Содержание
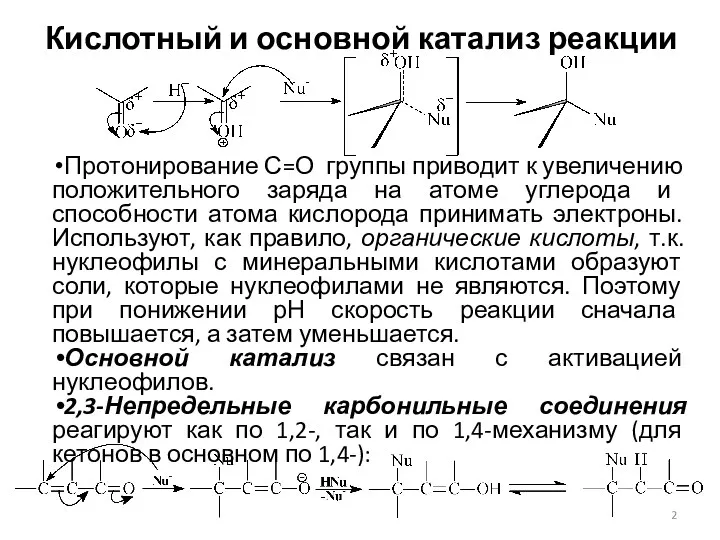
- 2. Кислотный и основной катализ реакции Протонирование С=О группы приводит к увеличению положительного заряда на атоме углерода
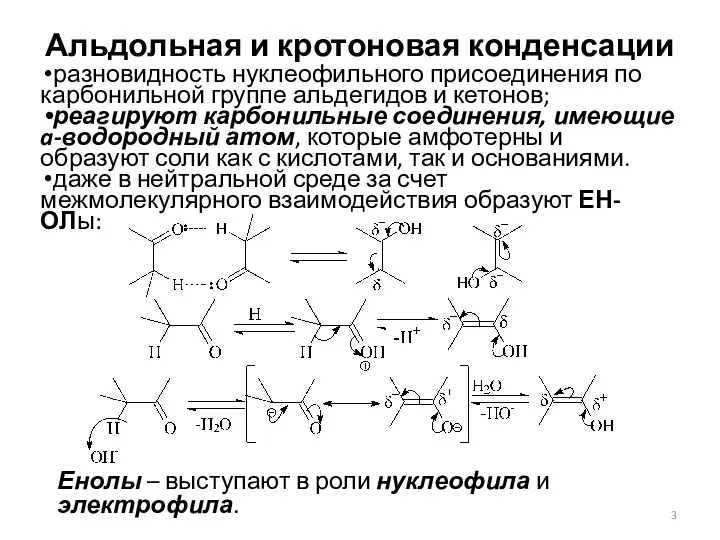
- 3. Альдольная и кротоновая конденсации разновидность нуклеофильного присоединения по карбонильной группе альдегидов и кетонов; реагируют карбонильные соединения,
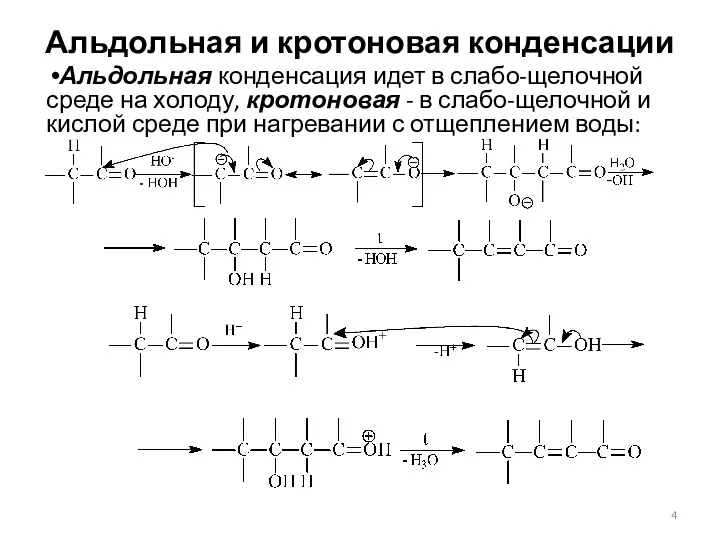
- 4. Альдольная и кротоновая конденсации Альдольная конденсация идет в слабо-щелочной среде на холоду, кротоновая - в слабо-щелочной
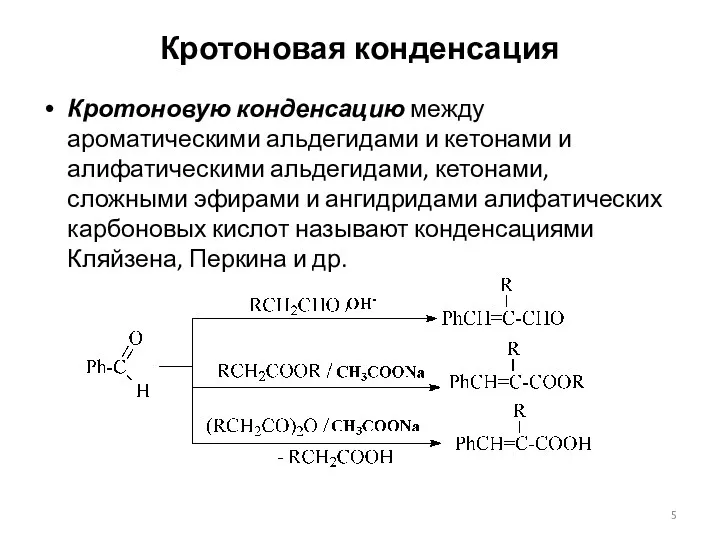
- 5. Кротоновая конденсация Кротоновую конденсацию между ароматическими альдегидами и кетонами и алифатическими альдегидами, кетонами, сложными эфирами и
- 6. Взаимодействия нуклеофила с ацильными соединениями (SNAE) Реакционная способность ацильных соединений зависит от величины положительного заряда и
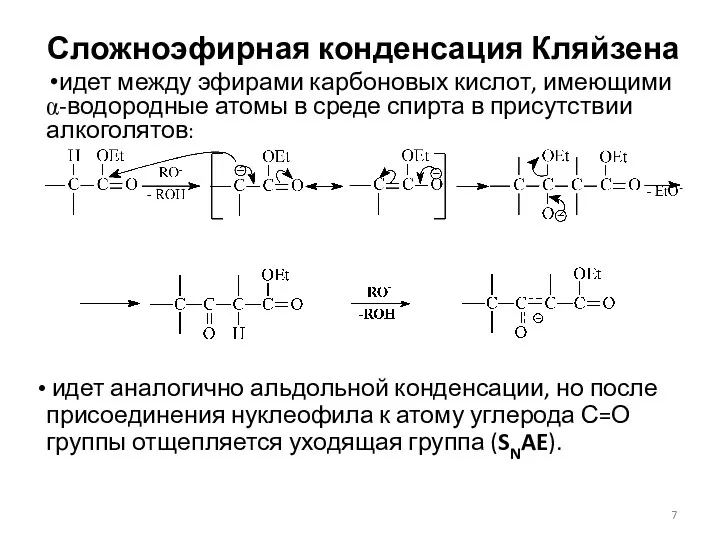
- 7. Сложноэфирная конденсация Кляйзена идет между эфирами карбоновых кислот, имеющими α-водородные атомы в среде спирта в присутствии
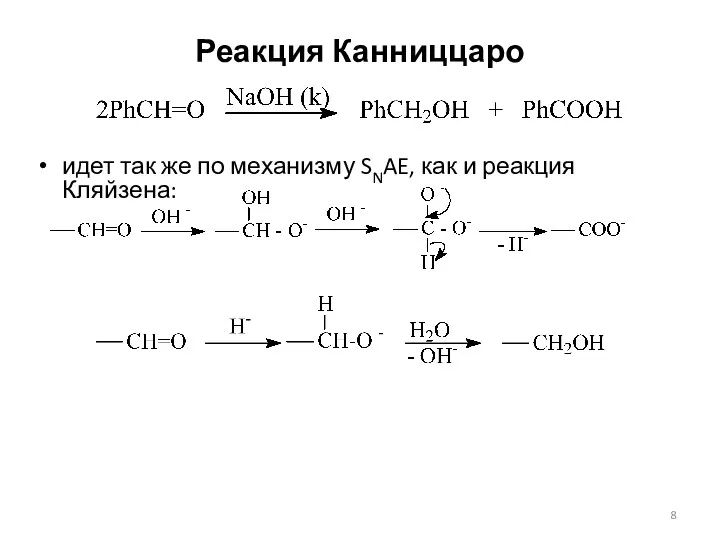
- 8. Реакция Канниццаро идет так же по механизму SNAE, как и реакция Кляйзена:
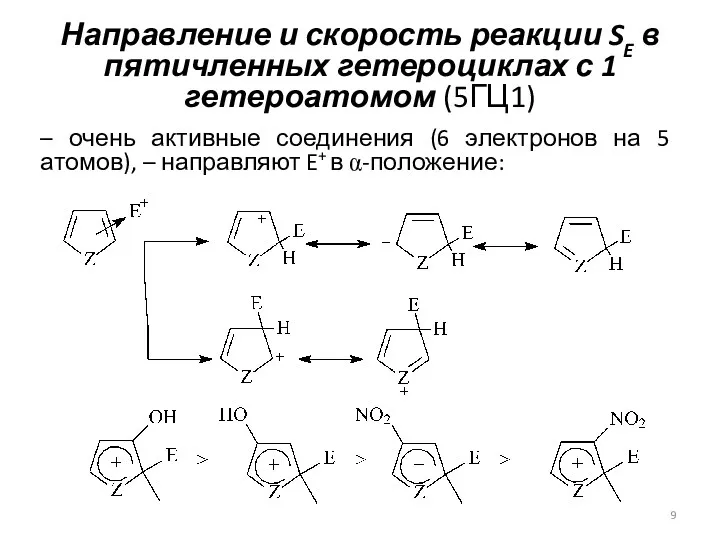
- 9. Направление и скорость реакции SE в пятичленных гетероциклах с 1 гетероатомом (5ГЦ1) – очень активные соединения
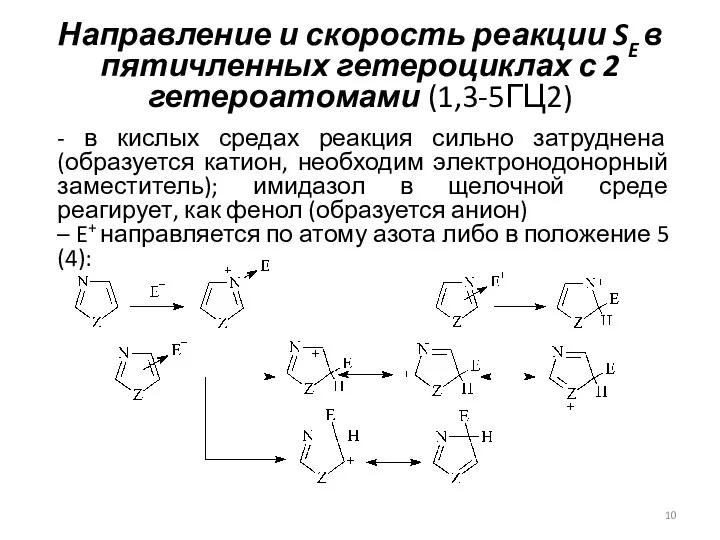
- 10. Направление и скорость реакции SE в пятичленных гетероциклах с 2 гетероатомами (1,3-5ГЦ2) - в кислых средах
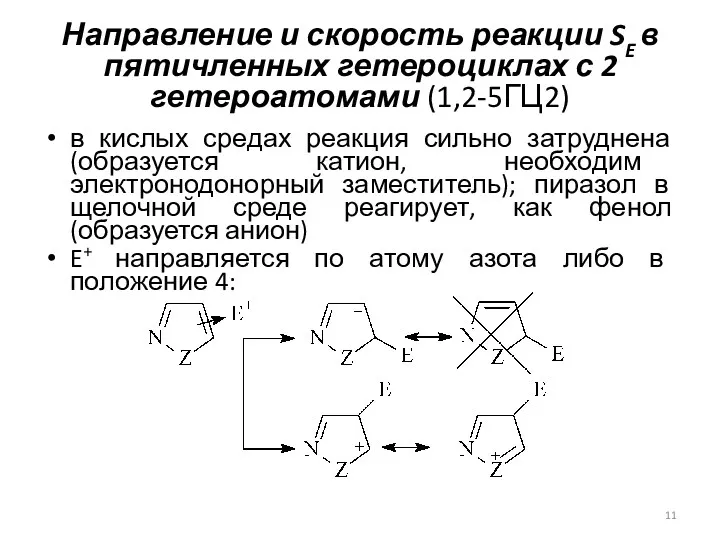
- 11. Направление и скорость реакции SE в пятичленных гетероциклах с 2 гетероатомами (1,2-5ГЦ2) в кислых средах реакция
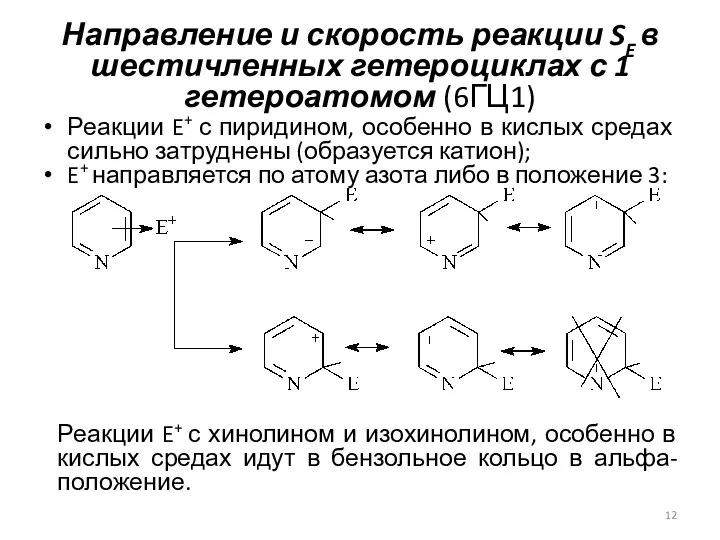
- 12. Направление и скорость реакции SE в шестичленных гетероциклах с 1 гетероатомом (6ГЦ1) Реакции E+ с пиридином,
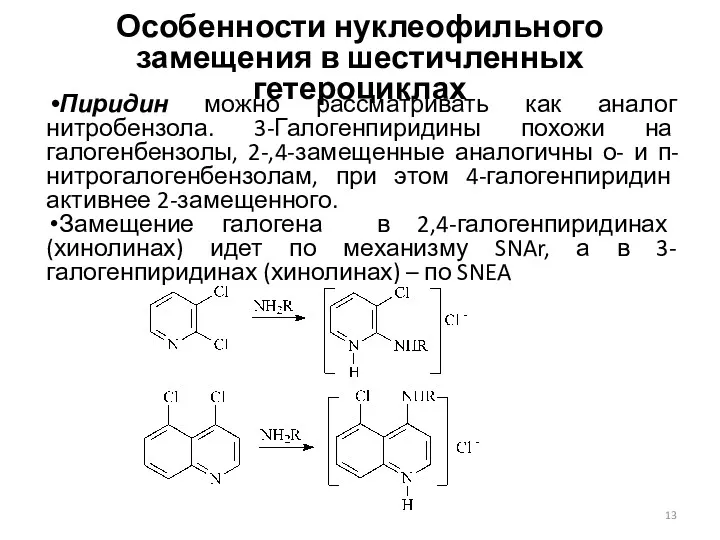
- 13. Особенности нуклеофильного замещения в шестичленных гетероциклах Пиридин можно рассматривать как аналог нитробензола. 3-Галогенпиридины похожи на галогенбензолы,
- 15. Скачать презентацию

 Относительная атомная масса. Знаки химических элементов
Относительная атомная масса. Знаки химических элементов Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи
Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів c0198e3edf1db804a5527004a7864ed1
c0198e3edf1db804a5527004a7864ed1 5.Алкины
5.Алкины Классификация и свойства оксидов
Классификация и свойства оксидов Моделирование структуры биомакромолекул
Моделирование структуры биомакромолекул Химия. ЕГЭ. Задание № 32
Химия. ЕГЭ. Задание № 32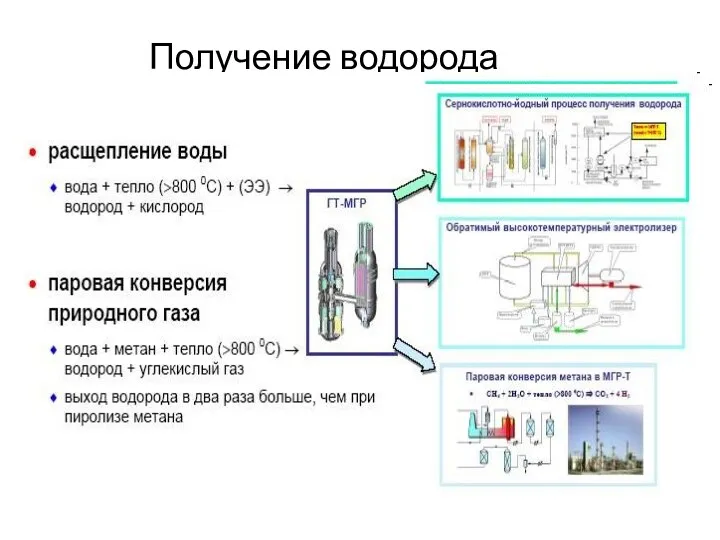 Получение водорода
Получение водорода Алкадиены. Циклоалканы. Лекция № 5
Алкадиены. Циклоалканы. Лекция № 5 Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага
Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага Алюминий и его соединения
Алюминий и его соединения Свойства кислот
Свойства кислот Алгоритм определения вида связи по формуле вещества
Алгоритм определения вида связи по формуле вещества Щелочноземельные металлы
Щелочноземельные металлы Сағыз пайдалы ма, әлде зиян ба?
Сағыз пайдалы ма, әлде зиян ба? Пищевые добавки
Пищевые добавки Свойства минералов Лекция 3
Свойства минералов Лекция 3 Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ
Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ Галогены. Строение атомов фтора и хлора
Галогены. Строение атомов фтора и хлора Органическая химия
Органическая химия Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1 Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию Единый государственный экзамен Химия 2021. Задание 3
Единый государственный экзамен Химия 2021. Задание 3 Водородная связь
Водородная связь Металлы подгруппы железа Fe, Co, Ni
Металлы подгруппы железа Fe, Co, Ni Бензин: догадкии реальность
Бензин: догадкии реальность