Содержание
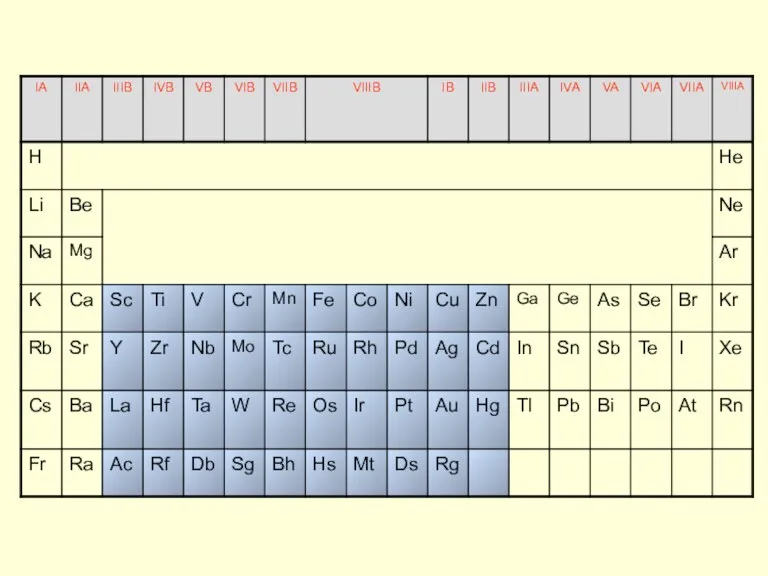
- 3. d-Элементы
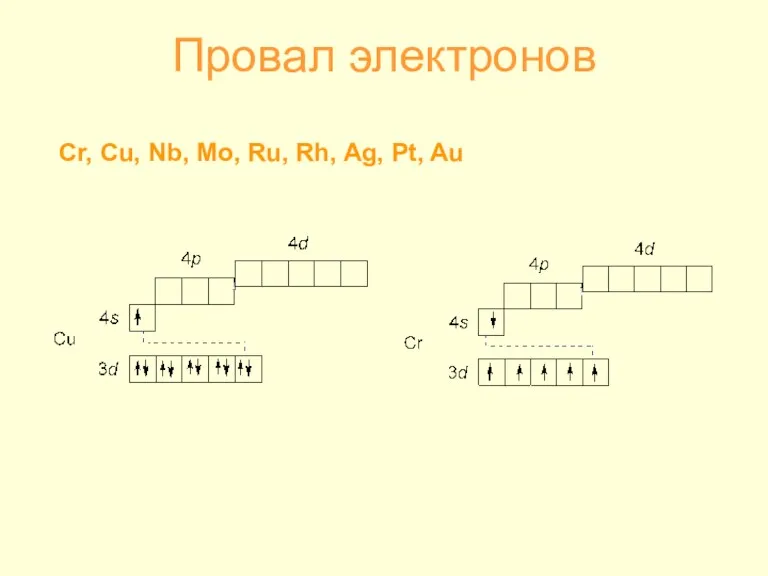
- 4. Провал электронов Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au
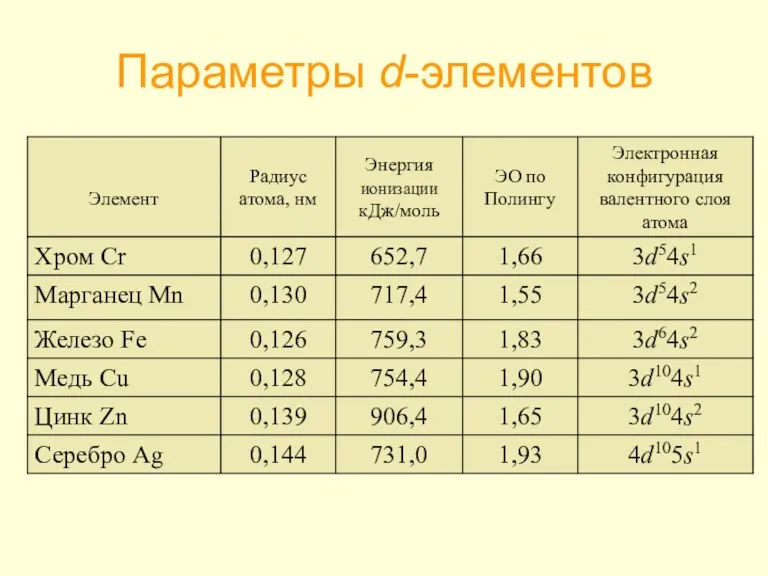
- 5. Параметры d-элементов
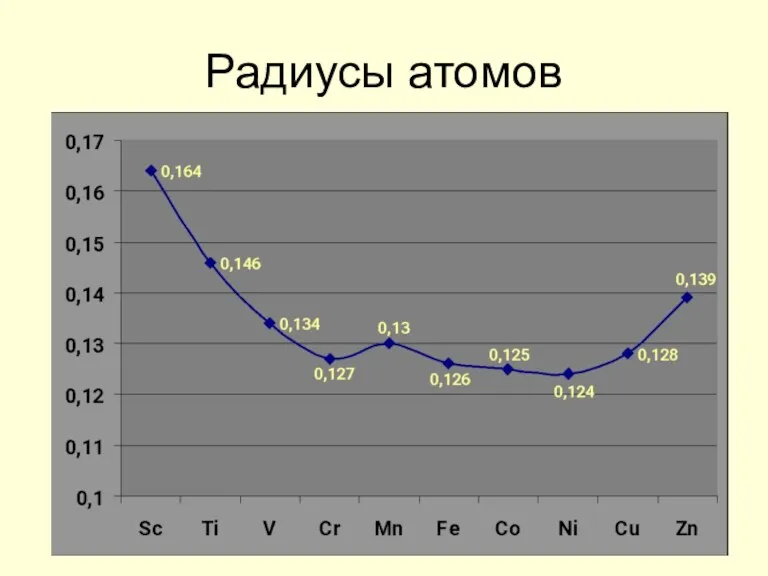
- 6. Радиусы атомов
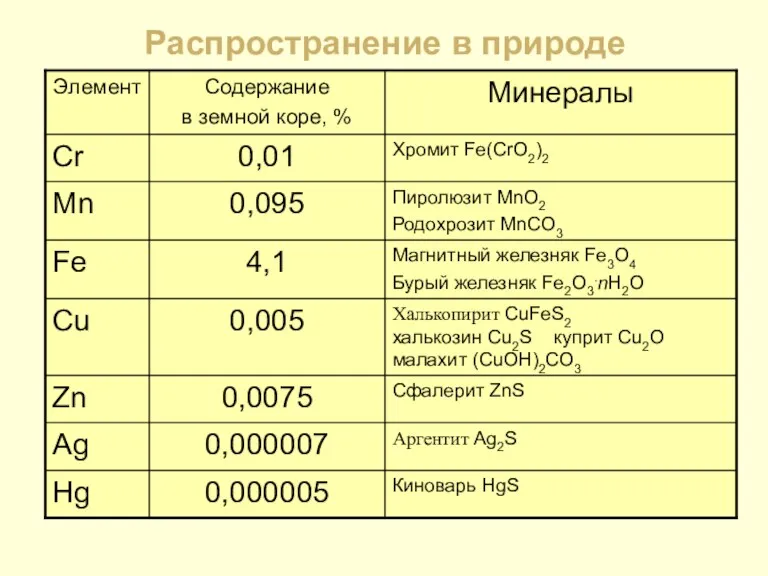
- 7. Распространение в природе
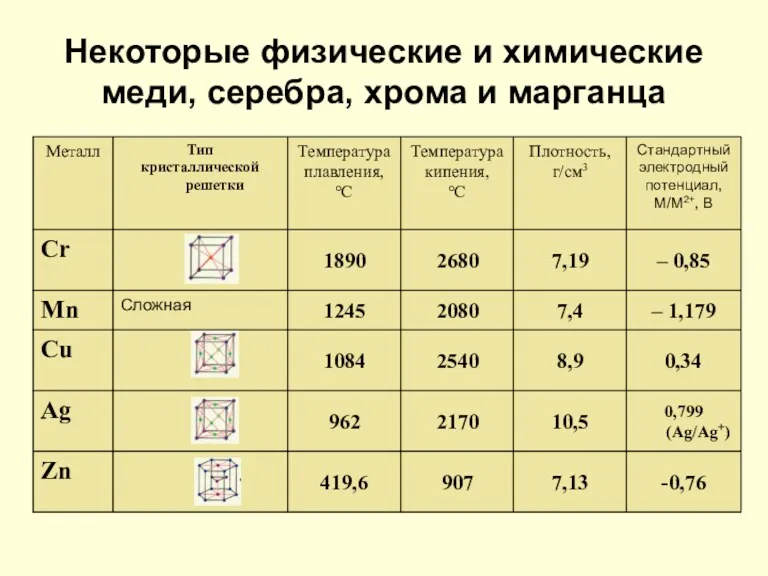
- 8. Некоторые физические и химические меди, серебра, хрома и марганца
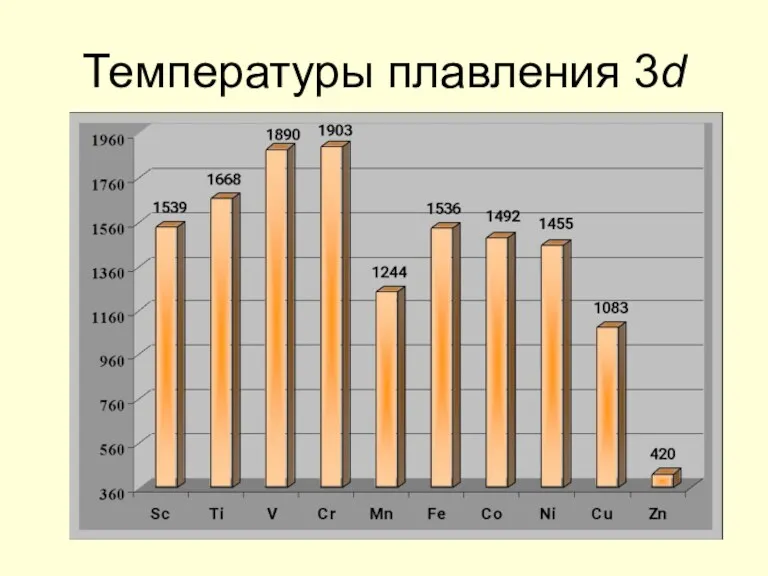
- 9. Температуры плавления 3d
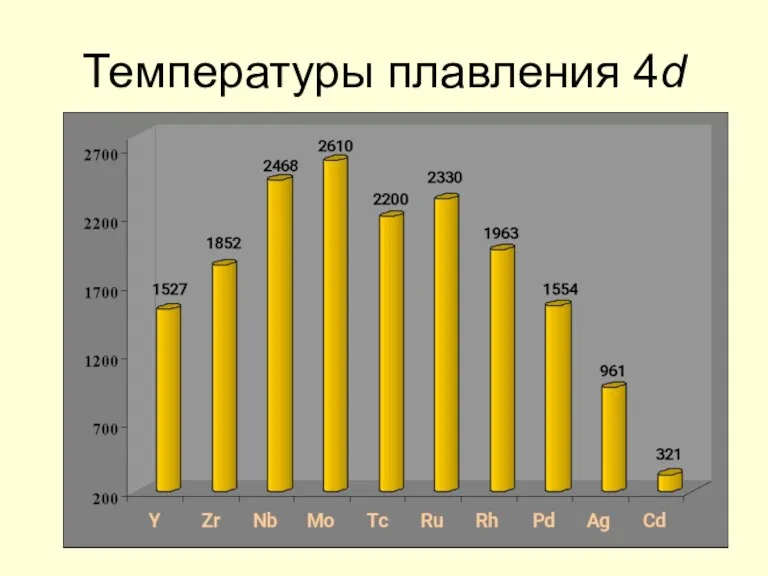
- 10. Температуры плавления 4d
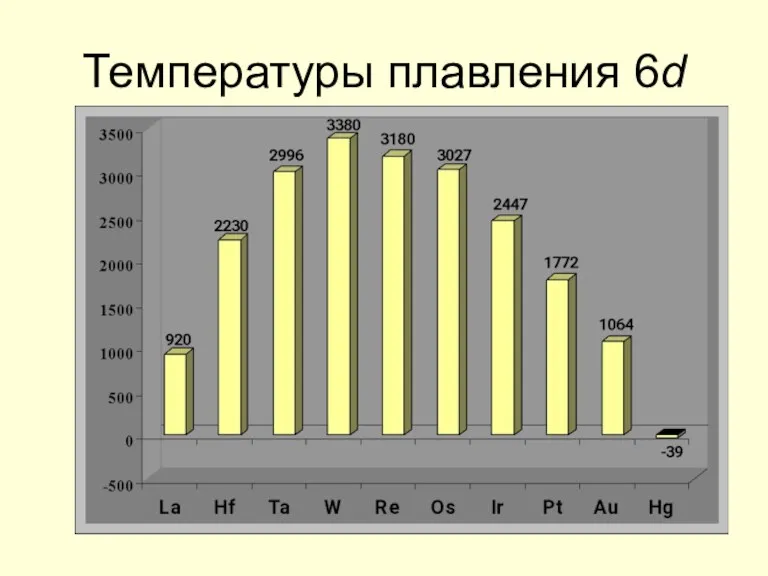
- 11. Температуры плавления 6d
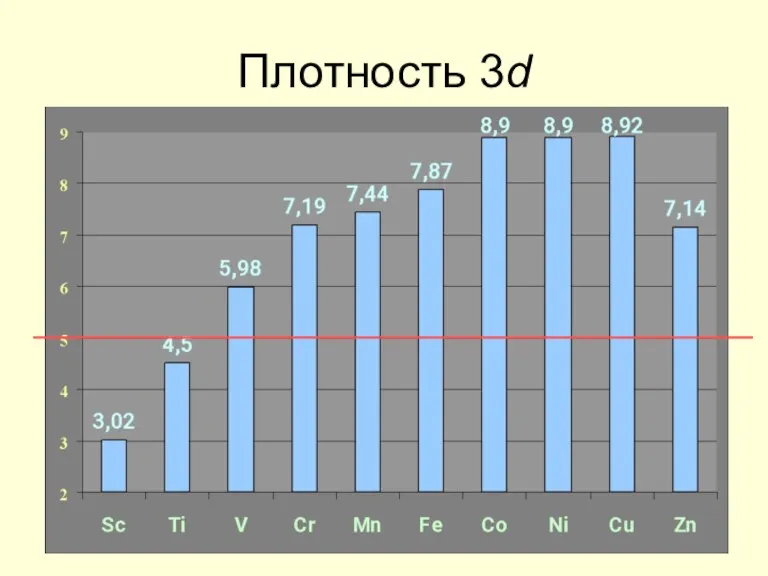
- 12. Плотность 3d
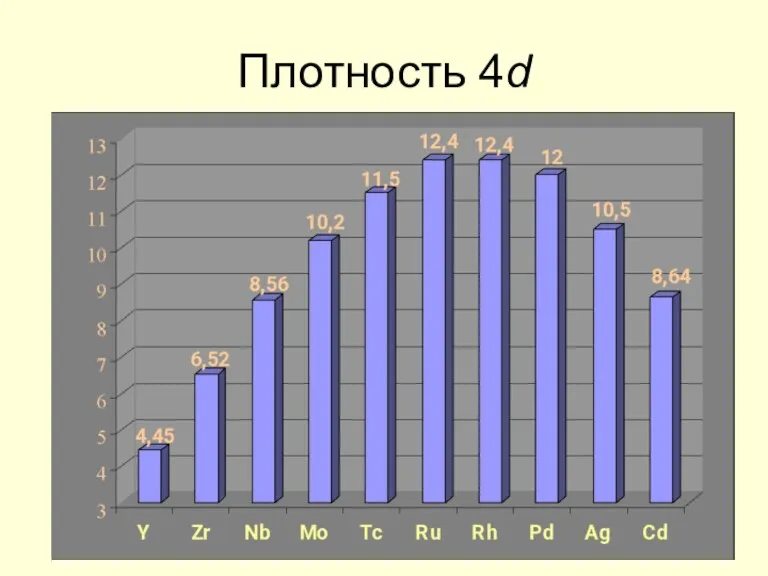
- 13. Плотность 4d
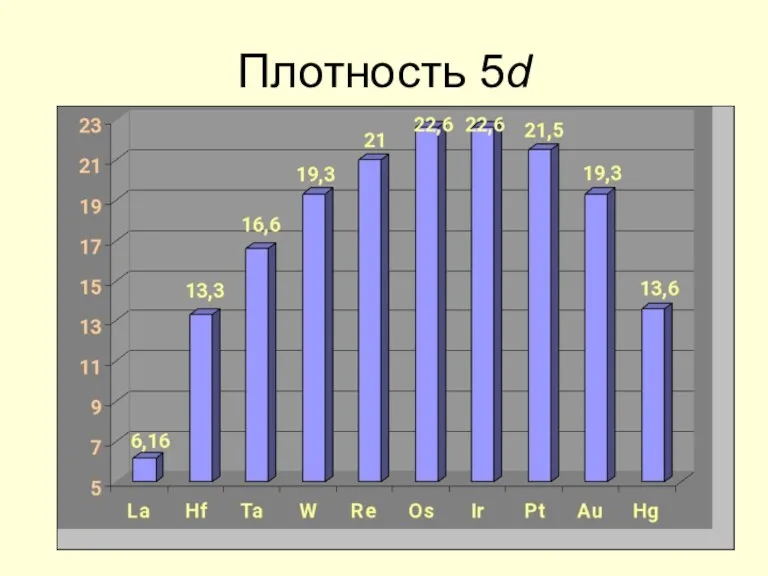
- 14. Плотность 5d
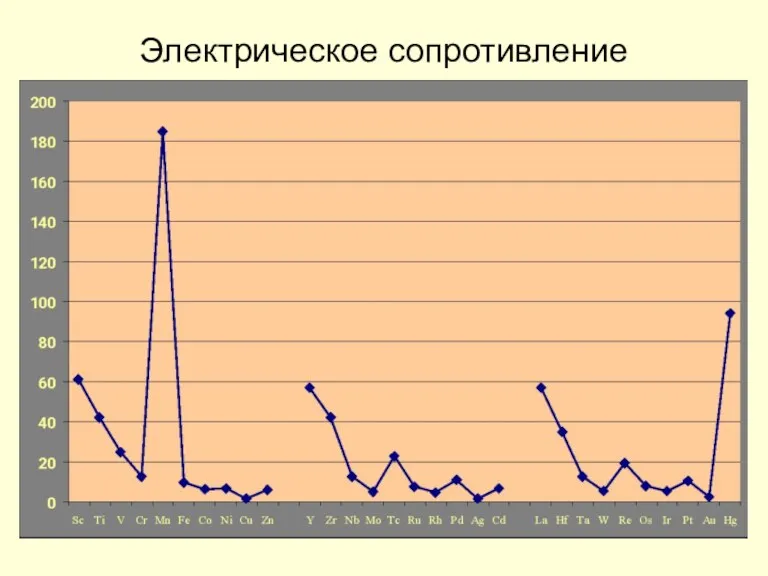
- 15. Электрическое сопротивление
- 16. Химические свойства меди 2Cu + O2 = 2CuO. Cu + Cl2 = CuCl2 2Cu + S
- 17. Химические свойства цинка Zn + H2O (пар) = ZnO + H2 Zn + 2HCl = ZnCl2
- 18. Химические свойства хрома Cr + H2SO4 (разб.) = CrSO4 + H2↑ 4Cr (порошок) + 3O2 =
- 19. Химические свойства марганца Mn + Cl2 = MnCl2 Mn + O2 = MnO2 Mn + S
- 20. Химические свойства серебра 2Ag + Cl2 = 2AgCl 2Ag + S = Ag2S. 2Ag + 2H2SO4
- 21. Химические свойства ртути 2Hg + 2H2SO4 = Hg2SO4 + SO2 + 2H2O Hg + 2H2SO4 =
- 22. Соединения меди Cu(OH)2 + 2H+ = Cu2+ + 2H2O Cu(OH)2 + 2OH– = [Cu(OH)4]2– Сульфат меди(II)
- 23. Соединения серебра Оксид серебра Ag2O. Твердое вещество темно-коричневого цвета, при нагревании разлагается. Аммиачный раствор оксида серебра
- 24. Соединения хрома Cr(OH)2 + 2H+ = Cr2+ + 2H2O 4CrCl2 + 4HCl + O2 = 4CrCl3
- 25. Соединения марганца MnCO3 = MnO + CO2↑ MnO2 + H2 = MnO + H2O MnO +
- 26. Окислительные свойства перманганата 2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O 2KMnO4 +
- 27. Применение
- 29. Скачать презентацию













 Товары бытовой химии
Товары бытовой химии Алкадиены
Алкадиены Основания, их классификация и свойства в свете ТЭД
Основания, их классификация и свойства в свете ТЭД Separation amp confirmation
Separation amp confirmation Магний и кальций
Магний и кальций Характеристика химических элементов IV группы, главной подгруппы. Углерод
Характеристика химических элементов IV группы, главной подгруппы. Углерод Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости
Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости Метаморфические породы
Метаморфические породы Высокомолекулярные соединения (синтетическое волокно капрон)
Высокомолекулярные соединения (синтетическое волокно капрон) Биологически важные окислительно-восстановительные реакции органических соединений
Биологически важные окислительно-восстановительные реакции органических соединений Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Электроотрицательность. Ковалентная полярная связь. (Тема 12)
Электроотрицательность. Ковалентная полярная связь. (Тема 12) Строительное материаловедение. Лекция 1
Строительное материаловедение. Лекция 1 Кристаллография и основы кристаллохимии
Кристаллография и основы кристаллохимии Получение кислот
Получение кислот Фенол. Фізичні та хімічні властивості
Фенол. Фізичні та хімічні властивості Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция
Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева
Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева Теоретические основы органической химии
Теоретические основы органической химии Алюминий и его соединения. Характеристика химического элемента: 3-й период, 3-я А подгруппа
Алюминий и его соединения. Характеристика химического элемента: 3-й период, 3-я А подгруппа Утворення асимілятів та їхнє перетворення
Утворення асимілятів та їхнє перетворення Феноли (бензенол)
Феноли (бензенол) Свойства фосфора
Свойства фосфора Значення хімії у розв’ язанні енергетичної проблеми
Значення хімії у розв’ язанні енергетичної проблеми Признаки химических реакций. Урок химии в 8 классе
Признаки химических реакций. Урок химии в 8 классе Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения