Содержание
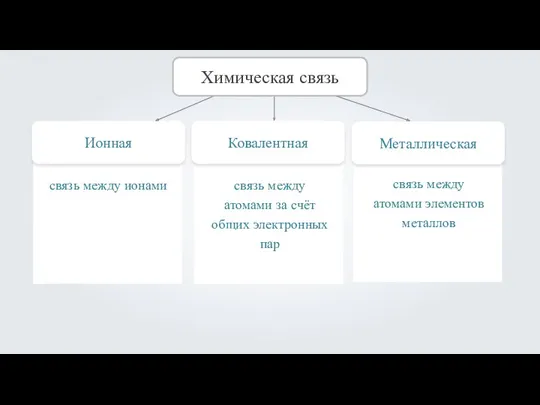
- 2. Ионная Химическая связь Ковалентная Металлическая
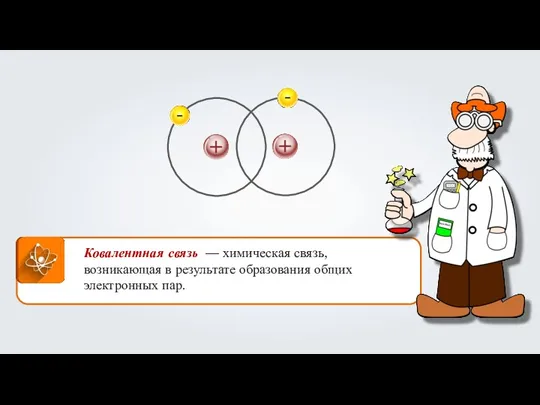
- 3. Ковалентная связь — химическая связь, возникающая в результате образования общих электронных пар.
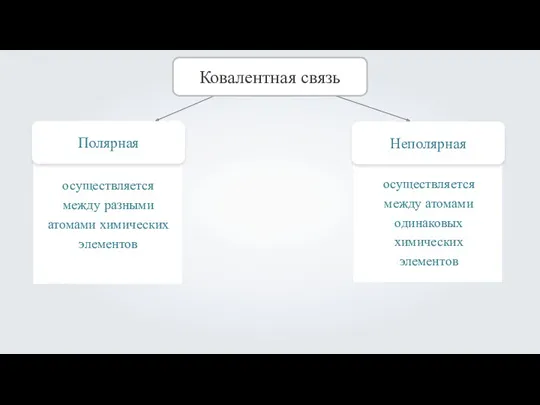
- 4. Полярная Ковалентная связь Неполярная
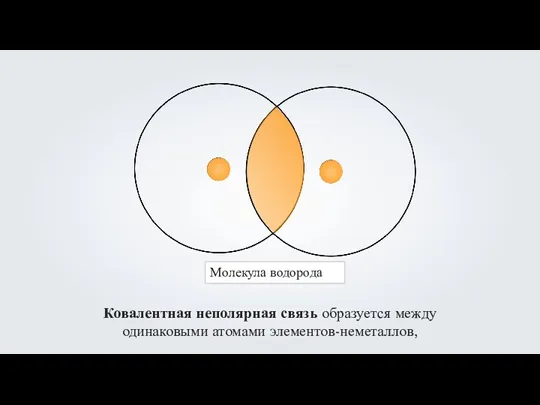
- 5. Молекула водорода Ковалентная неполярная связь образуется между одинаковыми атомами элементов-неметаллов,
- 6. Полярная ковалентная связь может образовываться только между атомами разных элементов-неметаллов. фтороводород НF
- 7. Молекула фторводорода H1 1S1 F9 1S2 / 2S2 2p5 H F Неспаренный электрон Неспаренный электрон
- 8. H F + → H F
- 9. Электроотрицательность — это способность атомов химического элемента смещать к себе общие электронные пары, участвующие в образовании
- 10. F→ O→ N → CI → Br → I → S → C → Si →P
- 11. H F + → H F F→ O→ N → CI → Br → I →
- 12. H F + → H F + - Частичный заряд, приобретаемый атомами, обозначается латинской буквой «дельта»
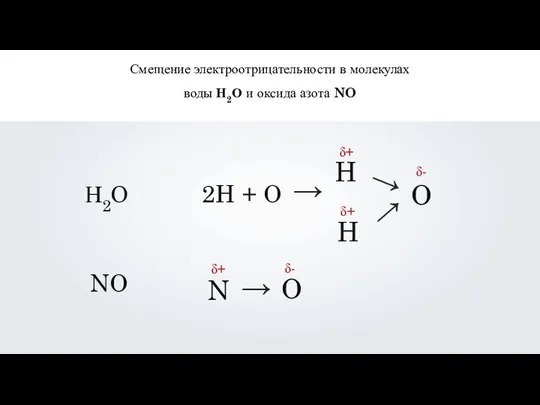
- 13. Смещение электроотрицательности в молекулах воды Н2О и оксида азота NO Н2О NO 2H + O →
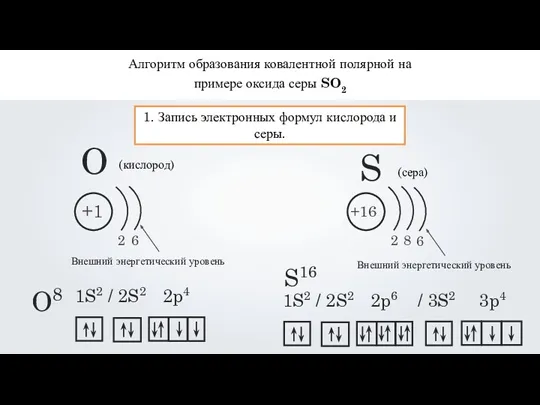
- 14. Алгоритм образования ковалентной полярной на примере оксида серы SO2 1. Запись электронных формул кислорода и серы.
- 15. Алгоритм образования ковалентной полярной на примере оксида серы SO2 2. Изображение расположения внешних электронов у знаков
- 16. Алгоритм образования ковалентной полярной на примере оксида серы SO2 3. Запись электронно-структурной формулы образовавшейся молекулы оксида
- 17. Алгоритм образования ковалентной полярной на примере оксида серы SO2 3. Определение по рассмотренному нами ранее химическому
- 18. Валентность — это число ковалентных связей, которыми атом одного химического элемента связан с атомами этого же
- 19. Аммиак NH3 NIIIHI Вода H2O HIOII Оксид фосфора P2O5 PVOII Запись валентности
- 20. Если валентность обоих элементов кратна какому-нибудь числу, то индексы записываются, уменьшенными на это число. SO3 S2O6
- 21. Al III S II S VI S IV
- 22. По формуле также можно определить валентность одного элемента, если валентность другого известна. SO2 II ? 4
- 24. Скачать презентацию


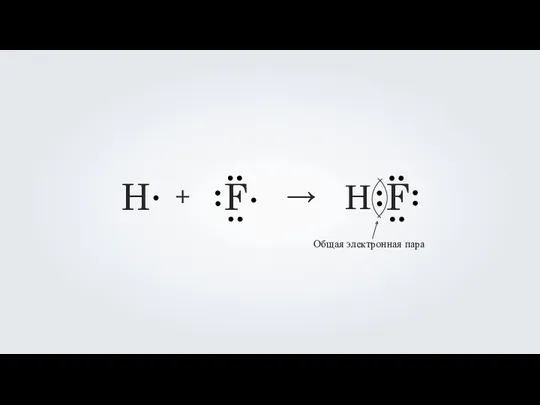


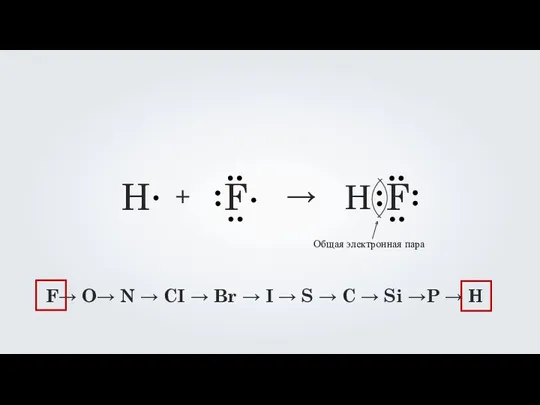









 Синтетический каучук и его применение
Синтетический каучук и его применение Трансмиссионные масла
Трансмиссионные масла 20230816_belki_2
20230816_belki_2 Геохимия урана и тория в магматическом процессе
Геохимия урана и тория в магматическом процессе Вуглеводи
Вуглеводи Ртуть
Ртуть Единый государственный экзамен Химия 2021. Задание 3
Единый государственный экзамен Химия 2021. Задание 3 Химия нефти и газа
Химия нефти и газа Indicatori di pH
Indicatori di pH Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Серная кислота
Серная кислота Александр Евгеньевич Ферсман
Александр Евгеньевич Ферсман Метал конструкциялық материалдар
Метал конструкциялық материалдар Місце хімії серед наук про природу
Місце хімії серед наук про природу Оксид углерода II. Угарный газ
Оксид углерода II. Угарный газ Углерод, как химический элемент и простое вещество
Углерод, как химический элемент и простое вещество Получение Н2, О2, щелочей
Получение Н2, О2, щелочей Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері Химия элементов VIIA группы
Химия элементов VIIA группы Химия и проблемы охраны окружающей среды
Химия и проблемы охраны окружающей среды Классы органических соединений
Классы органических соединений Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10)
Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10) Формы парфюмерно-косметической продукции
Формы парфюмерно-косметической продукции Химические процессы зоны гипергенеза
Химические процессы зоны гипергенеза Состав и классификация магматических горных пород
Состав и классификация магматических горных пород Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Химия нефти и газа. Лекция № 1
Химия нефти и газа. Лекция № 1 Зависят ли свойства предельных одноатомных спиртов от их химического строения?
Зависят ли свойства предельных одноатомных спиртов от их химического строения?