Слайд 2

Состав
Классификация
Применение
Химические свойства растворимых оснований
Химические свойства нерастворимых оснований
Получение оснований
Слайд 3
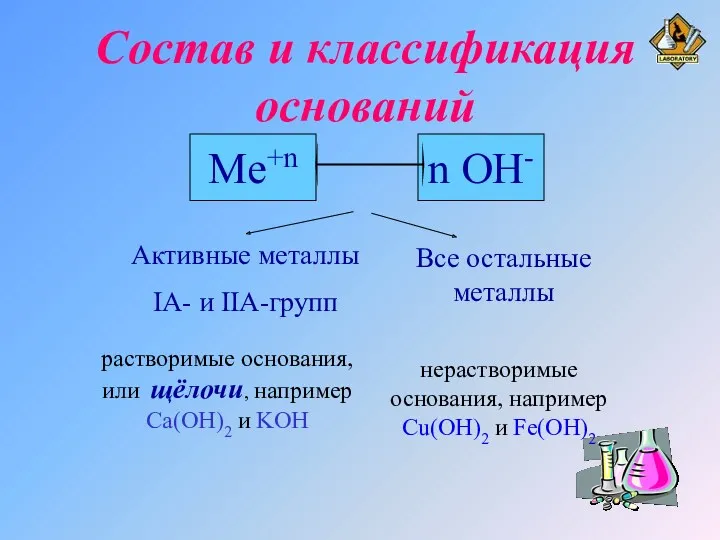
Состав и классификация оснований
Слайд 4

Классификация оснований по степени ЭД
Слабые (α→0) нерастворимые основания, водный раствор NH3·
H2O
Сильные (α→1)
щёлочи
Слайд 5

Классификация оснований по кислотности (числу гидроксогрупп)
Однокислотные
NaOH, KOH
Двухкислотные
Fe(OH)2 , Cu(OH)2
Слайд 6

Слайд 7

Химические свойства растворимых оснований
Основания изменяют окраску индикаторов:
Фенолфталеин → малиновый
Метиловый оранжевый →
жёлтый
Универсальный → синий
Лакмус → синий
Причина: образование одинаковых
ионов при диссоциации
NaOH → Na+ + OH- ; KOH → K + + OH-
Слайд 8

Химические свойства растворимых оснований
Основание + кислота → соль + вода
Реакция нейтрализации
2NaOH + H2SO4 → Na2SО4 + 2H2O
2Na ++ 2OH - + 2H + + SO42- → 2Na ++ SO42-+ 2H2O;
H ++ OH - → H2O;
Слайд 9

Химические свойства
растворимых оснований
Основание + кислотный оксид → соль + вода
S+4O2
→ H2 S+4O3 → Na2 S+4O3
2NaOH + SO2 → Na2 SO3 + H2O;
2Na++2OH -+SO2→2Na++SO32-+H2O;
SO2+2OH -→SO32-+H2O
Слайд 10

Химические свойства
растворимых оснований
Основание + соль → новая соль + новое
основание
NH3↑
NaOH + NH4Cl →Na Cl + NH4OH
H2O
Na ++ OH -+ NH4+ + Cl - →Na ++ Cl -+ NH3 ↑+ H2O
NH4+ + OH - → NH3 ↑+H2O
( если образуется ↑ или ↓)
Слайд 11

Химические свойства нерастворимых оснований
Основание + кислота →соль + вода
Cu(OH)2+ H2 SO4 →
Cu SO4 + 2H2O ;
Cu(OH)2+ 2 H + + SO4 2- → Cu 2+ + SO4 2- + 2H2O;
Cu(OH)2+ 2H + → Cu 2++ 2H2O
При нагревании разлагаются с образованием соответствующего оксида металла и воды
Fe+3(OH)3 → Fe2+3O3 ; Fe+2(OH)2→Fe+2O
Cu(OH)2 → CuO + 2H2O
Слайд 12

Получение
НЕРАСТВОРИМЫХ ОСНОВАНИЙ
Соль + растворимое основание → основание + новая соль
CuCl2
+ 2NaOH → 2NaCl + Cu(OH)2 ↓
Cu2+ +2Cl -+2Na ++2OH -→2Na ++2Cl -+ Cu(OH)2↓
Cu2++ 2OH -→ Cu(OH)2↓
Слайд 13

Получение
РАСТВОРИМЫХ ОСНОВАНИЙ
а) Активный металл + вода → основание + водород
2Na
+ 2H2O → 2NaOH + H2 ↑
б) Оксид активного металла + вода → основание
Na2O + H2O → 2NaOH
Слайд 14
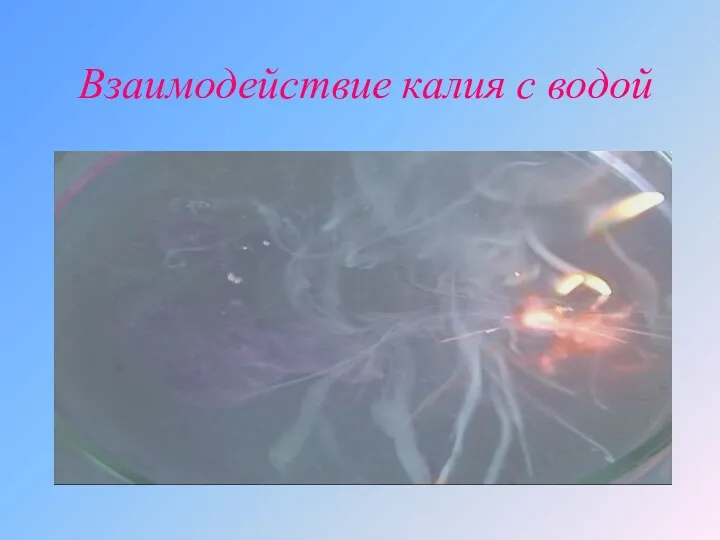
Взаимодействие калия с водой













 Полимерные материалы, пластмассы и изделия из них
Полимерные материалы, пластмассы и изделия из них Видалення забруднень органічного походження з поверхні тканини
Видалення забруднень органічного походження з поверхні тканини Сильные и слабые электролиты. Степень диссоциации
Сильные и слабые электролиты. Степень диссоциации Электрометрические методы анализа ЛВ. Термографические методы
Электрометрические методы анализа ЛВ. Термографические методы Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Химическая термодинамика. Термохимия. Лекция 6
Химическая термодинамика. Термохимия. Лекция 6 Aluminium
Aluminium Хром, марганец
Хром, марганец Полимеры. Мономер
Полимеры. Мономер Генетическая связь неорганических соединений (8 класс)
Генетическая связь неорганических соединений (8 класс) Сероводород и его свойства
Сероводород и его свойства Современные методы образования амидной связи с использованием ацилгалогенидов, ангидридов, активированных эфиров и их аналогов
Современные методы образования амидной связи с использованием ацилгалогенидов, ангидридов, активированных эфиров и их аналогов Индикаторы окислительно-восстановительного титрования. Их применение в анализе
Индикаторы окислительно-восстановительного титрования. Их применение в анализе Массовая доля вещества в растворе
Массовая доля вещества в растворе Строение атома. 8 класс
Строение атома. 8 класс Изомеризация пентан-гексановой фракции
Изомеризация пентан-гексановой фракции Карбоновые кислоты
Карбоновые кислоты Петрография некоторых распространенных метаморфических пород
Петрография некоторых распространенных метаморфических пород Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары
Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары Кислород. Промышленный способ (перегонка жидкого воздуха)
Кислород. Промышленный способ (перегонка жидкого воздуха) Количество вещества. 8 класс
Количество вещества. 8 класс Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05)
Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05) Електролітична дисоціація. Гідроліз солей
Електролітична дисоціація. Гідроліз солей Вода
Вода Аминокислоты и белки
Аминокислоты и белки Аминокислоты
Аминокислоты Химические элементы
Химические элементы