Слайд 2

Химический знак – H
Относительная атомная
масса Ar (H) = 1, 008
Химическая
формула – H2
Относительная молекулярная
масса Mr (H2) = 2, 016
В соединениях водород одновалентен
Слайд 3

История открытия
Водород
(Hudrogenium)
был открыт в первой половине XVI века немецким
врачом и естествоиспытателем Парацельсом.
Слайд 4

В 1766 г.
Генри Кавендиш (Англия)
установил свойства водорода
и указал
его отличия от других газов
Слайд 5

Французский химик Антуан Лавуазье
доказал и обратное: получил «горючий газ» из
воды. Он дал новому газу и другое имя – водород (рождающий воду)
Слайд 6

Водород
является самым распространенным химическим элементом во Вселенной, он является главной
составной частью Солнца, а также многих звезд.
Слайд 7

Распространенность в природе
Слайд 8

Водород
занимает первое место в периодической системе химических элементов
Д.И. Менделеева,
имеет простейшее строение атома: ядро атома окружено электронным облаком
Слайд 9

Получение водорода в промышленности
В основном получают из природного газа путем
конверсии ( превращения) под действием водяных паров и катализатора:
CH4 + 2H2O 4H2 + CO2
Нагревание:
CH4 2H2 + C
3. Разложение воды под действием электрического тока:
2H2O 2H2 + O2
4.В промышленности водород получают, пропуская водяные пары над раскаленным углем:
C + H2O CO + H2
Слайд 10

Получение водорода в лаборатории
1.Взаимодействие металлов с кислотами:
Zn +2HCl → ZnCl2 +H2↑
2.Взаимодействие активных
металлов с водой:
2Na + 2HOH 2NaOH + H2
3.Разложение воды под действием постоянного электрического тока:
2H2O 2H2 + O2
Слайд 11
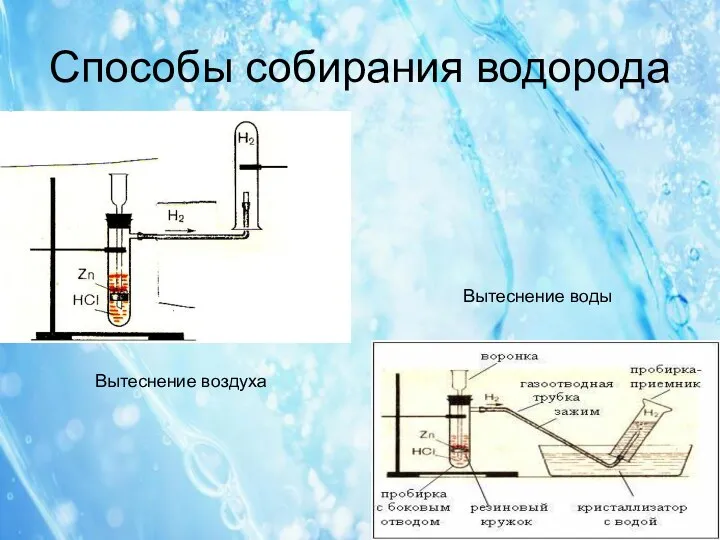
Способы собирания водорода
Вытеснение воды
Вытеснение воздуха
Слайд 12

Физические свойства
1.Бесцветный газ
2.Без запаха
3.Без вкуса
4.Легче воздуха в 14,5 раза
5.Плохо растворим
в воде
Слайд 13

Химические свойства
1.Взаимодействие с кислородом
2H2 + O2 = 2H2O
2.Взаимодействие с
серой
H2 + S = H2S
3.Взаимодействие с оксидами металлов
CuO + H2 = Cu + H2O
Слайд 14
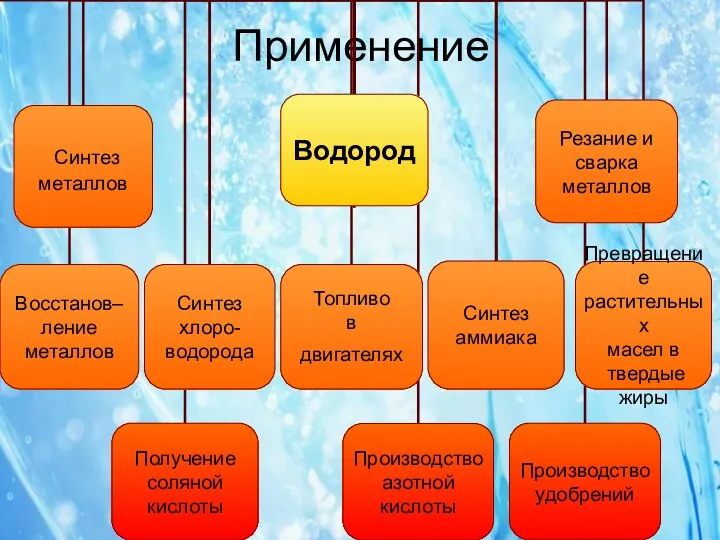
Слайд 15

Помимо полезных свойств водорода существует еще одно: из водорода можно
сделать оружие разрушительной силы. Это оружие называется водородная бомба. Взрыв водородной бомбы сопровождается выбросом большого количества радиоактивных веществ. Благодаря своей конструкции и механизму действия, водородная бомба может быть сделана какой угодно мощной. При этом она намного дешевле атомных бомб той же мощности.
Слайд 16

Водородные бомбы иногда сравнивают с солнцем. Однако солнце дарует нам жизнь,
а водородная бомба — сулит смерть...
Слайд 17

Водородная энергетика
В недалеком будущем основным источником получения энергии станет реакция горения
водорода. Водородная энергетика вытеснит традиционные источники получения энергии (уголь, нефть и др.)
Слайд 18

Водородные автомобили
В 1979 году
компания BMW выпустила первый автомобиль, вполне успешно
ездивший на водороде
Слайд 19

Toyota переходит на водород


















 Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги
Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз
Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз Органічні речовини в живій природі. Рівні структурної органшзації
Органічні речовини в живій природі. Рівні структурної органшзації Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Задачи на массовую долю растворённого вещества в растворе
Задачи на массовую долю растворённого вещества в растворе Щелочноземельные металлы Положение в периодической таблице
Щелочноземельные металлы Положение в периодической таблице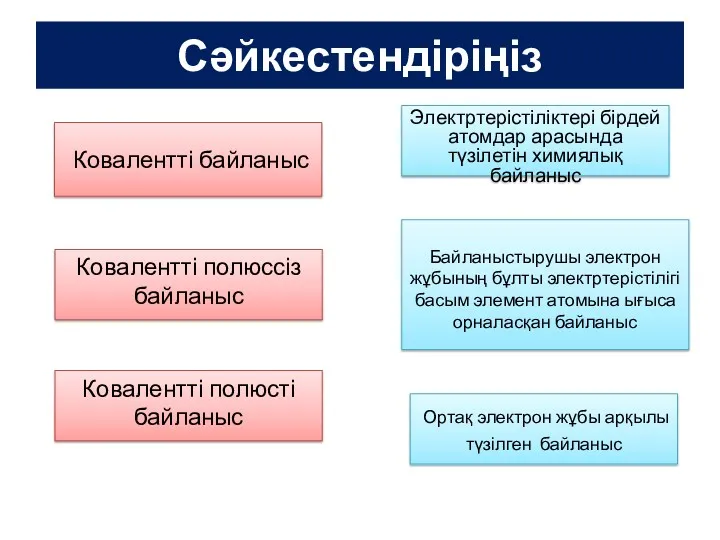 Иондық байланыс
Иондық байланыс Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Получение хлортетрациклина
Получение хлортетрациклина Элементы химической термодинамики
Элементы химической термодинамики Аминокислоты. Физические свойства. Химические свойства
Аминокислоты. Физические свойства. Химические свойства Индикаторные ошибки кислотно-основного титрования
Индикаторные ошибки кислотно-основного титрования Классификация, номенклатура, изомерия органических соединений
Классификация, номенклатура, изомерия органических соединений Все о чае
Все о чае Природные источники углеводородов, их переработка, применение и экологические проблемы
Природные источники углеводородов, их переработка, применение и экологические проблемы Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Хром, марганец
Хром, марганец Современные конструкционные материалы
Современные конструкционные материалы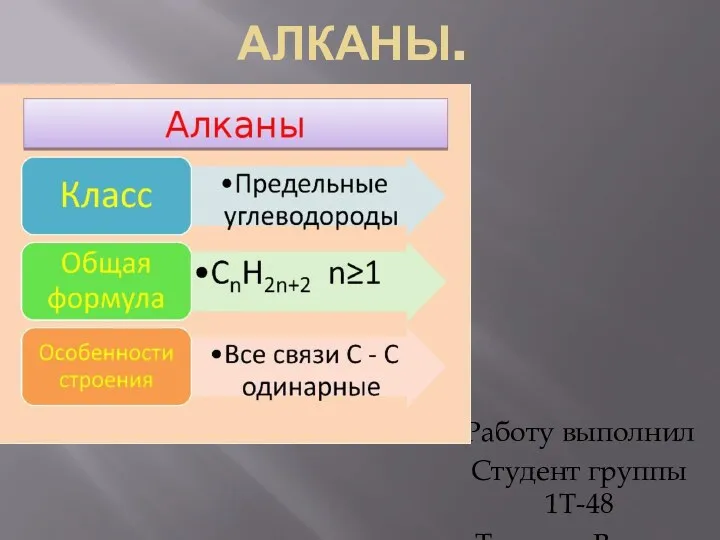 Алканы. Гомологический ряд и изомерия
Алканы. Гомологический ряд и изомерия Спирты. Виды спирта
Спирты. Виды спирта Классификация химических реакций
Классификация химических реакций Органические высокомолекулярные реагенты
Органические высокомолекулярные реагенты Закон сохранения массы. Химические уравнения
Закон сохранения массы. Химические уравнения химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя
химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін)
Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін) Одноатомные спирты
Одноатомные спирты Химическое производство (урок по химии в 11 классе)
Химическое производство (урок по химии в 11 классе)