Содержание
- 2. Термодинамика – это наука о превращениях одних видов энергии в другие. Химическая термодинамика рассматривает превращения энергии
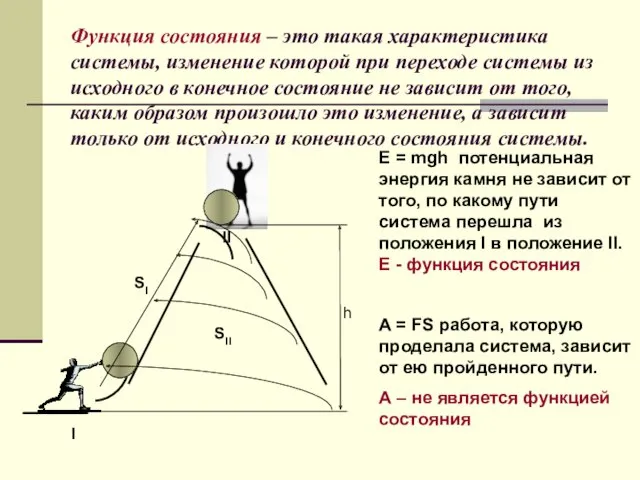
- 3. Функция состояния – это такая характеристика системы, изменение которой при переходе системы из исходного в конечное
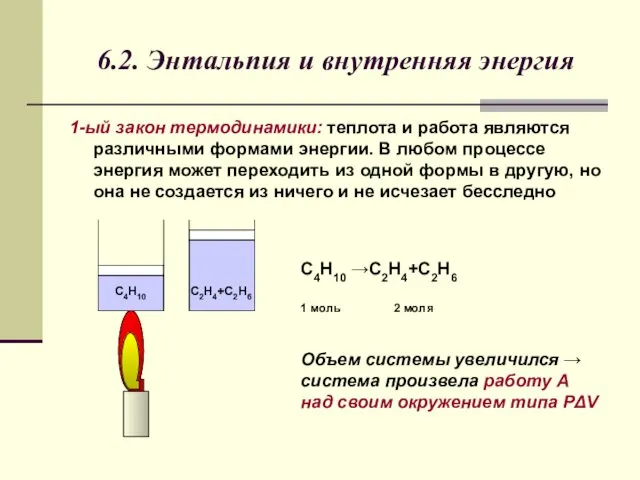
- 4. 6.2. Энтальпия и внутренняя энергия 1-ый закон термодинамики: теплота и работа являются различными формами энергии. В
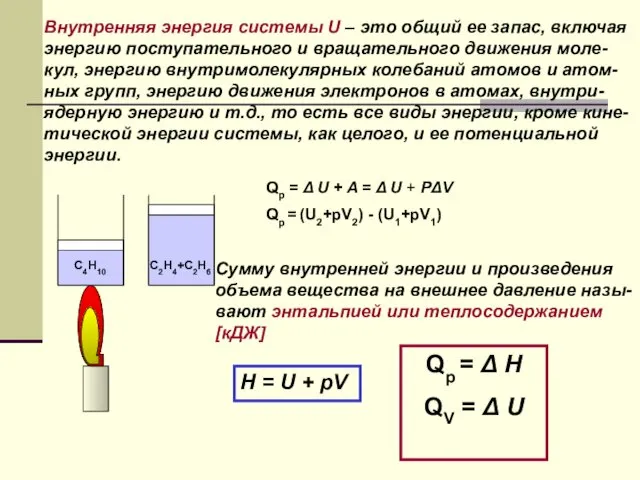
- 5. Qp = Δ U + A = Δ U + РΔV Qp = (U2+pV2) - (U1+pV1)
- 6. 6.3. Энергетика химических реакций Все химические реакции протекают либо с выделением, либо с поглощением теплоты. Количество
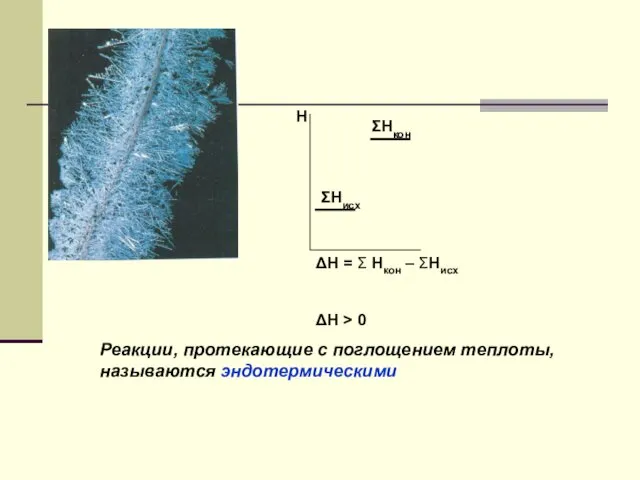
- 7. ΔН = Σ Нкон – ΣНисх ΔН > 0 Реакции, протекающие с поглощением теплоты, называются эндотермическими
- 8. Закон Гесса (Г.И.Гесс, 1840) 1802-1850 Тепловой эффект химического процесса зависит только от начального и конечного состояния
- 9. ΔH4 Стандартная энтальпия образования вещества ΔНo298 – тепловой эффект реакции образования одного моля вещества из простых
- 10. Следствие из закона Гесса Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций
- 11. Пример. Определить тепловой эффект реакции сгорания метана при стандартных условиях. Записываем термохимической уравнение реакции, лежащей в
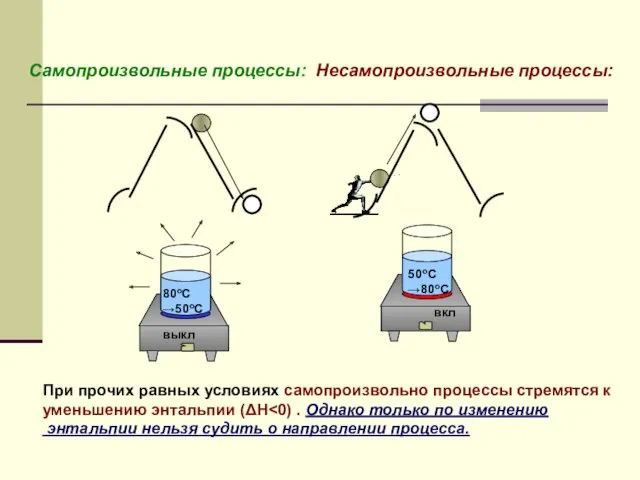
- 12. Самопроизвольные процессы: Несамопроизвольные процессы: При прочих равных условиях самопроизвольно процессы стремятся к уменьшению энтальпии (ΔН энтальпии
- 13. 6.4. Порядок и беспорядок в природе. Принцип возрастания энтропии. Число микросостояний, которое соответствует данному макросостоянию, называется
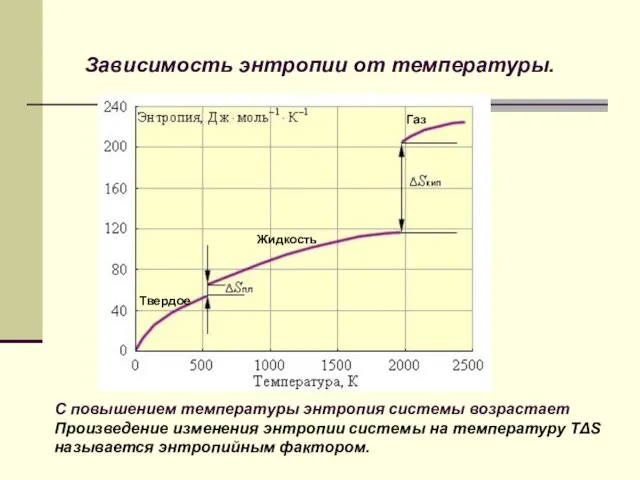
- 14. Зависимость энтропии от температуры. С повышением температуры энтропия системы возрастает Произведение изменения энтропии системы на температуру
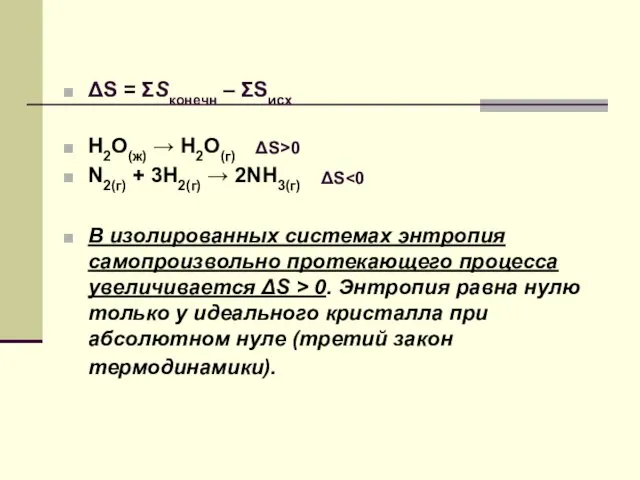
- 15. ΔS = ΣSконечн – ΣSисх H2O(ж) → H2O(г) N2(г) + 3H2(г) → 2NH3(г) В изолированных системах
- 16. 6.5. Движущая сила природных процессов. Энергия Гиббса. Представление о равновесии Самопроизвольное протекание изобарно-изотер-мического процесса определяется двумя
- 17. При равенстве энтальпийного и энтропийного факторов (ΔH = TΔS) система достигает равновесия ΔG = 0 Любая
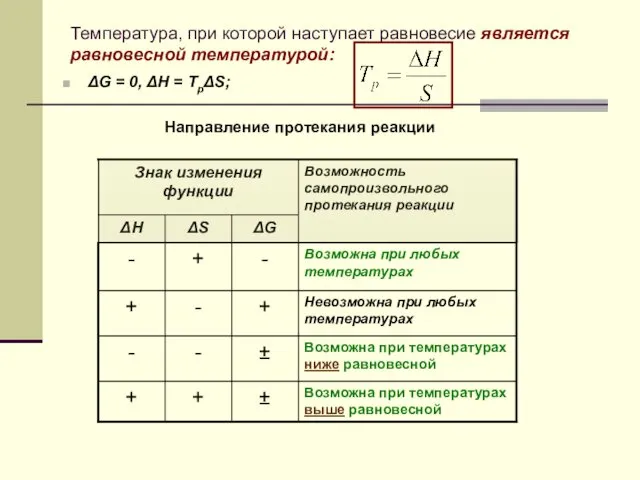
- 18. Температура, при которой наступает равновесие является равновесной температурой: ΔG = 0, ΔH = TpΔS; Направление протекания
- 20. Скачать презентацию









 Белки. Определение
Белки. Определение Оксиды. 9 класс
Оксиды. 9 класс Аминокислоты
Аминокислоты Полисахариды. Крахмал
Полисахариды. Крахмал Карбоновые кислоты
Карбоновые кислоты Геохимия
Геохимия Альдольные реакции енолятов
Альдольные реакции енолятов Гравиметрический метод анализа
Гравиметрический метод анализа Методы защиты металлов от электрохимической коррозии. Классификация методов защиты бетона и железобетона
Методы защиты металлов от электрохимической коррозии. Классификация методов защиты бетона и железобетона Строение и переваривание липидов. Классификация и роль жирных кислот. Нутриомика. Липофильных соединений
Строение и переваривание липидов. Классификация и роль жирных кислот. Нутриомика. Липофильных соединений Химические элементы в организме человека
Химические элементы в организме человека Задачі на виведення формули речовини
Задачі на виведення формули речовини Основания
Основания Методика обучения решению задач на соотношение атомов в школьном курсе химии
Методика обучения решению задач на соотношение атомов в школьном курсе химии Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями Разбор заданий #ОВРновый, #реакционно и #соточка
Разбор заданий #ОВРновый, #реакционно и #соточка Аммиак. Соли аммония
Аммиак. Соли аммония Синтетические моющие средства. Использование их в повседневной жизни
Синтетические моющие средства. Использование их в повседневной жизни Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс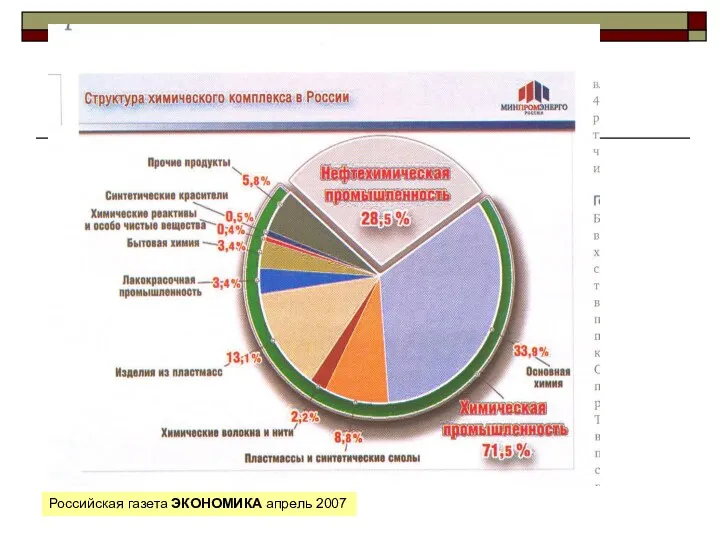 Свойства и классификация нефти
Свойства и классификация нефти Металдар мен бейметалдардың салыстырмалы сипаттамасы
Металдар мен бейметалдардың салыстырмалы сипаттамасы Analytical chemistry methods
Analytical chemistry methods Хлор (лат. Chlorum, Cl)
Хлор (лат. Chlorum, Cl) Химические свойства алкенов
Химические свойства алкенов Кремний
Кремний Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Общие свойства металлов
Общие свойства металлов Атом. Модели строения атома
Атом. Модели строения атома