Содержание
- 2. Когда альдегид (или кетон) обрабатывается гидроксидом или алкоксидом, то енолят и альдегид существуют в равновесии. Если
- 3. Механизм альдольной реакции Этап 1: Образование енолята. Этап 2: Присоединение к карбонильной группе с образованием тетраэдрического
- 4. Эта реакция очень важна, поскольку образуется новая углерод-углеродная связь. Альдольная реакция это обратимый равновесный процесс. Обычно
- 5. Альдольная конденсация ацетона дает только 1% продукта при равновесии, поэтому надо использовать хитрость. Ацетон кипятят с
- 6. Альдольные продукты очень легко дегидратируются до α,β-ненасыщенных альдегидов или кетонов. Дегидратация происходит при нагреве в основных
- 7. Альдольная конденсация, катализируемая основанием, может приводить к образованию альдольного продукта либо дегидратированного енона или еналя по
- 8. При внутримолекулярной альдольной реакции образуются циклические соединения. Альдольная конденсация Образуются преимущественно пяти и шестичленные кольца.
- 9. Два разных карбонильных соединения могут вступать в кросс-(перекрестную) альдольную реакцию с образованием 4 возможных продуктов. Такие
- 10. Кросс-альдольная конденсация Кросс-альдольная конденсация успешно протекает, если: Один из реагентов не имеет α-водородов и, следовательно, не
- 11. Кросс-альдольная конденсация В кросс-альдольной реакции один тип молекул образует енолят, а второй тип не способен на
- 12. Кросс-альдольная конденсация В перекрестных конденсациях альдлегидов и кетонов енолят выбирает более сильный электрофил, которым является альдегид.
- 13. Типы альдольно-кротоновых конденсаций
- 14. Альдегиды без α-протонов при взаимодействии с концентрированным раствором основания вступают в реакцию Канницаро. Эта реакция протекает
- 15. Реакция Канницаро Реакция Канниццаро происходит путем нуклеофильного присоединения ОН- к альдегиду с образованием тетраэдрического промежуточного соединения,
- 16. Контролируемые альдольно-кротоновые конденсации с использованием синтетических эквивалентов енолов Для селективного алкилирования енолятов лучше всего использовать синтетические
- 17. Контролируемые альдольно-кротоновые конденсации с использованием синтетических эквивалентов енолов Синтетические эквиваленты енолов обладают реакционной способностью енолов или
- 18. Контролируемые альдольно-кротоновые конденсации с использованием синтетических эквивалентов енолов После образования литиевого енолята добавляют другое карбонильное соединение,
- 19. Контролируемые альдольно-кротоновые конденсации с использованием синтетических эквивалентов енолов Силиловые эфиры енолов в альдольных конденсациях Они намного
- 20. Контролируемые альдольно-кротоновые конденсации с использованием синтетических эквивалентов енолов 1,3-дикарбонильные соединения в альдольных конденсациях Эти старейшие из
- 21. Контролируемые альдольно-кротоновые конденсации с использованием синтетических эквивалентов енолов Если хотим провести перекрестную альдольную конденсацию, то просто
- 22. Контролируемые альдольно-кротоновые конденсации с использованием синтетических эквивалентов енолов Реакция Кнёвенагеля – реакция конденсации альдегидов или кетонов
- 23. Для перекрестных альдольно-кротоновых конденсаций в случае использования альдегида как енольного компонента применяют Альдегиды енолизуются очень легко,
- 24. Для перекрестных альдольно-кротоновых конденсаций в случае использования кетона как енольного компонента применяют Енолизация кетонов, за исключением
- 25. Для перекрестных альдольно-кротоновых конденсаций в случае использования кетона как енольного компонента применяют Получение более замещенных эквивалентов
- 26. Реакция Манниха Трехкомпонентная реакция, которая включает аминоалкилирование кислого протона рядом с карбонильной функциональной группой формальдегидом и
- 27. Равновесные и направленные альдольные конденсации Равновесные реакции: при использовании равновесных методов карбонильное соединение (соединения) обрабатывают сильными,
- 28. Биологические альдольные реакции Одной из стадий биосинтеза глюкозы является альдольная реакция. Фермент альдолаза катализирует перекрестное альдольное
- 29. Биологические альдольные реакции Коллаген является наиболее распространенным белком у млекопитающих, составляющим около четверти общего белка. Это
- 30. Биологические альдольные реакции В гликолизе фруктоза (β-гидроксикетон), расщепляется ретро-альдольной реакцией на две молекулы с тремя атомами
- 31. Вещества вступают в реакции самоконденсации в водном растворе NaOH с образованием ненасыщенных карбонильных соединений. Нарисуйтие структуры
- 32. Нарисуйте способ синтеза веществ:
- 33. Используйте силиловый эфир енола для получения продукта. Нарисуйте продукты, получающиеся при смешивании этих альдегидов в щелочи:
- 34. Предположите механизм реакции. В каких условиях можно провести альдольную реакцию между реагентами?
- 35. Что является основным продуктом в следующей реакции?
- 36. Что является основным продуктом в следующей реакции?
- 39. - Ацетоуксусный эфир
- 41. Скачать презентацию
 Застосування засобів захисту органів дихання від небезпечних хімічних речовин
Застосування засобів захисту органів дихання від небезпечних хімічних речовин Цинк
Цинк Химические свойства воды
Химические свойства воды Углерод. Металлы. 9 класс
Углерод. Металлы. 9 класс Лужноземельні метали
Лужноземельні метали Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Дисахариды, моносахариды
Дисахариды, моносахариды Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Растворы электролитов
Растворы электролитов Гидроочистка дизельного топлива
Гидроочистка дизельного топлива Предмет и задачи фармацевтической химии. Общие методы анализа лекарственных средств неорганической природы согласно ГФУ
Предмет и задачи фармацевтической химии. Общие методы анализа лекарственных средств неорганической природы согласно ГФУ Серная кислота. 9 класс
Серная кислота. 9 класс Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Судың кермектілігі. Сілтілік металдар мен сілтілікжер металдардың табиғи қосылыстарының қазақстандағы кен орындары
Судың кермектілігі. Сілтілік металдар мен сілтілікжер металдардың табиғи қосылыстарының қазақстандағы кен орындары Основные разделы химии
Основные разделы химии Массовая доля элемента в веществе
Массовая доля элемента в веществе Аминокислоты
Аминокислоты Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Строение и свойства аминокислот и белков
Строение и свойства аминокислот и белков Теплота горения
Теплота горения Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы
Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы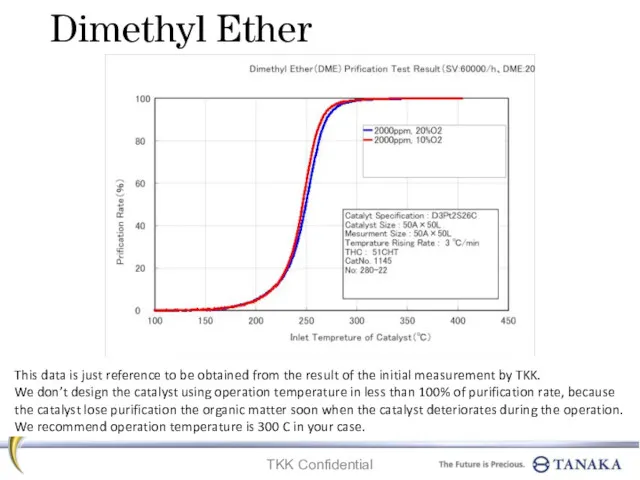 Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Геохимические классификации элементов
Геохимические классификации элементов Энтальпия. Тепловой эффект химической реакции. 11 класс
Энтальпия. Тепловой эффект химической реакции. 11 класс Высокомолекулярные соединения. Общие понятия
Высокомолекулярные соединения. Общие понятия Anionic Polymerization
Anionic Polymerization Общая и неорганическая химия
Общая и неорганическая химия Кварц
Кварц