Содержание
- 2. Химическая термодинамика рассматривает энергетические аспекты различных процессов и определяет условия их самопроизвольного протекания.
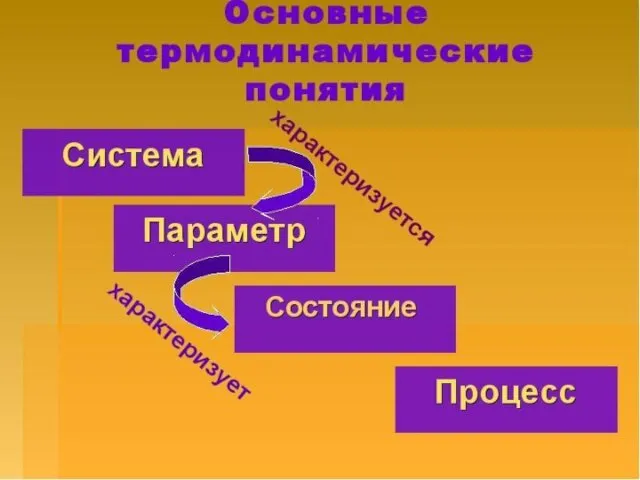
- 4. – это все, что находится в прямом или косвенном контакте с системой. Окружающая среда Система –
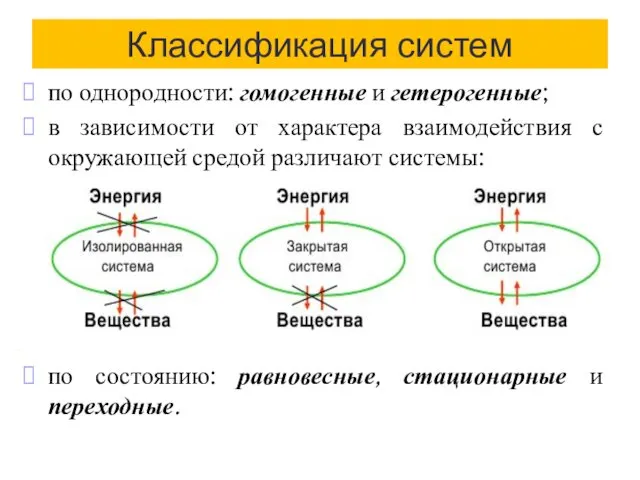
- 5. Классификация систем по однородности: гомогенные и гетерогенные; в зависимости от характера взаимодействия с окружающей средой различают
- 6. Т/д равновесное состояние - const всех свойств во времени и отсутствие потока вещества и энергии в
- 7. Совокупность всех физических и химических свойств системы называют состоянием системы. Его характеризуют термодинамическими параметрами, которые бывают:
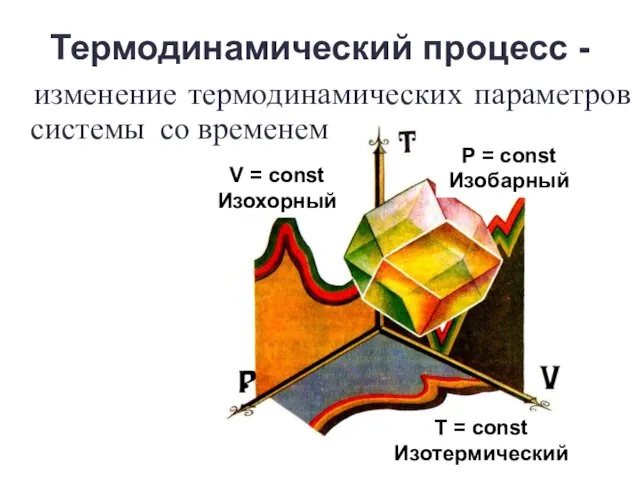
- 8. Термодинамический процесс - изменение термодинамических параметров системы со временем
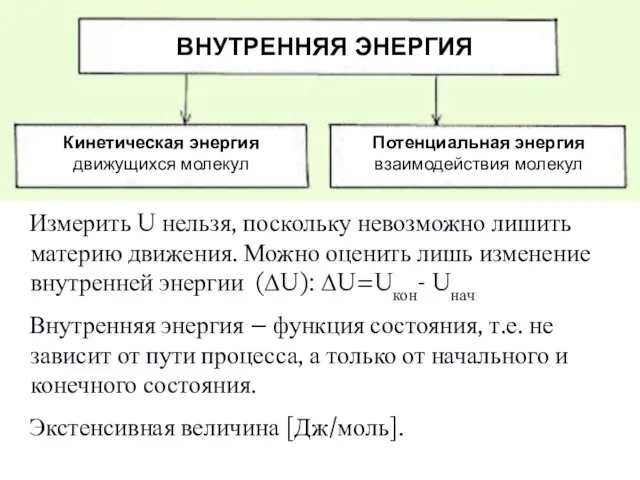
- 9. Измерить U нельзя, поскольку невозможно лишить материю движения. Можно оценить лишь изменение внутренней энергии (ΔU): ΔU=Uкон-
- 10. Теплота и работа Теплота (Q) - хаотический вид передачи энергии Работа (W) – направленный вид передачи
- 11. Первое начало термодинамики
- 12. Формулировки 2.Энергия изолированной системы постоянна. 3. Вечный двигатель I рода невозможен, т.е. машина, производящая работу без
- 13. Математический вид: Q=ΔU + W= ΔU + pΔV Количество теплоты, подведенное к системе, идет на изменение
- 14. Первый закон термодинамики в применении к некоторым процессам Изотермические процессы (Т = const): U = const,
- 15. Закон Гесса Тепловой эффект реакции не зависит от пути процесса ,а зависит только начальным и конечным
- 16. Следствия из закона Гесса 1. ΔНр-ии =∑νΔH0обр(прод) - ∑νΔH0обр(исх) Стандартной энтальпией образования (ΔH0обр ) - тепловой
- 17. 2. ΔНр-ии= ∑νΔ H0сгор(исх) - ∑νΔH0сгор (прод) Стандартная энтальпия сгорания (ΔH0сгор ) - тепловой эффект (изменение
- 18. Второе начало термодинамики
- 19. I закон термодинамики дает данные лишь о тепловыделении и говорит о превращении одной формы энергии в
- 20. Формулировки второго закона термодинамики Теплота не может самопроизвольно переходить от более холодного тела к более горячему
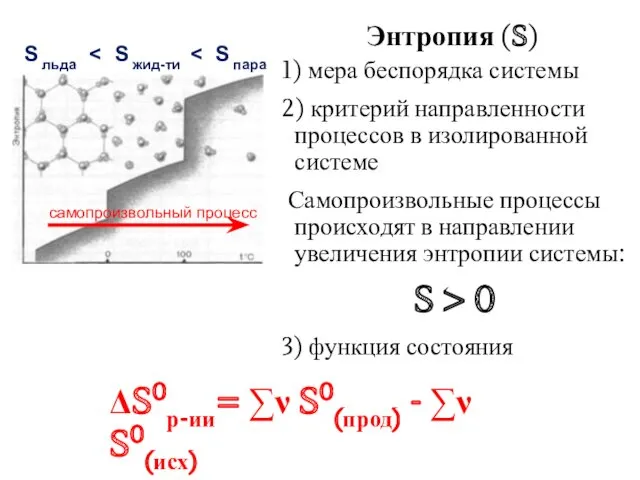
- 21. Энтропия (S) 1) мера беспорядка системы 2) критерий направленности процессов в изолированной системе Самопроизвольные процессы происходят
- 22. Термодинамические потенциалы критерии направленности процессов в открытой и закрытой системах: энергия Гиббса энергия Гельмгольца Расчет энергии
- 23. Биохимические реакции, сопровождающиеся уменьшением энергии Гиббса, называются экзергоническими реакциями. Биохимические реакции, сопровождающиеся увеличением энергии Гиббса, называются
- 25. Скачать презентацию

















 Теория химического строения органических соединений
Теория химического строения органических соединений Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов Фазовые равновесия в растворах
Фазовые равновесия в растворах Сера. Аллотропные модификации
Сера. Аллотропные модификации Carbohydrates and their metabolism. Digestion of carbohydrates
Carbohydrates and their metabolism. Digestion of carbohydrates Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс)
Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс) Химическая связь
Химическая связь Термическая и химико-термическая обработка
Термическая и химико-термическая обработка Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Методика обучения решению задач на соотношение атомов в школьном курсе химии
Методика обучения решению задач на соотношение атомов в школьном курсе химии Химические уравнения
Химические уравнения Аммиак
Аммиак Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Виды камней
Виды камней Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Соли. 11 класс
Соли. 11 класс CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Обмен жиров в организме
Обмен жиров в организме Введение в органическую химию
Введение в органическую химию Фосфор и его соединения. Урок по химии для 9 класса
Фосфор и его соединения. Урок по химии для 9 класса Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері
Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері Элементы группы галогенов
Элементы группы галогенов Кислород, его характеристика, получение и свойства
Кислород, его характеристика, получение и свойства Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Щелочи
Щелочи