Содержание
- 2. Вещество — это вид материи, обладающей массой покоя. В технике вместо понятия «вещество» используют понятие «материал».
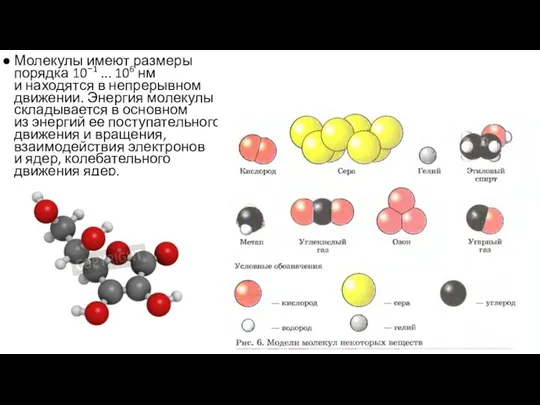
- 3. Молекулы имеют размеры порядка 10−1 ... 106 нм и находятся в непрерывном движении. Энергия молекулы складывается
- 4. Химические связи Ковалентные (атомные) связи возникают между атомами за счет образования устойчивых пар валентных электронов разных
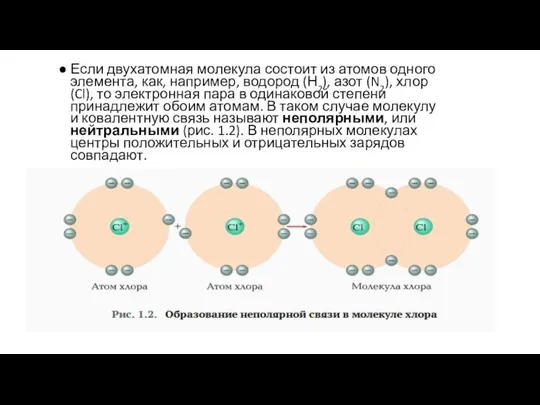
- 5. Если двухатомная молекула состоит из атомов одного элемента, как, например, водород (Н2), азот (N2), хлор (Cl),
- 6. Если двухатомная молекула состоит из атомов различных элементов, то электронная пара может быть смещена к одному
- 7. Дипольная молекула характеризуется электрическим дипольным моментом μ, Кл · м: μ = gl, где g —
- 8. Разновидностью ковалентной связи является донорно-акцепторная связь, которая возникает между атомом, способным отдать электрон (донор), и атомом,
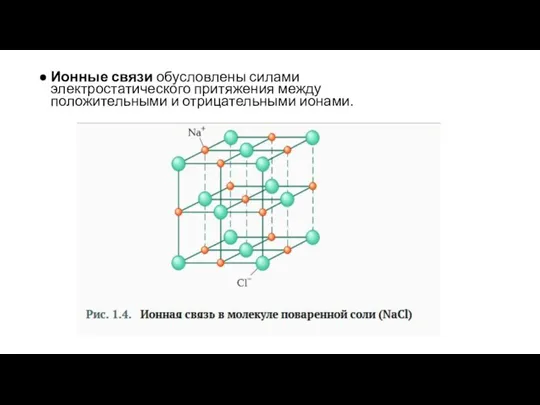
- 9. Ионные связи обусловлены силами электростатического притяжения между положительными и отрицательными ионами.
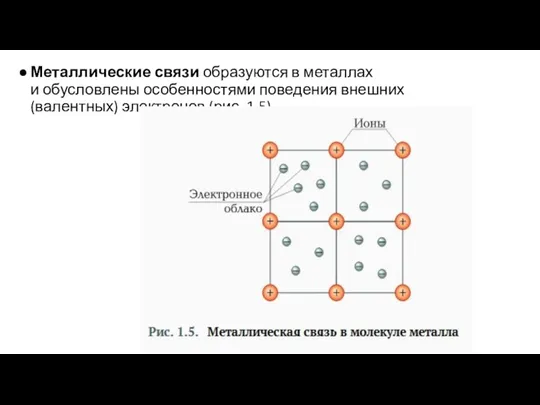
- 10. Металлические связи образуются в металлах и обусловлены особенностями поведения внешних (валентных) электронов (рис. 1.5).
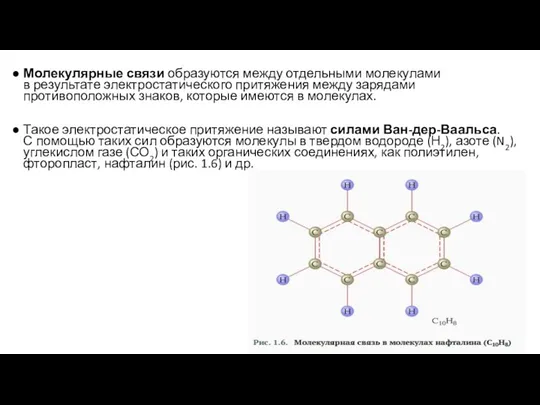
- 11. Молекулярные связи образуются между отдельными молекулами в результате электростатического притяжения между зарядами противоположных знаков, которые имеются
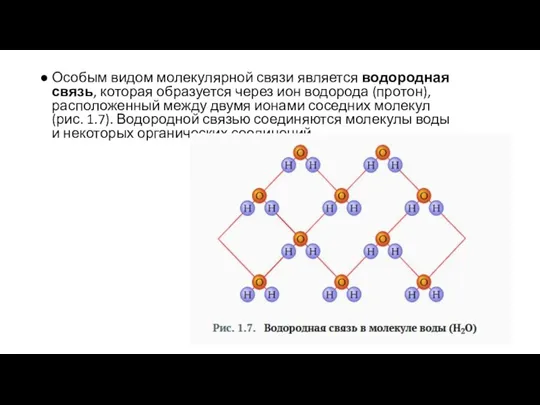
- 12. Особым видом молекулярной связи является водородная связь, которая образуется через ион водорода (протон), расположенный между двумя
- 13. Кристаллические материалы Кристалл состоит из множества сопряженных друг с другом элементарных кристаллических ячеек. В элементарной кристаллической
- 14. Для описания структуры кристаллических тел пользуются понятием пространственной кристаллической решетки, представляющей собой пространственную сетку, в узлах
- 15. В узлах ковалентных (атомных) решеток находятся нейтральные атомы, которые связаны друг с другом ковалентной связью. В
- 16. Наиболее распространенными типами кристаллических решеток являются: кубическая объемноцентрированная (рис. 1.9, а), ее имеют α-железо, хром, вольфрам,
- 17. Изменение свойств кристаллов (металлов) в зависимости от направления называют анизотропией. Степень анизотропности свойств металлов может быть
- 18. Температура, при которой происходит фазовое превращение твердого вещества в жидкое, называется температурой плавления Тпл. Обратный переход
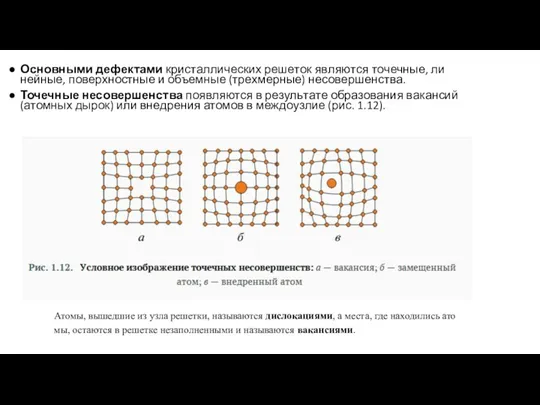
- 19. Основными дефектами кристаллических решеток являются точечные, линейные, поверхностные и объемные (трехмерные) несовершенства. Точечные несовершенства появляются в
- 20. Линейные несовершенства представляют собой изменения структуры, протяженность которых в одном измерении гораздо больше, чем в двух
- 21. Поверхностные несовершенства характеризуются значительными изменениями структуры в двух измерениях. Примером поверхностного несовершенства является граница между кристаллами
- 22. Объемные (трехмерные) несовершенства кристалла имеют существенные размеры во всех трех измерениях. К объемным дефектам относятся пустоты,
- 23. Поликристаллические материалы состоят из большого числа сросшихся между собой мелких кристаллических зерен (кристаллитов), которые хаотически ориентированы
- 24. Аморфные и аморфно-кристаллические материалы В аморфных материалах атомы и молекулы расположены беспорядочно (рис. 1.15). В отличие
- 25. Аморфные материалы, в свою очередь, подразделяются на две группы: 1) простые аморфные материалы, к которым относятся
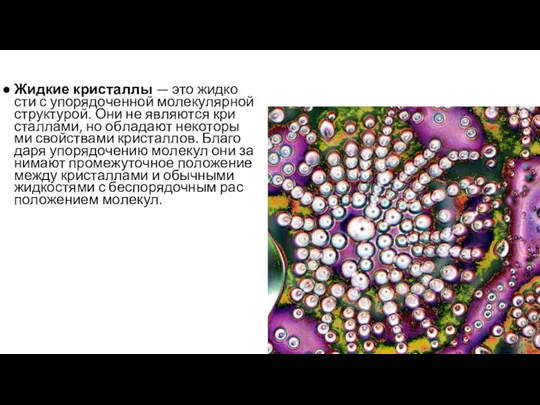
- 26. Жидкие кристаллы — это жидкости с упорядоченной молекулярной структурой. Они не являются кристаллами, но обладают некоторыми
- 27. Нанокристаллические материалы Нанокристаллическими называются материалы с размерами кристаллов (зерен и частиц) менее 100 нм. По свойствам
- 28. Молекулы фуллеренов содержат 60, 70 и 82 атома углерода, которые обозначают, соответственно, С60, С70, С82. Молекулы
- 29. Нанотрубки представляют собой протяженные цилиндрические структуры, состоящие из одной или нескольких свернутых в трубку гексагональных графитовых
- 30. Фазовый состав материалов Жидкий раствор представляет собой однородную массу двух или более компонентов, которые равномерно распределены
- 31. Твердые растворы бывают полностью упорядоченными, неупорядоченными и частично упорядоченными (промежуточные фазы). Твердые растворы, устойчивые при сравнительно
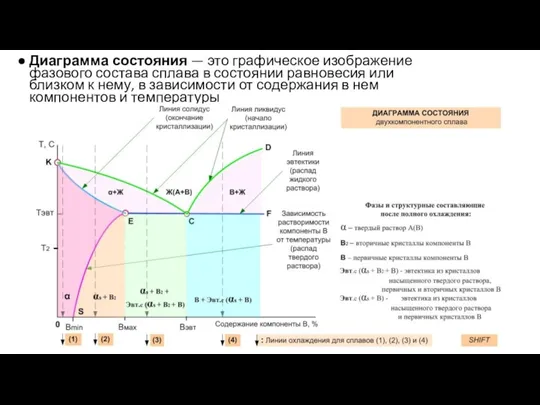
- 32. Диаграмма состояния — это графическое изображение фазового состава сплава в состоянии равновесия или близком к нему,
- 34. Скачать презентацию






















 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Экспериментально исследовательский проект Соль волшебница
Экспериментально исследовательский проект Соль волшебница Химиялық кинетика және химиялық тепе-теңдік
Химиялық кинетика және химиялық тепе-теңдік Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Қалдық мөлшерлер
Қалдық мөлшерлер сложные эфиры
сложные эфиры Закон сохранения массы. Химические уравнения
Закон сохранения массы. Химические уравнения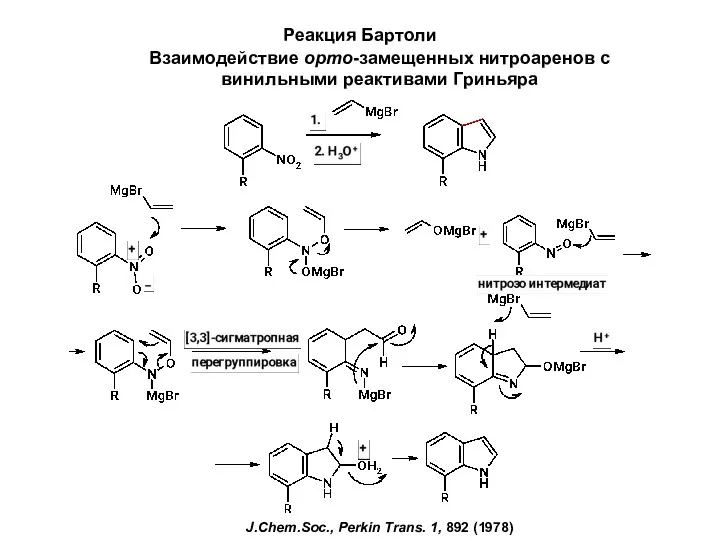 Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра
Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості Химические свойства толуола
Химические свойства толуола Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Определите положение в ПСХЭ элементов
Определите положение в ПСХЭ элементов Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Complex compounds
Complex compounds Химия - тұрмыста
Химия - тұрмыста p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Свойства кислорода. Получение кислорода методом вытеснения воздуха
Свойства кислорода. Получение кислорода методом вытеснения воздуха Самородные элементы
Самородные элементы Товары бытовой химии
Товары бытовой химии Реакції йонного обміну між електролітами у водних розчинах
Реакції йонного обміну між електролітами у водних розчинах Вода – растворитель. Растворы. Значение воды
Вода – растворитель. Растворы. Значение воды Окислительно-восстановительные реакции. (лекция №10)
Окислительно-восстановительные реакции. (лекция №10) Узагальнення й систематизація знань з теми Початкові хімічні поняття (1 частина)
Узагальнення й систематизація знань з теми Початкові хімічні поняття (1 частина) Виды присадок к моторным топливам (керосин)
Виды присадок к моторным топливам (керосин) Сера и ее соединения
Сера и ее соединения Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Последствия применения удобрений в сельском хозяйстве
Последствия применения удобрений в сельском хозяйстве