Содержание
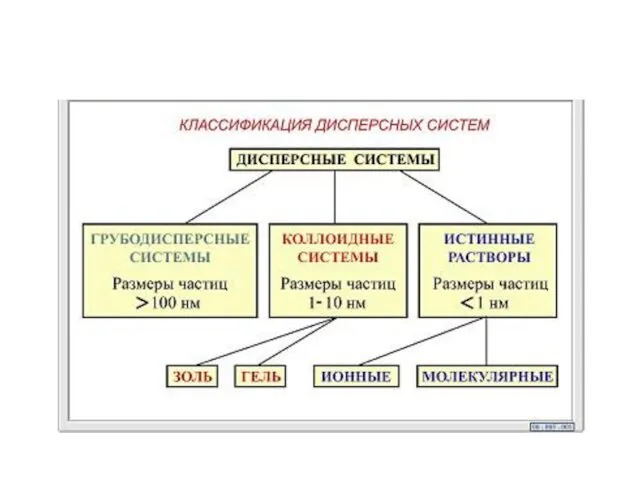
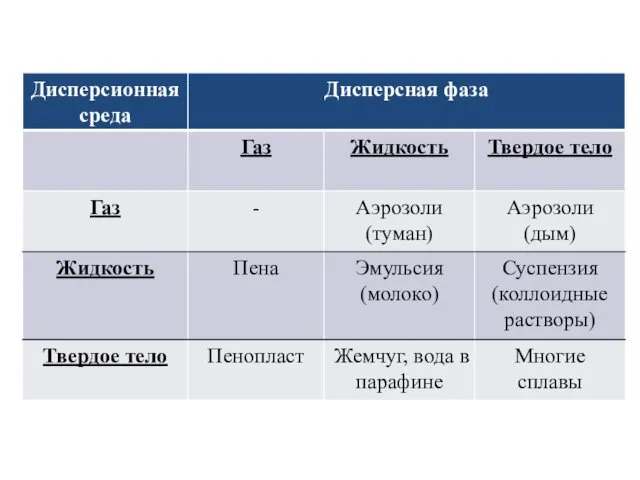
- 3. Дисперсные системы гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностью раздела между
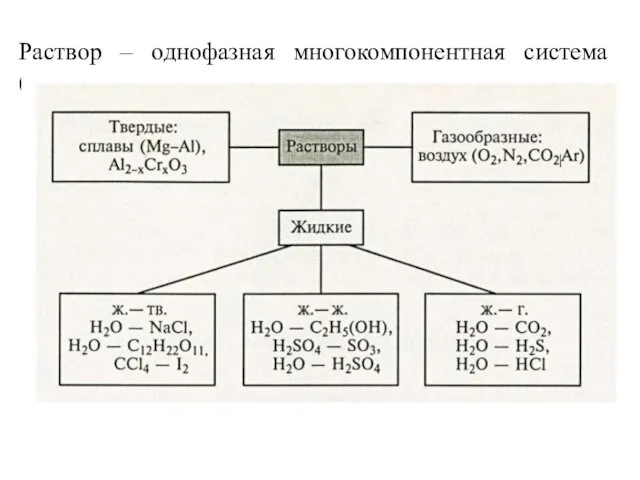
- 5. Раствор – однофазная многокомпонентная система (двух - ) переменного состава
- 6. Растворимость Растворимостью (S) называется свойство вещества растворяться в том или ином растворителе. Мерой растворимости является концентрация
- 7. Пересыщенный раствор
- 8. Растворимость твердых веществ часто выражают в граммах растворённого вещества, приходящегося на 100 г воды в насыщенном
- 9. Растворимость газов выражают в миллилитрах газа, растворяющихся в 100 г воды до образования насыщенного раствора при
- 10. Способы выражения концентрации раствора Массовая доля Молярная концентрация, моль/л Нормальная, эквивалентная концентрация, моль/л Моляльность, моль/кг Титр,
- 11. В 1 л воды растворено 160 г NaOH. Выразить всеми способами концентрацию раствора, плотность которого равна
- 12. 8) Находим мольную долю гидроксида натрия: 6) Вычисляем моляльность раствора: 7) Определяем титр: 9) Находим мольную
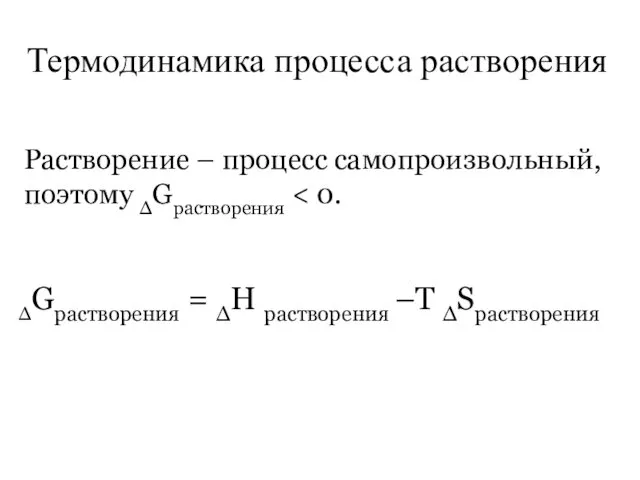
- 13. Термодинамика процесса растворения Растворение – процесс самопроизвольный, поэтому ∆Gрастворения ∆Gрастворения = ∆Н растворения –Т ∆Sрастворения
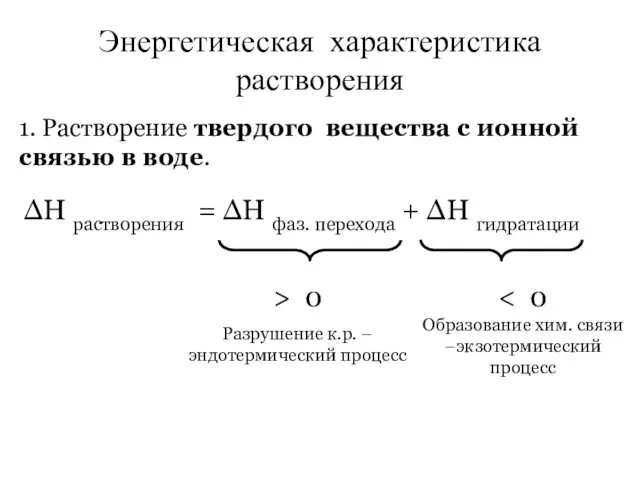
- 14. Энергетическая характеристика растворения ∆Н растворения = ∆Н фаз. перехода + ∆Н гидратации 1. Растворение твердого вещества
- 15. 1. Если |∆Н ф. п. |> |∆Н гидр. |, то ∆Н растворения > 0, эндо-процесс, раствор
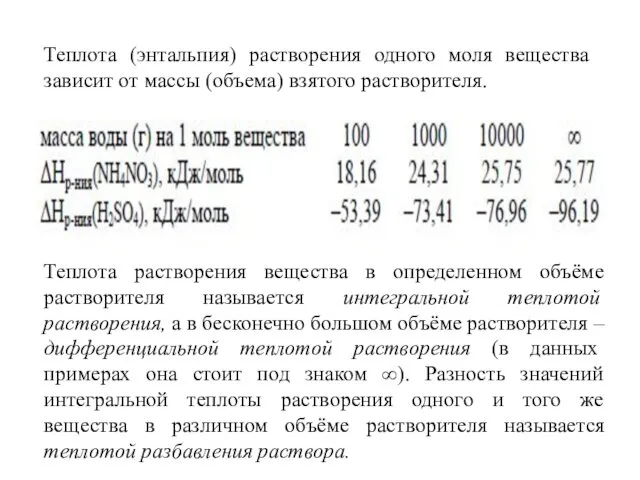
- 16. Теплота (энтальпия) растворения одного моля вещества зависит от массы (объема) взятого растворителя. Теплота растворения вещества в
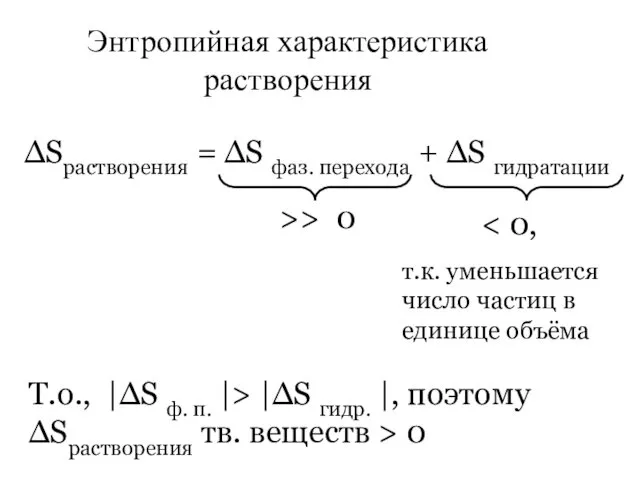
- 17. Энтропийная характеристика растворения ∆Sрастворения = ∆S фаз. перехода + ∆S гидратации >> 0 т.к. уменьшается число
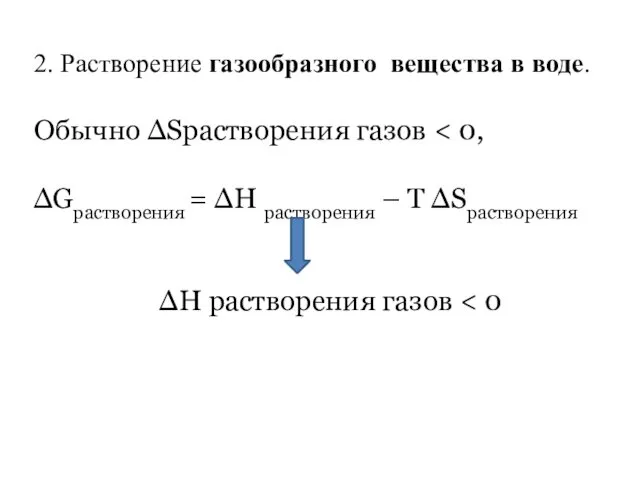
- 18. 2. Растворение газообразного вещества в воде. Обычно ∆Sрастворения газов ∆Gрастворения = ∆Н растворения – Т ∆Sрастворения
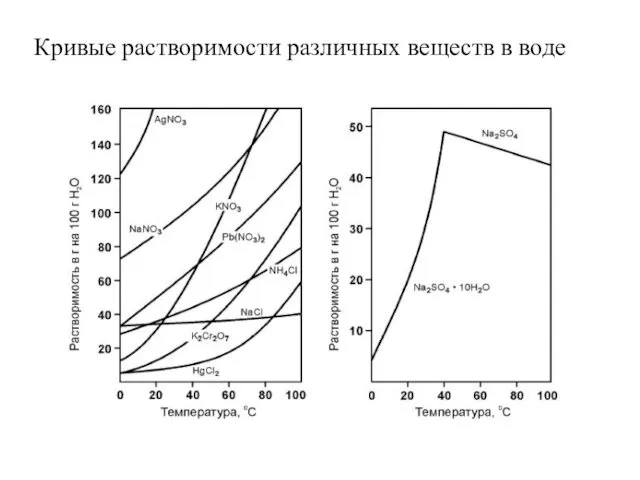
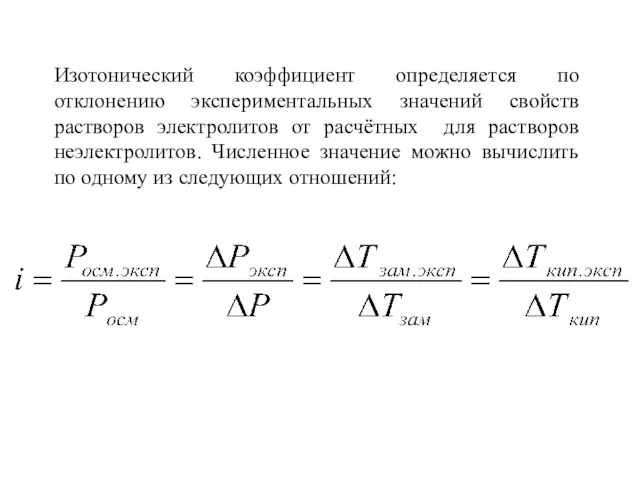
- 19. Кривая растворимости (политерма) ∆H0ф.п. ∆H0растворения (экзотермический процесс) [S] ∆H0см. газы, NaOH, экзо Li2CO3 T ∆H0раств-я= ∆H0ф.п.+
- 20. Кривая растворимости (политерма) [S] ∆H0см. > 0 KNO3 эндо T ∆H0ф.п. > ∆H0гидр. ∆H0растворения > 0
- 21. Кривые растворимости различных веществ в воде
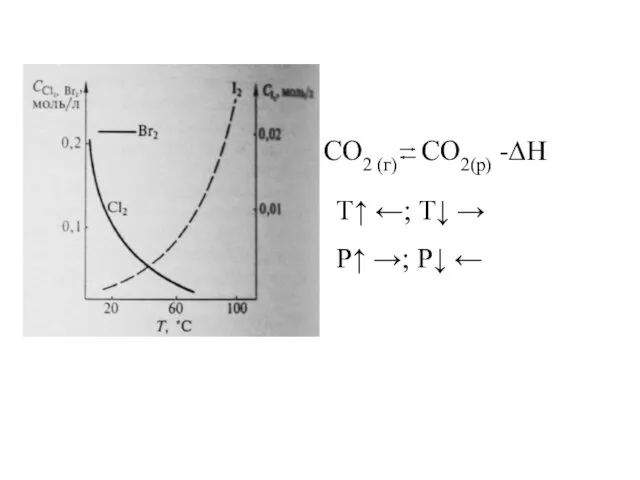
- 22. Растворимость газов Газ + жидкость ↔ нас. р-р газа При постоянной температуре растворимость чистого идеального газа
- 23. СO2 (г) CO2(р) -∆H Т↑ ←; T↓ → P↑ →; P↓ ←
- 24. Коллигативные свойства растворов Осмотическое давление 2.Понижение давления насыщенного пара растворителя над раствором по сравнению с давлением
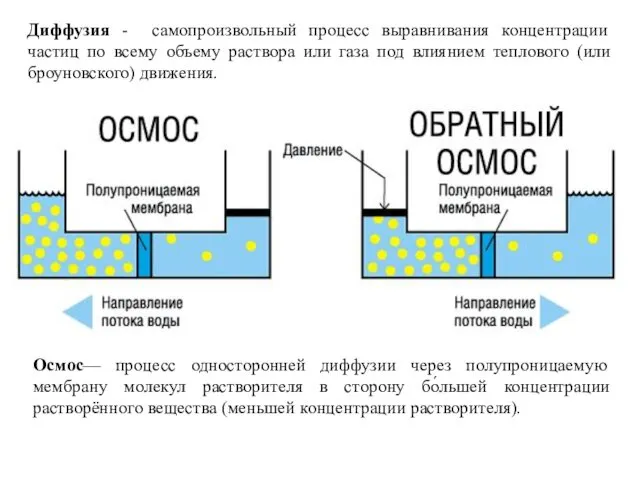
- 25. Диффузия - самопроизвольный процесс выравнивания концентрации частиц по всему объему раствора или газа под влиянием теплового
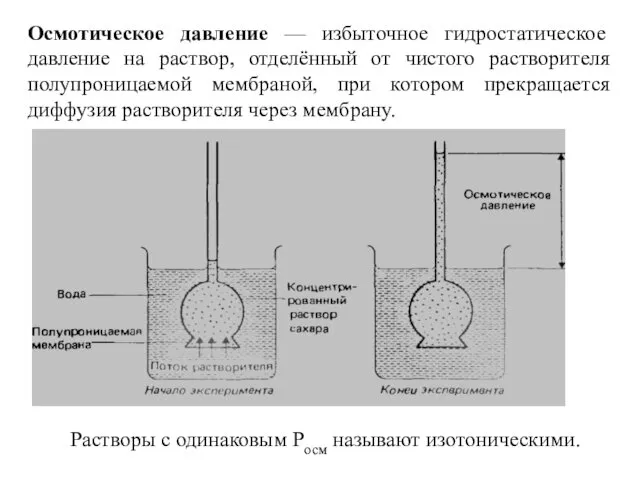
- 26. Осмотическое давление — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором
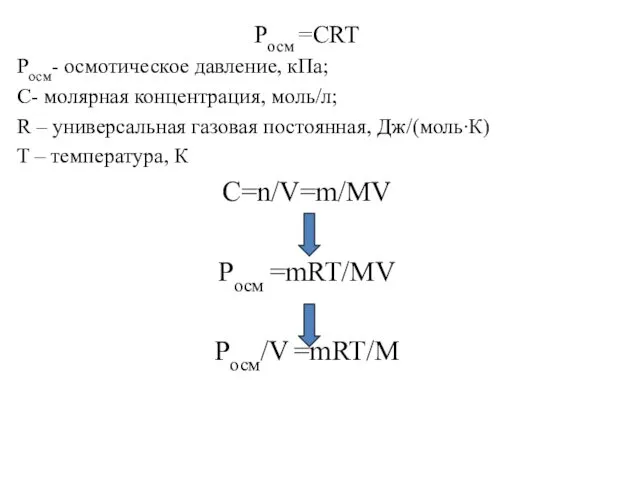
- 27. Pосм =СRT Pосм- осмотическое давление, кПа; С- молярная концентрация, моль/л; R – универсальная газовая постоянная, Дж/(моль∙К)
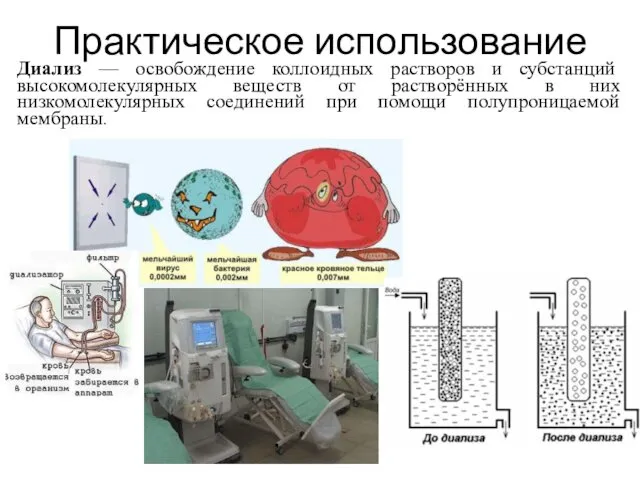
- 28. Практическое использование Диализ — освобождение коллоидных растворов и субстанций высокомолекулярных веществ от растворённых в них низкомолекулярных
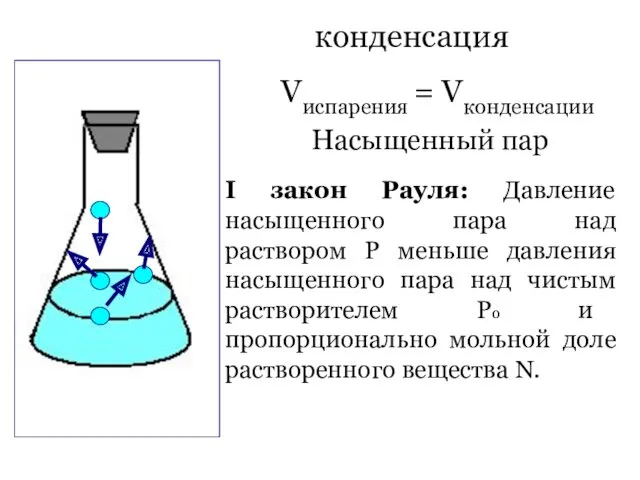
- 29. Давление насыщенного пара растворителя Испарение
- 30. конденсация Vиспарения = Vконденсации Насыщенный пар I закон Рауля: Давление насыщенного пара над раствором Р меньше
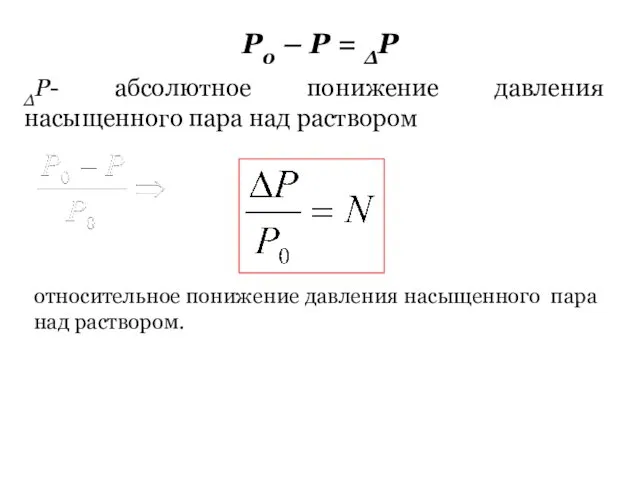
- 31. Р0 – Р = ΔР ΔР- абсолютное понижение давления насыщенного пара над раствором относительное понижение давления
- 32. Вычислить давление насыщенного пара над 4%-м водным раствором глюкозы С6H12O6 при 40 °С. Решение. Принимаем массу
- 33. В разбавленных растворах n1 >> n2, поэтому n1 + n2 ≈ n1. Таким образом, для разбавленных
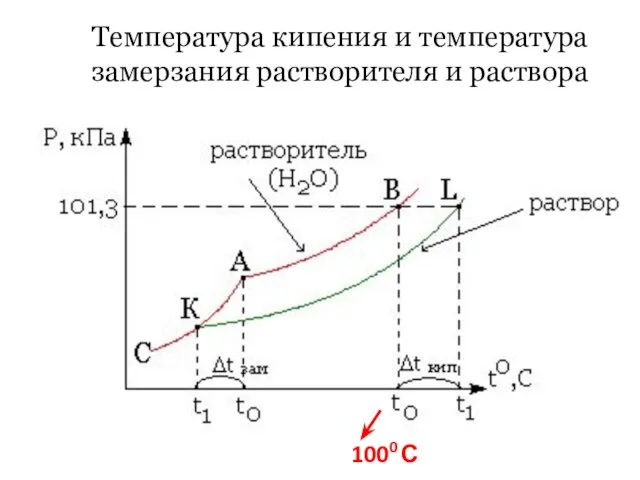
- 34. Температура кипения и температура замерзания растворителя и раствора
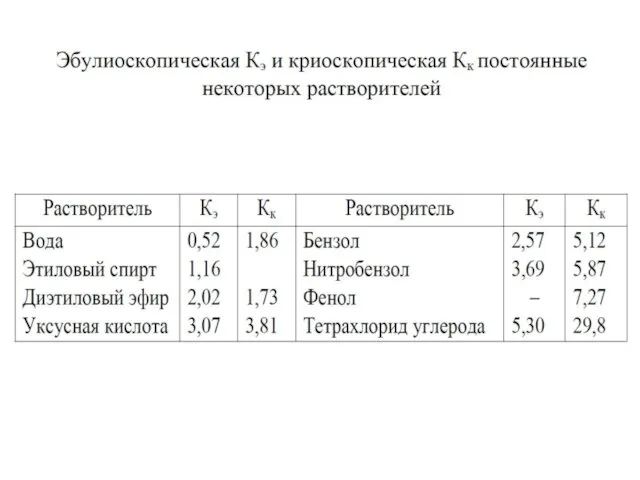
- 35. Е- эбулиоскопическая постоянная, К- криоскопическая постоянная, Сm- моляльность раствора, моль/кг Для Н2О: Е= 0,53 кг⋅град /
- 37. Криометрия, эбулиометрия
- 38. В 200 мл воды растворено 6,58 г сахара. При какой температуре кипит этот раствор? Решение. 1)
- 39. Росм = См ⋅ R ⋅ T Ткип.=Е⋅ Сm ΔТзам.=К⋅ Сm Только для растворов неэлектролитов
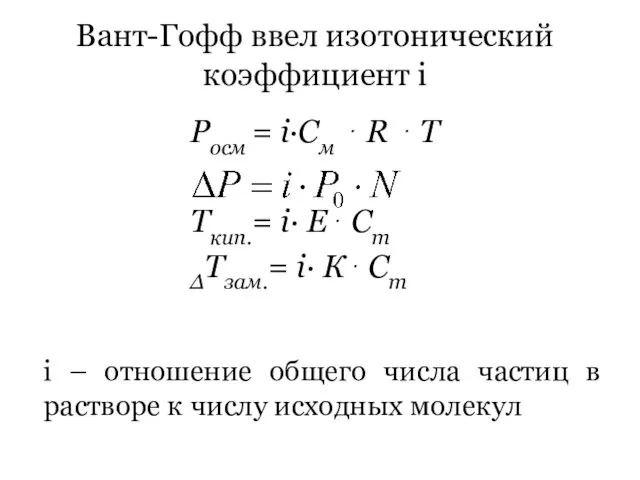
- 40. Вант-Гофф ввел изотонический коэффициент i i – отношение общего числа частиц в растворе к числу исходных
- 41. Растворы Ч. 2 Электролитическая диссоциация Теории кислот и оснований
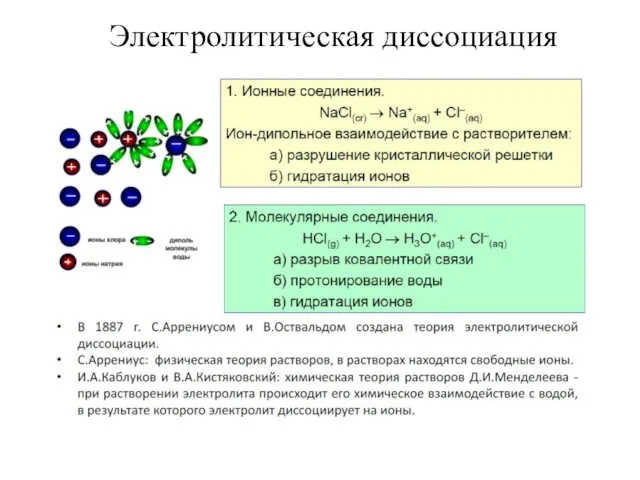
- 42. Электролитическая диссоциация
- 43. Основные положения учения Арениуса: 1. По отношению к электрическому току: проводящие электрический ток (электролиты); не проводящие
- 44. Факторы, влияющие на α: 1. природа вещества а) растворителя (дипольный момент , диэлектрическая проницаемость); б) характер
- 45. С- исходная молярная концентрация кислоты, моль/л; α - степень диссоциации; С⋅α - число продиссоциировавших молекул; (С-
- 46. для слабых электролитов α→ 0 и (1- α) → 1, тогда Закон разведения Оствальда (1888 г.)
- 47. Пусть общее число молекул электролита N и каждая молекула диссоциирует на n ионов. Тогда число молекул
- 48. Изотонический коэффициент определяется по отклонению экспериментальных значений свойств растворов электролитов от расчётных для растворов неэлектролитов. Численное
- 49. Пример. Определите константу и степени диссоциации уксусной кислоты в растворе содержащем 0,571 г CH3COOH в 100
- 50. Сильные электролиты диссоциируют на ионы необратимо и полно но степень их электролитической диссоциации не достигает 1
- 51. Пример. При растворении 3,48 г нитрата кальция в 200 г воды получен раствор замерзающий при температуре
- 52. Образование гидратных оболочек ионных пар и ассоциатов в растворах сильных электролитов приводит как бы к уменьшению
- 53. Коэффициенты активности ионов зависят от ионной силы раствора (I), то есть от интенсивности электростатического поля, которая
- 54. Для разбавленных растворов, в которых I ≤ 0,01: Предельный з-н Дебая-Хюккеля Для растворов электролитов одинаковозарядных (MgSO4):
- 55. Пример: Определить fa 0,001 М р-ра К2SO4.
- 56. Пример. В 250 г воды растворено 0,375 г сульфата магния. Определить коэффициенты активности ионов и активность
- 57. Произведение растворимости Произведение растворимости (ПР) - произведение равновесных концентраций ионов сильных малорастворимых электролитов в их насыщенном
- 58. Условие выпадения осадка
- 59. Предсказать возможные направления превращений
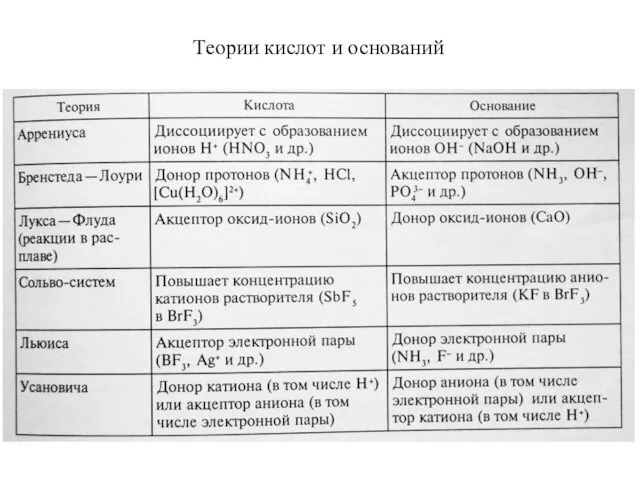
- 60. Теории кислот и оснований
- 61. Протонная теория кислот и оснований. Теория Бренстеда – Лоури (1923 г.) Основные положения : Кислота -
- 62. Классификация кислот и оснований Кислоты: а) нейтральные НCl → H+ + Cl- б) анионные HCO3 -
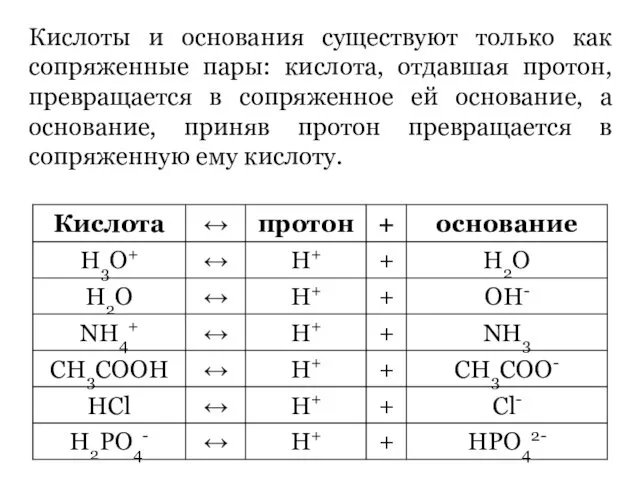
- 63. Кислоты и основания существуют только как сопряженные пары: кислота, отдавшая протон, превращается в сопряженное ей основание,
- 64. Типы протолитических реакций 1. нейтрализация 2. гидролиз 3. электролитическая диссоциация
- 65. 4. Кислотно-основные свойства вещество проявляет в конкретной химической реакции. В зависимости от партнера могут быть вещества
- 66. Классификация растворителей 1. апротонные (нет Н+) : СS2, CCl4 и др. 2. протолитические : а) протогенные
- 67. NH3 Н2О С2Н5ОН HCN H2S CH3COOH HNO3 H2SO4 HF HClO4 Возрастает способность быть донором протона В
- 68. Сильные кислоты в хлорной кислоте становятся слабыми, а слабые еще слабее, кислоты дифференцируются. Растворители в которых
- 74. 1.HnЭОn. Это очень слабые кислоты, константы диссоциации которых К Формальная оценка силы кислот в водных растворах
- 75. Если у нескольких кислот формальный показатель одинаков и одинаковая степень окисления кислотообразующего элемента, то сила этих
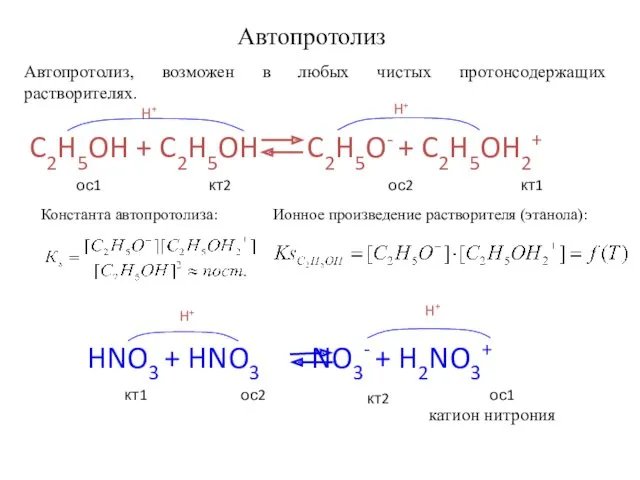
- 76. HNO3 + HNO3 NO3- + H2NO3+ H+ H+ кт1 ос2 ос1 кт2 катион нитрония Автопротолиз Автопротолиз,
- 77. Диссоциация воды. Ионное произведение воды. Н2О ↔ Н+ + ОН-
- 78. (Н2О) =1,8 ⋅10-9 , это значит, что из 50 000 000 молекул распадается - 1
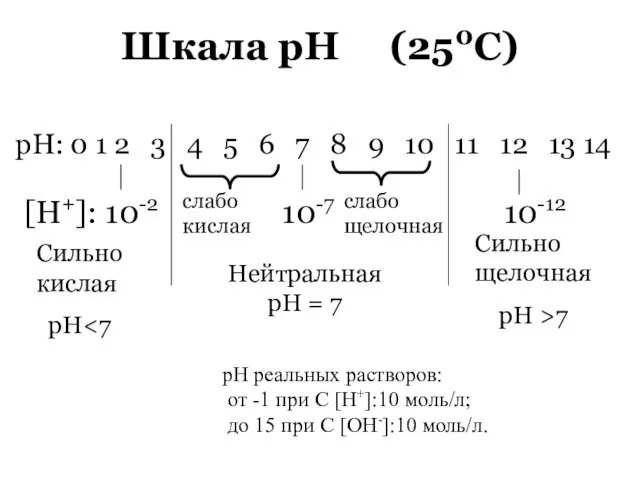
- 80. Водородный показатель (рН) 1909 г. Серенсен
- 81. Шкала рН (250С) рН реальных растворов: от -1 при С [H+]:10 моль/л; до 15 при С
- 82. Расчет рН растворов I. Сильных кислот и оснований fa ≈ 1
- 83. II. Слабых кислот и оснований
- 84. Если α неизвестно: [СН3СОО-]=[Н+]
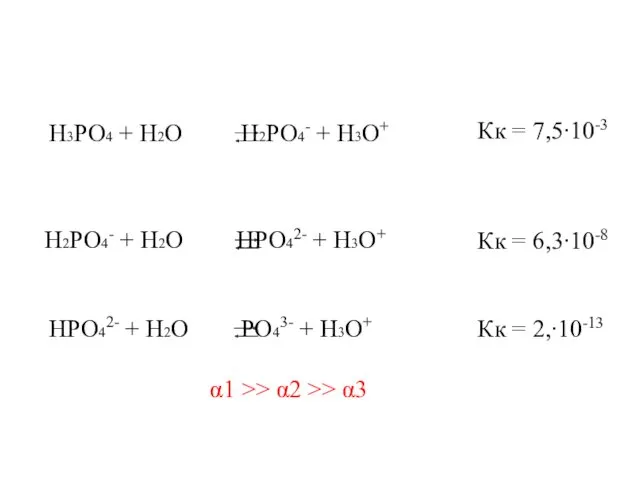
- 85. H3PO4 + H2O H2PO4- + H3O+ Кк = 7,5∙10-3 H2PO4- + H2O HPO42- + H3O+ HPO42-
- 86. Буферные растворы Буферные растворы – это растворы состоящие из слабой кислоты и её соли или слабого
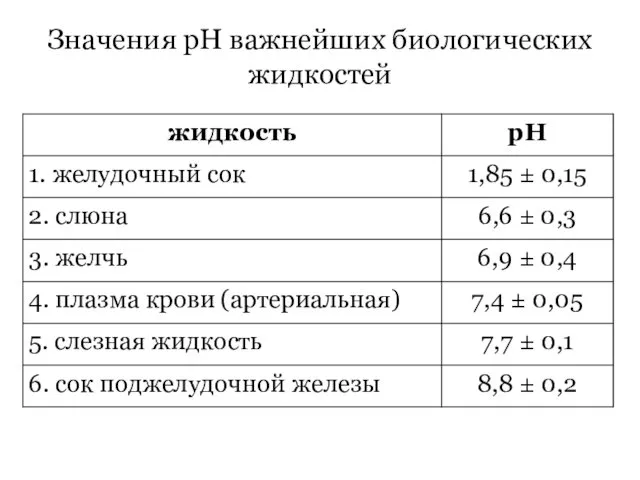
- 87. Значения рН важнейших биологических жидкостей
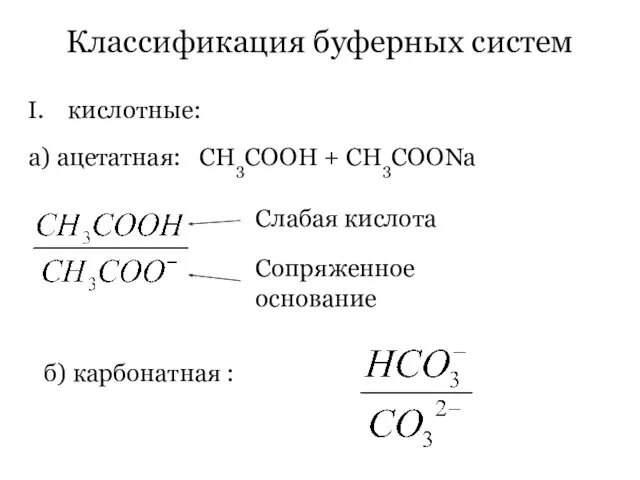
- 88. Классификация буферных систем I. кислотные: а) ацетатная: СН3СООН + СН3СООNa
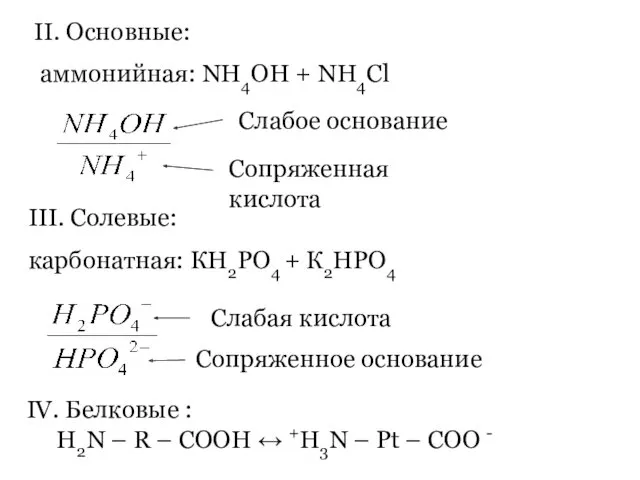
- 89. II. Основные: аммонийная: NH4OH + NH4Cl III. Солевые: карбонатная: КН2РО4 + К2НРО4 IV. Белковые : H2N
- 91. Расчет рН буферных систем СН3 СООН ↔ СН3 СОО- + Н+ (α→ 0) СН3 СООNa →
- 92. уравнение Гендерсона - Гассельбаха
- 94. Механизм действия буферных систем а) ~ OH- → Н2О ~ сильное основание NaOH → слабое СН3СОО-
- 95. Вычислить pH ацетатного буфера при концентрациях CH3COOH и CH3COONa, равных 1 моль/л, и при разбавлении растворов
- 96. В колбу поместили 2,25 мл 100% уксусной кислоты с плотностью 1,05 г/мл, 4,92 г ацетата натрия
- 97. К 100 мл 1 М ацетатного буферного раствора прибавили 100 мл децимолярной соляной кислоты. Вычислить водородный
- 98. Предельное количество кислоты или щёлочи (в моль/л), при добавлении которого к буферному раствору его pH изменяется
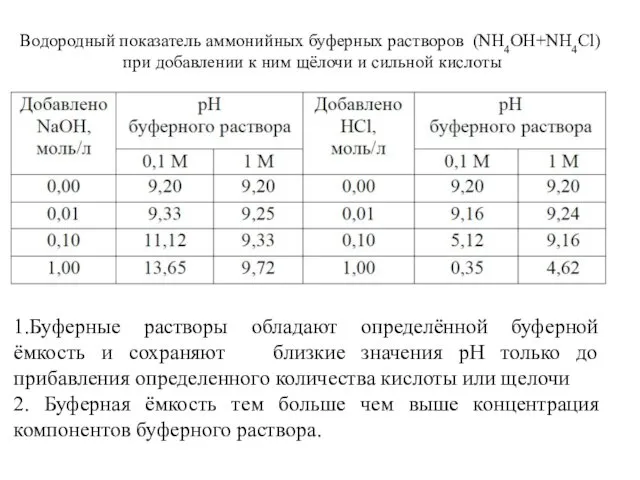
- 99. Водородный показатель аммонийных буферных растворов (NH4OH+NH4Cl) при добавлении к ним щёлочи и сильной кислоты 1.Буферные растворы
- 101. Скачать презентацию









![Кривая растворимости (политерма) ∆H0ф.п. ∆H0растворения (экзотермический процесс) [S] ∆H0см. газы,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108229/slide-18.jpg)
![Кривая растворимости (политерма) [S] ∆H0см. > 0 KNO3 эндо T](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108229/slide-19.jpg)





















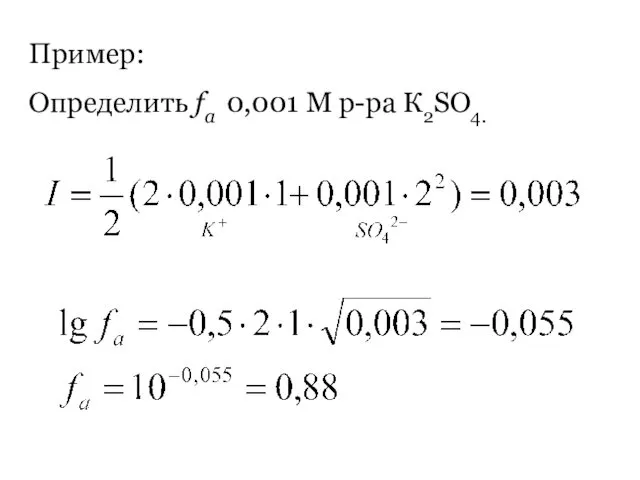



















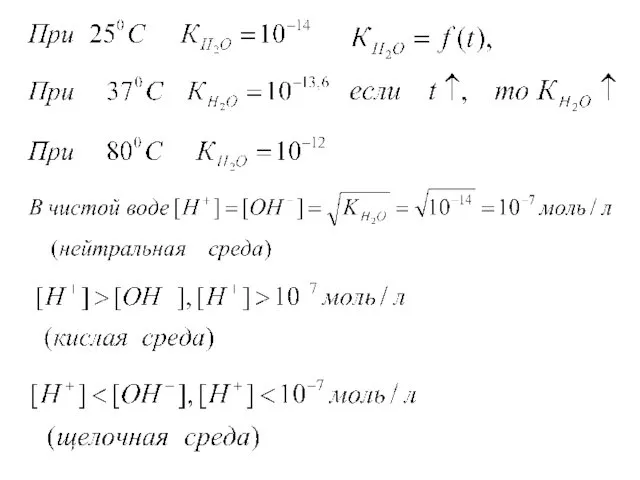



![Если α неизвестно: [СН3СОО-]=[Н+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108229/slide-83.jpg)










 Materials. Metals non-metals
Materials. Metals non-metals Методика “Кольоропис”
Методика “Кольоропис” Выращивание кристаллов методом Чохральского
Выращивание кристаллов методом Чохральского Радиохимия
Радиохимия Геохимические классификации элементов
Геохимические классификации элементов Дисперсные системы (продолжение)
Дисперсные системы (продолжение) Переработка нефти. Крекинг
Переработка нефти. Крекинг Галогены. Положение галогенов в ПСХЭ
Галогены. Положение галогенов в ПСХЭ Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Термохімічні рівняння
Термохімічні рівняння Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы
Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника
Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника Основные классы неорганических соединений
Основные классы неорганических соединений Закон збереження маси речовини. Хімічні рівняння
Закон збереження маси речовини. Хімічні рівняння Альдегидтер мен спирттер
Альдегидтер мен спирттер Трансмиссионные масла
Трансмиссионные масла Основания. (8 класс)
Основания. (8 класс) Производство цемента. Сухой цемент
Производство цемента. Сухой цемент Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Общая характеристика элементов IБгруппы. Медь. Серебро. Золото
Общая характеристика элементов IБгруппы. Медь. Серебро. Золото Каучук. Применение
Каучук. Применение Обратимые реакции. Химическое равновесие. Смещение равновесия
Обратимые реакции. Химическое равновесие. Смещение равновесия Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ АЛКАНЫ Строение молекулы метана.
АЛКАНЫ Строение молекулы метана. Состав воздуха. Тема 1
Состав воздуха. Тема 1 Хром. Химиялық қасиеттері
Хром. Химиялық қасиеттері Включение региональных особенностей Камчатского края в программы учебного предмета химия
Включение региональных особенностей Камчатского края в программы учебного предмета химия