Содержание
- 2. Элементы IБ-группы
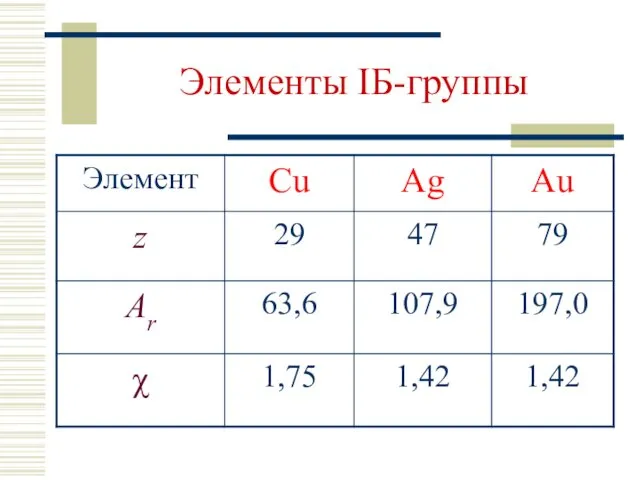
- 3. Элементы IБ-группы Общая электронная формула: […] ns1 (n–1)d10 Степени окисления: 0, +I, +II, +III
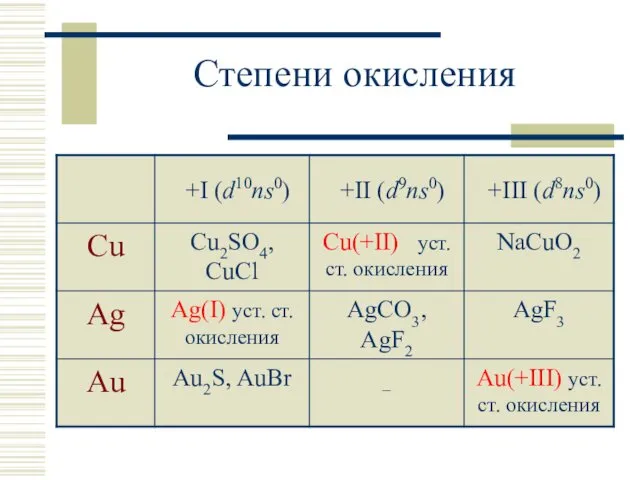
- 4. Степени окисления
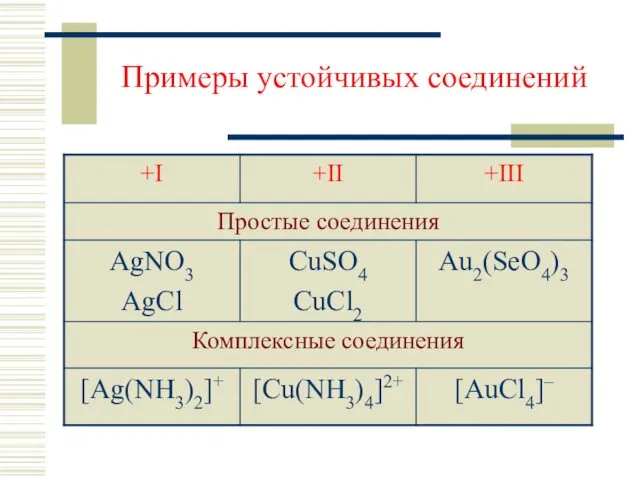
- 5. Примеры устойчивых соединений
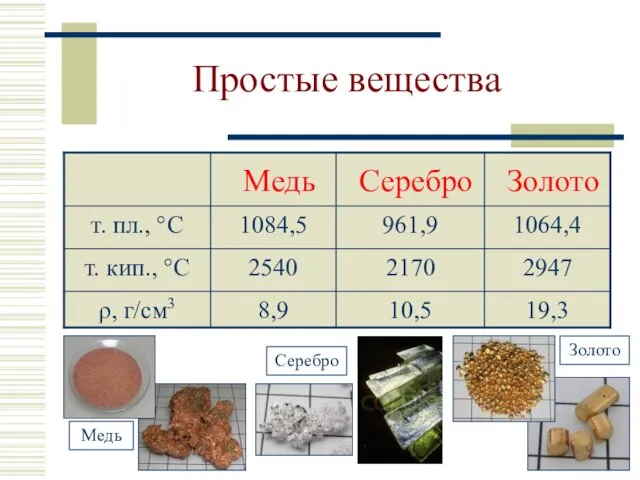
- 6. Простые вещества
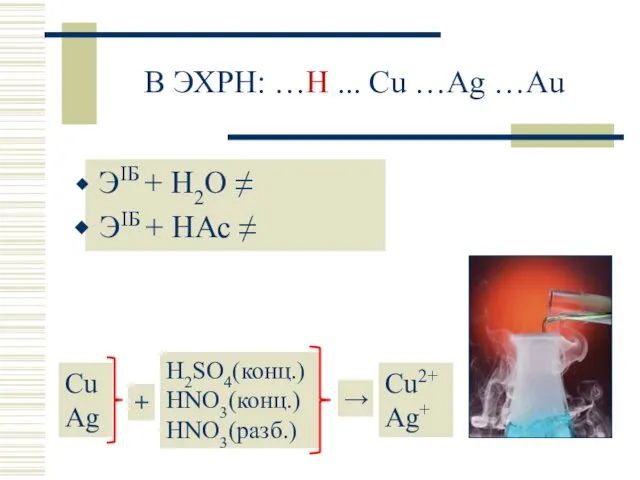
- 7. В ЭХРН: …H ... Cu …Ag …Au ЭIБ + H2O ≠ ЭIБ + HАс ≠ CuAg
- 8. Кислородные соединения Cu Ag, Au +I: Cu2O уст. красн., т. пл. 1240 °С +II: CuO черн.,
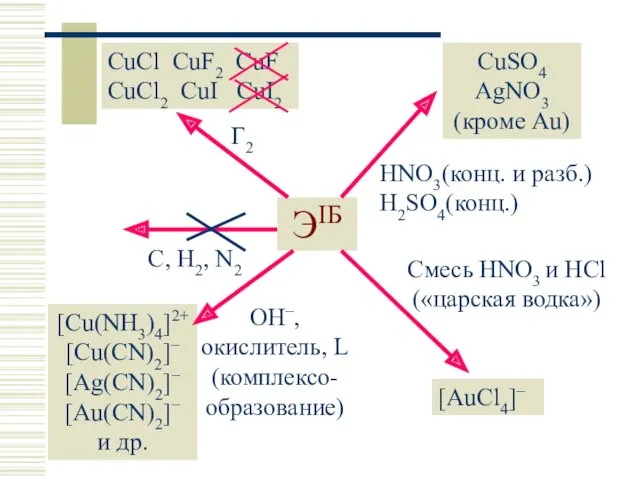
- 9. ЭIБ C, H2, N2 Г2 CuCl CuF2 CuF CuCl2 CuI CuI2 CuSO4 AgNO3 (кроме Au) HNO3(конц.
- 10. Распространение в природе и важнейшие минералы В земной коре: 26. Cu 0,01% масс. 69. Ag 1·10–5
- 11. Минералы халькопирит (FeCu)S2 халькозин Cu2S ковеллин CuS куприт Cu2O малахит Cu2(CO3)2(OH)2 аргентит Ag2S хлораргирит AgCl калаверит
- 12. Добыча золота
- 13. Серебро Ag – уникальный элемент: нет гидратов солей нет аквакомплексов Растворимые соли: AgNO3, AgClO4, AgClO3, AgF
- 14. Серебро 2Ag+ + 2OH– ⮀ Ag2O(т) + H2O ПР(AgOH) = 1,6 ·10–6 2Ag+ + S2– =
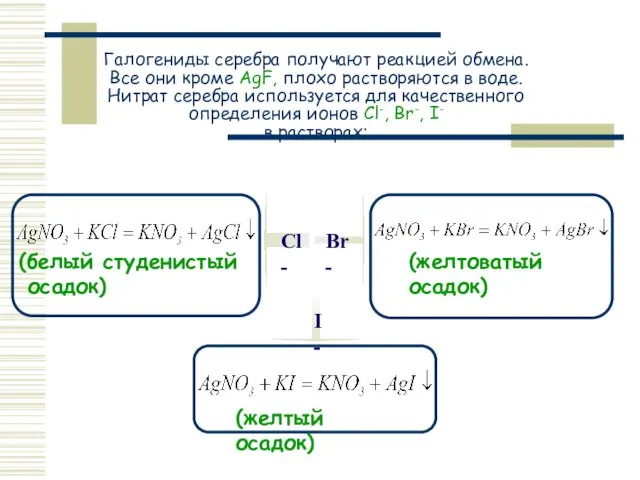
- 15. Галогениды серебра получают реакцией обмена. Все они кроме AgF, плохо растворяются в воде. Нитрат серебра используется
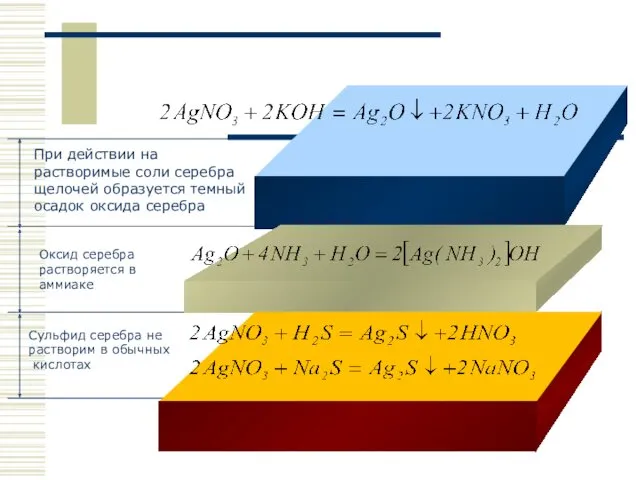
- 16. При действии на растворимые соли серебра щелочей образуется темный осадок оксида серебра Оксид серебра растворяется в
- 17. Свойства золота Не реагирует золото с водородом, азотом, фосфором, углеродом, а галогены с золотом при нагревании
- 18. Щелочи и большинство минеральных кислот на золото не действуют. На этом основан один из способов определения
- 20. Скачать презентацию
![Элементы IБ-группы Общая электронная формула: […] ns1 (n–1)d10 Степени окисления: 0, +I, +II, +III](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/108363/slide-2.jpg)








 Химическая кинетика
Химическая кинетика Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО Химические реакции. (8 класс)
Химические реакции. (8 класс) Сера и ее соединения
Сера и ее соединения Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь
Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь Оксид водорода (H2O)
Оксид водорода (H2O) Жиры и масла
Жиры и масла Искусственные и трансурановые элементы
Искусственные и трансурановые элементы Классификация химических реакций
Классификация химических реакций Практическая работа. Химический состав клетки
Практическая работа. Химический состав клетки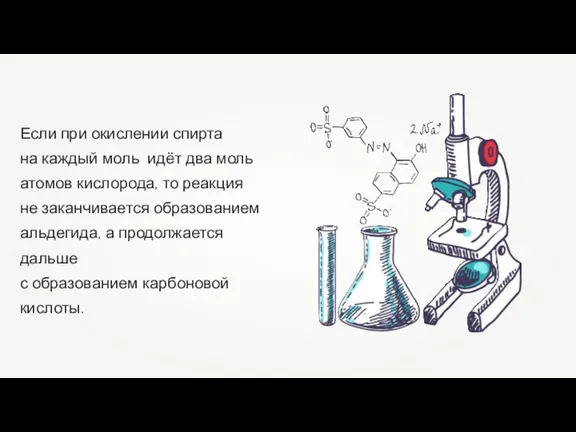 Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура
Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура Кислородные соединения азота
Кислородные соединения азота Вода
Вода Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Химическая организация клетки
Химическая организация клетки Водород
Водород Тұздар гидролизі
Тұздар гидролизі Оксиды. Классификация оксидов
Оксиды. Классификация оксидов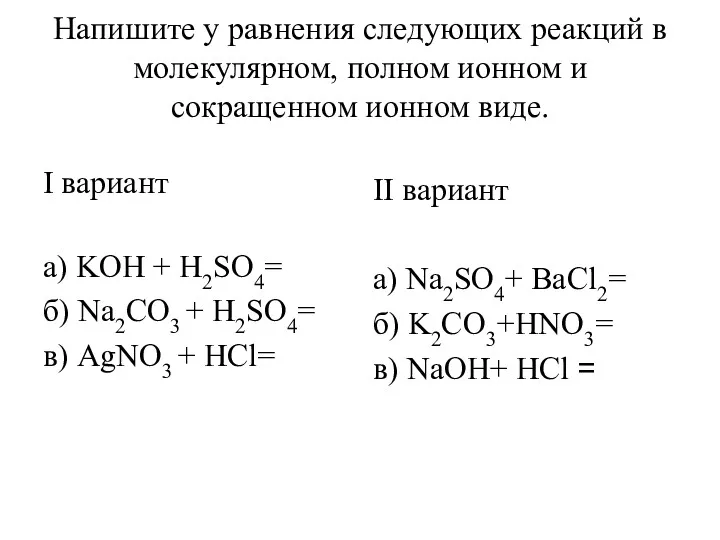 Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде
Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде Относительная атомная и относительная молекулярная масса
Относительная атомная и относительная молекулярная масса Классификация химических реакций (11 класс)
Классификация химических реакций (11 класс) Дробный метод анализа металлических ядов в минерализате (деструктате) (Продолжение)
Дробный метод анализа металлических ядов в минерализате (деструктате) (Продолжение) Ациклические углеводороды
Ациклические углеводороды Растворы
Растворы Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Алкалоиды
Алкалоиды Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Строение и свойства циклоалканов
Строение и свойства циклоалканов