Содержание
- 2. Как образуется раствор?
- 3. Что такое раствор? Растворы – это однородные системы, состоящие из молекул растворителя и частиц растворенного вещества,
- 4. Растворимость Способность вещества образовывать с другими веществами (растворителями) однородные системы – растворы Зависит: От природы растворяемого
- 5. Природа растворенного вещества Вещества хорошо растворимые (в 100г H2O больше 1г вещества) нерастворимые (в 100г H2O
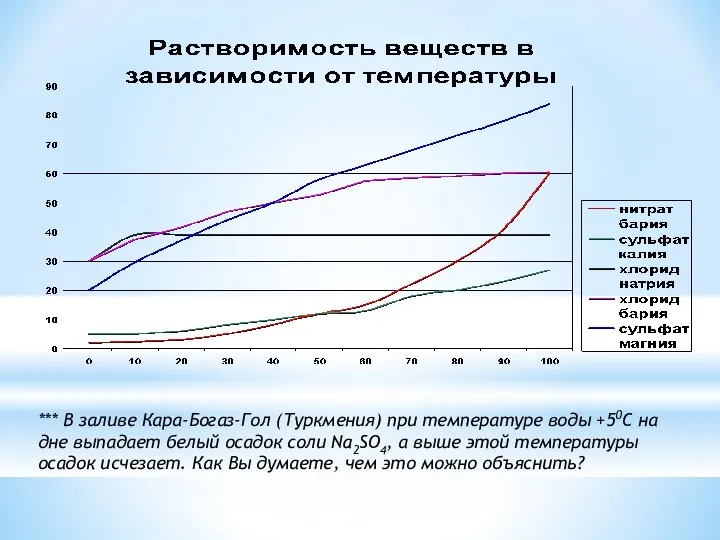
- 6. *** В заливе Кара-Богаз-Гол (Туркмения) при температуре воды +50С на дне выпадает белый осадок соли Na2SO4,
- 7. Растворимость. Растворы Коэффициент растворимости – это масса вещества (г), способная раствориться в одном литре растворителя (л)
- 8. Растворимость Решите задачу. В 400 мл. воды при 200С может раствориться 48 г. сульфата калия. Какова
- 9. Концентрация растворов РАСТВОРЫ разбавленные концентрированные Показатель, характеризующий количество растворенного вещества в растворе мало растворенного вещества много
- 10. Выражение концентрации растворов Один из способов выражения концентрации растворов – массовая доля (w) w w%
- 11. Задача 1. Вычислите массовую долю раствора в %, который получится, если 50 г. вещества растворили в
- 13. Скачать презентацию









 Щелочные металлы IА группы. Литий
Щелочные металлы IА группы. Литий Натуральный каучук
Натуральный каучук Получение и применение спиртов
Получение и применение спиртов Сложные эфиры. Жиры
Сложные эфиры. Жиры Розрахунки за хімічними рівняннями
Розрахунки за хімічними рівняннями Свойства кислот
Свойства кислот Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Электронное строение атома. Периодический закон
Электронное строение атома. Периодический закон Азотная кислота и ее свойства
Азотная кислота и ее свойства Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Химия p-элементов. VI и VII группы главные подгруппы
Химия p-элементов. VI и VII группы главные подгруппы Общая характеристика и классификация топлива
Общая характеристика и классификация топлива Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов
Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов Минералы. Свойства минералов
Минералы. Свойства минералов Глицерин. Свойства и применение
Глицерин. Свойства и применение топ през
топ през Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь
Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь Алгоритм определения вида связи по формуле вещества
Алгоритм определения вида связи по формуле вещества III А – топтың элементтері
III А – топтың элементтері Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома Молекулярные и немолекулярные вещества
Молекулярные и немолекулярные вещества Обезвреживающая функция печени
Обезвреживающая функция печени Химическая связь
Химическая связь Происхождение нефти
Происхождение нефти Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Контрольная работа по дисциплине: химия
Контрольная работа по дисциплине: химия Почва. Интегрированный урок по химии и географии
Почва. Интегрированный урок по химии и географии