Содержание
- 2. Сегодня на уроке мы должны: записать молекулярную и структурную формулы азотной кислоты; изучить химические свойства азотной
- 3. N2O5 HNO3 Ст/о (N) = + 5
- 4. Строение и свойства молекулы азотной кислоты: «дымится на воздухе», на свету желтеет, т. к. подвергается разложению
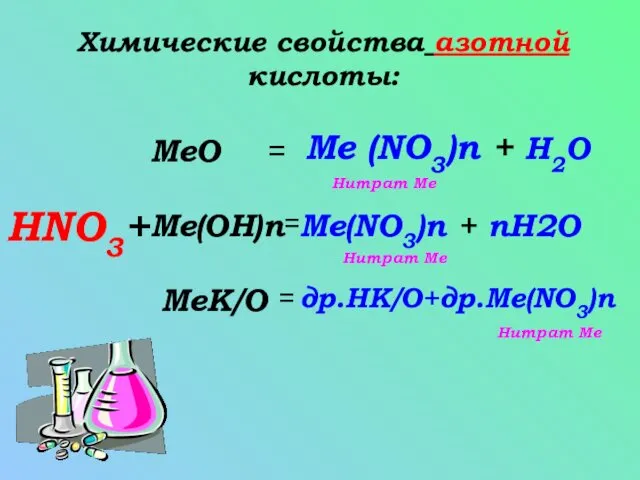
- 5. Химические свойства азотной кислоты: HNO3+ Me(OH)n MeК/О MeO = = = Me (NO3)n + H2O Me(NO3)n
- 6. Свойства концентрированной азотной кислоты: Cu + 4HNO3 = Cu(NO3)2+2H2O + 2NO2 ( конц.) Cu 0 --------
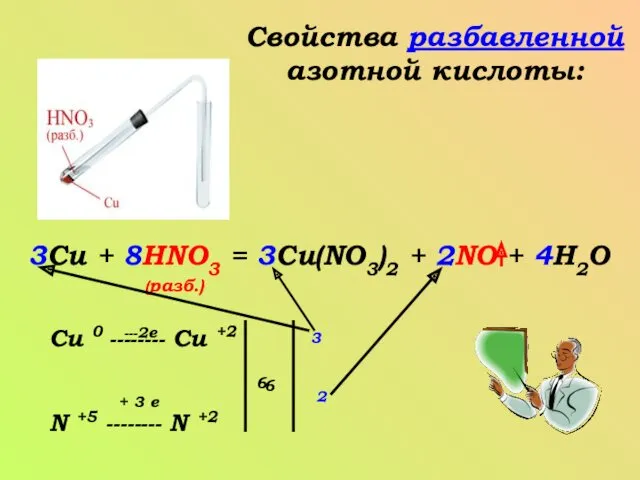
- 7. Свойства разбавленной азотной кислоты: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O (разб.) Cu 0
- 8. Специфические химические свойства концентрированной азотной кислоты Fe , Al + HNO3 ---- НЕ ВЗАИМОДЕЙСТВУЮТ, т.к. образуют
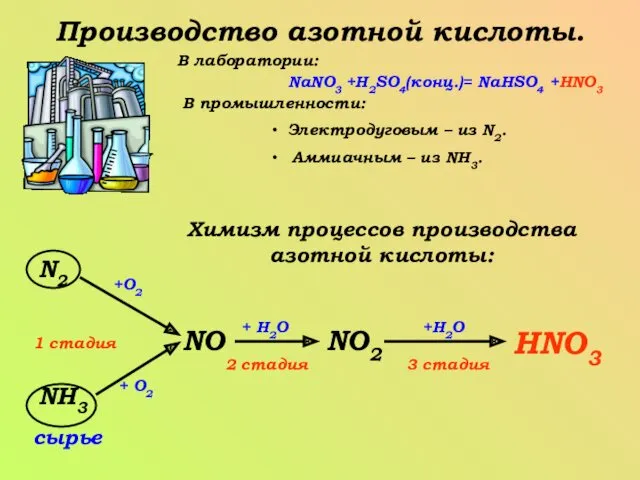
- 9. Производство азотной кислоты. В лаборатории: NaNO3 +H2SO4(конц.)= NaHSO4 +HNO3 В промышленности: Электродуговым – из N2. Аммиачным
- 10. HNO3
- 12. Скачать презентацию





 Химия в быту
Химия в быту Химия 8 класс. Введение в химию
Химия 8 класс. Введение в химию Полиэтилен - термопластичный полимер этилена
Полиэтилен - термопластичный полимер этилена Органическая химия. Олигосахариды. Полисахариды
Органическая химия. Олигосахариды. Полисахариды Химия аминокислот, пептидов и белков
Химия аминокислот, пептидов и белков Химические свойства металлов
Химические свойства металлов Эквивалент. Закон эквивалентов
Эквивалент. Закон эквивалентов Монокристаллы InSb. Свойства, выращивание, применение
Монокристаллы InSb. Свойства, выращивание, применение Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Моносахариды, дисахариды
Моносахариды, дисахариды Металлы. Металлы главной подгруппы
Металлы. Металлы главной подгруппы Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс Общие свойства металлов
Общие свойства металлов Газы, применяемые при сварке
Газы, применяемые при сварке Теория электролитической диссоциации
Теория электролитической диссоциации Соединения углерода
Соединения углерода Предмет органической химии
Предмет органической химии Фазовые равновесия. Физическая и коллоидная химия
Фазовые равновесия. Физическая и коллоидная химия Вуглеводи. Загальна характеристика вуглеводів, представники
Вуглеводи. Загальна характеристика вуглеводів, представники Алкадиены (диеновые углеводороды)
Алкадиены (диеновые углеводороды) Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3
Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3 Полибутадиен
Полибутадиен Биополимеры
Биополимеры Зелёная химия
Зелёная химия Растворы. Способы выражения концентрации раствора
Растворы. Способы выражения концентрации раствора Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Кислородные соединения азота
Кислородные соединения азота Показатели жесткости воды
Показатели жесткости воды