Содержание
- 2. ПЛАН ЛЕКЦИИ: 1. Аминокислоты (строение, классификация). 2. Химические свойства (амфотерность, образование внутренних солей, реакция поликонденсации –
- 3. 1. Аминокислоты (строение, классификация)
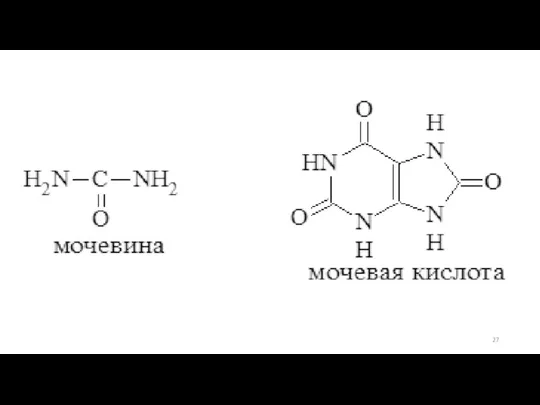
- 4. Аминокислоты – большой класс органических соединений, характерным признаком которых является наличие в составе молекулы двух функциональных
- 5. Аминокислоты (АмК) делят на: – природные; – синтетические.
- 6. АмК условно делятся на: АмК, которые участвуют в образовании пептидов и белков. Для них характерно только
- 7. Особенности строения и стереохимия
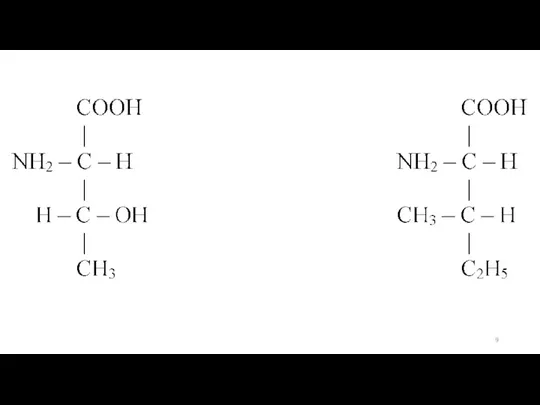
- 8. Истинные абсолютные конфигурации некоторых аминокислот
- 10. Классификация аминокислот по: – значению изоэлектрической точки – нейтральные, основные, кислые; – числу аминогрупп – моноамино-,
- 11. Классификация в зависимости от числа карбоксильных и аминогрупп:
- 12. Классификация по строению углеводородного радикала:
- 13. Классификация по взаимному расположению функциональных групп:
- 14. 2. Химические свойства (амфотерность, образование внутренних солей, реакция поликонденсации – образование пептидной связи). Изоэлектрическая точка
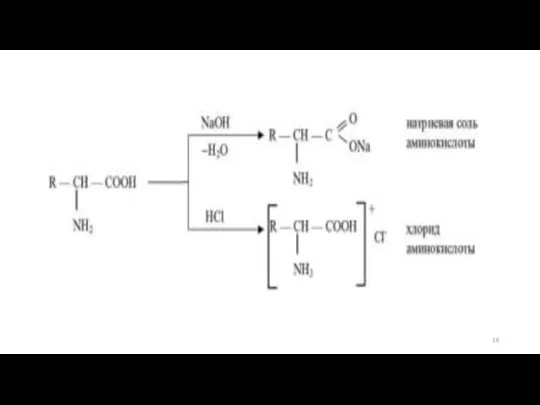
- 15. Аминокислоты – амфотерные вещества, в твердом состоянии они всегда существуют в виде биполярного, двухзарядного иона –
- 17. Образование пептидной связи NH2 – CH2 – COOH + NH2 – CH2 – COOH = NH2
- 18. Изоэлектрическая точка белка
- 19. Изоэлектрическая точка (pI) – значение рН, при котором аминокислота находится в виде биполярного иона.
- 20. Водные растворы аминокислот обладают буферными свойствами. При добавлении кислоты или щелочи аминокислоты приобретают тот или иной
- 21. 3. Биологически важные реакции аминокислот. Декарбоксилирование. Дезаминирование. Трансаминирование (переаминирование)
- 22. Декарбоксилирование – это путь образования биогенных аминов. В организме эта реакция катализируется ферментами – декарбоксилазами.
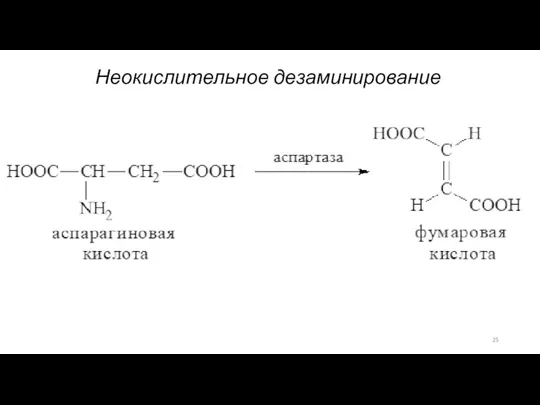
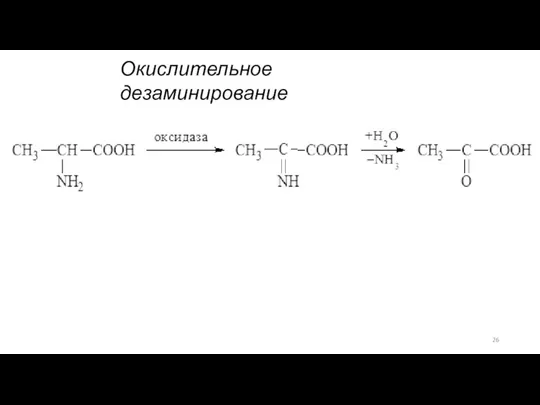
- 24. В организме дезаминирование осуществляется неокислительным и окислительным путями.
- 25. Неокислительное дезаминирование
- 26. Окислительное дезаминирование
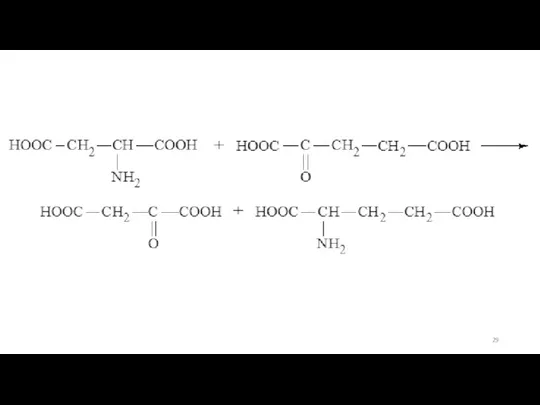
- 28. Трансаминирование (переаминирование) служит не только для разрушения аминокислот, но и для их биосинтеза. Реакция сводится к
- 30. 4. Пептиды, белки (строение, классификация)
- 31. Пептиды, белки, или протеины – высокомолекулярные, азотсодержащие органические полимеры, построенные из остатков α-аминокислот.
- 32. Структура белков: первичная, вторичная, третичная, четвертичная
- 33. Первичная структура определяется факторами: 1) природой АмК, входящих в состав белков; 2) количеством АмК; 3) последовательностью
- 35. Вторичная структура белка – полипептидная цепь, скрученная в спираль, которая удерживается посредством образования слабых, но многочисленных
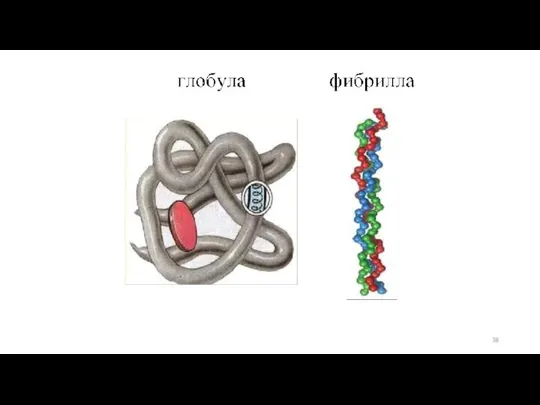
- 37. Третичная структура белка – еще более компактная молекула. Нить АмК далее свертывается, образуя клубок или фибриллу,
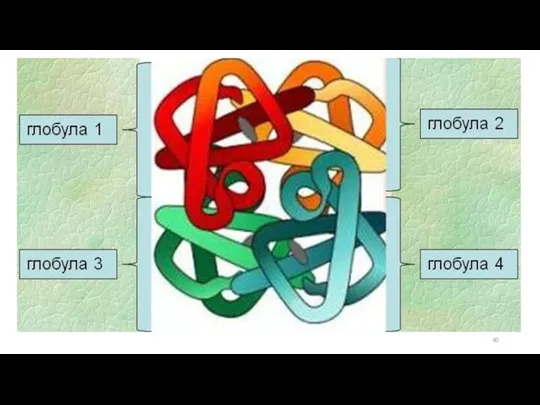
- 39. Четвертичная структура белка характерна не для всех белков. Она возникает в результате соединения нескольких глобул в
- 41. По функциям белки классифицируют: 1. Ферменты. 2. Регуляторные (инсулин, ДНК-связывающие белки). 3. Транспортные (гемоглобин). 4. Структурные
- 42. По составу белки различают: 1. Протеины, состоящие только из аминокислот. 2. Протеиды – содержащие небелковую часть.
- 43. По числу аминокислотных остатков в пептиде различают: – олигопептиды – меньше 10; – полипептиды – до
- 44. Простые белки (протеины): 1) Альбумины. 2) Глобулины. 3) Гистоны. 4) Протамины. 5) Проламины. 6) Кератины. 7)
- 45. Сложные белки (протеиды) Это системы, состоящие из простого белка и небелкового соединения (простетическая группа). Функцию этой
- 46. 1) Фосфопротеиды. 2) Гликопротеиды. 3) Хромопротеиды. 4) Нуклеопротеиды. 5) Липопротеиды.
- 49. Скачать презентацию






































 Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие
Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие Карбоновые кислоты. Классификация карбоновых кислот
Карбоновые кислоты. Классификация карбоновых кислот Классы неорганических веществ (лекция № 4)
Классы неорганических веществ (лекция № 4) Взрывоопасные грузы
Взрывоопасные грузы Кремний и его соединения
Кремний и его соединения Коллоидная химия
Коллоидная химия Вывод формул веществ по массовым долям элементов. 10 класс
Вывод формул веществ по массовым долям элементов. 10 класс Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Лекция_3_Химические_и_физические_свойства_алканов_и_циклоалканов (1)
Лекция_3_Химические_и_физические_свойства_алканов_и_циклоалканов (1) Азотная кислота
Азотная кислота Типы химических реакций
Типы химических реакций Оксиды, их классификация и свойства
Оксиды, их классификация и свойства Кристаллы и минералы
Кристаллы и минералы Знатоки химии. Викторина
Знатоки химии. Викторина Особенности строения, реакционной способности и методы синтеза карбоновых кислот и функциональных производных
Особенности строения, реакционной способности и методы синтеза карбоновых кислот и функциональных производных Свойства смесей ПАВ
Свойства смесей ПАВ Реологические свойства полимеров
Реологические свойства полимеров Камни и Телец
Камни и Телец Химическая связь
Химическая связь Основные понятия и законы химии
Основные понятия и законы химии Основные положения теории растворов электролитов, используемых в аналитической химии
Основные положения теории растворов электролитов, используемых в аналитической химии Химические профессии на стройках Олимпиады
Химические профессии на стройках Олимпиады Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Номенклатура органических соединений
Номенклатура органических соединений Қышқылдар мен сілтілер тепе-теңдігі
Қышқылдар мен сілтілер тепе-теңдігі Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов
Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов Неметаллические и композиционные материалы
Неметаллические и композиционные материалы