Содержание
- 2. Алканы Основные химические связи у алканов — это ковалентная неполярная связь между атомами углерода (С—С) и
- 3. Физические свойства: алканы, в составе молекулы которых от 16 атомов углерода, — твердые вещества. алканы, в
- 4. С увеличением количества атомов углерода в структуре молекулы и с ее формой в пространстве связана одна
- 5. Химические свойства: для алканов характерны реакции замещения. Галогенирование Правило Зайцева: водород отщепляется преимущественно от наименее гидрогенизированного
- 6. Реакция нитрования (реакция Коновалова) Дегидрирование (отщепление водорода) Горение(реакция с кислородом)
- 7. Получение алканов: Синтез из оксида углерода (II) и водорода для метана: CO + 3H2 → CH4
- 8. Реакция Вюрца (взаимодействие активных металлов с галогенпроизводными алканов) Метод синтеза симметричных насыщенных углеводородов действием металлического натрия
- 9. Циклоалканы это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл Общая формула циклоалканов CnH2n, где n≥3
- 10. Пpи ноpмальных условиях С3-С4 – газы, С5 – С16 – жидкости, начиная с С17 – твердые
- 11. Химические свойства Гидрирование (присоединение водорода) Галогенирование Циклопропан и циклобутан реагируют с галогенами, при этом тоже происходит
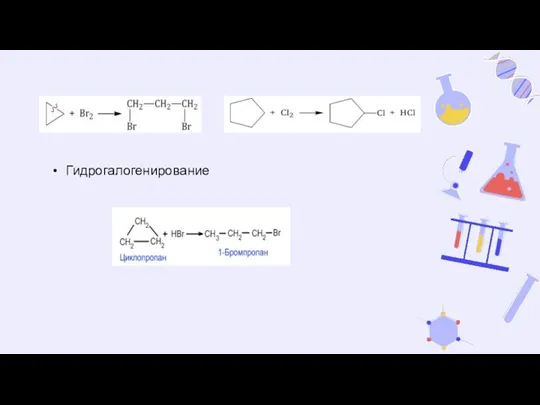
- 12. Гидрогалогенирование
- 13. Получение Каталитическое дегидрирование алканов Дегалогенирование дигалегеналканов Лабораторный способ получения циклоалканов С3-С5 – действие активных металлов (Zn,
- 14. Алкены
- 15. Химические свойства: 1. Гидрирование 2. Гидратация Гидратация алкенов идет в присутствии минеральных кислот, чаще всего серной,
- 16. 3. Галогенирование 4. Алкены присоединяют галогеноводороды. 5. Окисление раствором калия перманганата
- 17. Получение: 1.Дегидратация спиртов 2. Дегидрогалогенирование галогеналканов При действии спиртового раствора щелочи на моногалогенопроизводные отщепляется галогеноводород и
- 18. 3. Дегидрирование алканов Это промышленный метод получения алкенов. Реакцию проводят при температуре не выше 600оС во
- 19. Алкины
- 20. Химические свойства 1.Гидрирование 2.Гидрогалогенирование При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как
- 21. 3. Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II). Сначала образуется
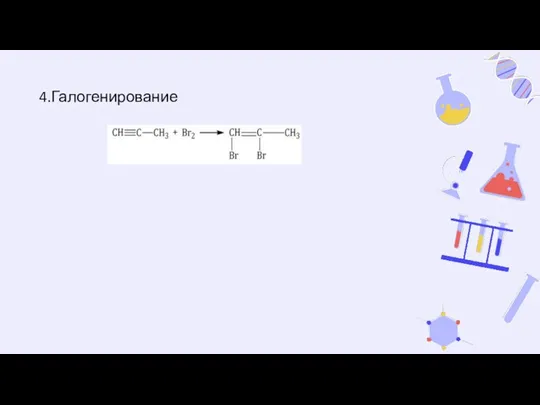
- 22. 4.Галогенирование
- 23. Способы получение: 1.Пиролиз алканов 2. Пиролиз метана – это промышленный способ получения ацетилена 3. Лабораторный способ
- 24. Алкадиены это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода
- 25. Химические свойства 1.Гидрирование 2.Галогенирование
- 26. Способы получения 1.Дегидрирование алканов 2.Синтез Лебедева Нагревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO)
- 27. Арены это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с
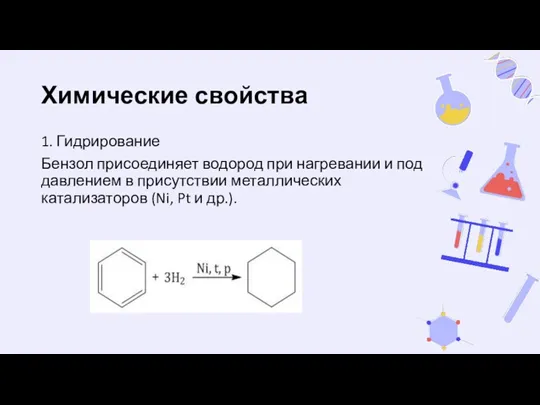
- 28. Химические свойства 1. Гидрирование Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов
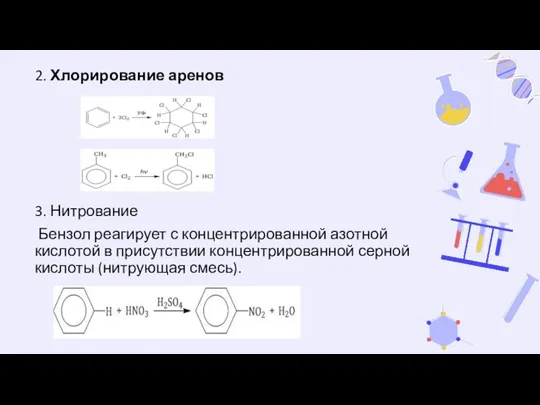
- 29. 2. Хлорирование аренов 3. Нитрование Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты
- 30. Способы получения Дегидроциклизация алканов 2. Тримеризация ацетилена
- 32. Скачать презентацию

























 Сабын
Сабын Азотная кислота. К уроку химии для 9 класса
Азотная кислота. К уроку химии для 9 класса Волшебница - вода
Волшебница - вода Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Предельные и непредельные углеводороды
Предельные и непредельные углеводороды Действующие вещества. Лексикон
Действующие вещества. Лексикон Курс Материаловедение. Введение
Курс Материаловедение. Введение Классификация химических элементов
Классификация химических элементов Природные источники углеводородов
Природные источники углеводородов Теплогенерация. Топливо и его горение
Теплогенерация. Топливо и его горение Аммиак
Аммиак Хімія та обмін вуглеводів
Хімія та обмін вуглеводів Галогены. Астат
Галогены. Астат Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Вред Coca-Cola на организм человека
Вред Coca-Cola на организм человека Сульфиды — природные сернистые соединения металлов и некоторых неметаллов
Сульфиды — природные сернистые соединения металлов и некоторых неметаллов Номенклатура углеводородов: алканов алкенов алкинов. Создание учебного пособия
Номенклатура углеводородов: алканов алкенов алкинов. Создание учебного пособия Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Соединения кремния
Соединения кремния Відкриття та походження хімічних елементів
Відкриття та походження хімічних елементів Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Алкалоиды. Выделение и очистка алкалоидов
Алкалоиды. Выделение и очистка алкалоидов Координационные комплексные соединения
Координационные комплексные соединения Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты
Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты Ионные уравнения
Ионные уравнения Жиры
Жиры