Содержание
- 2. Что такое оксиды? Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых
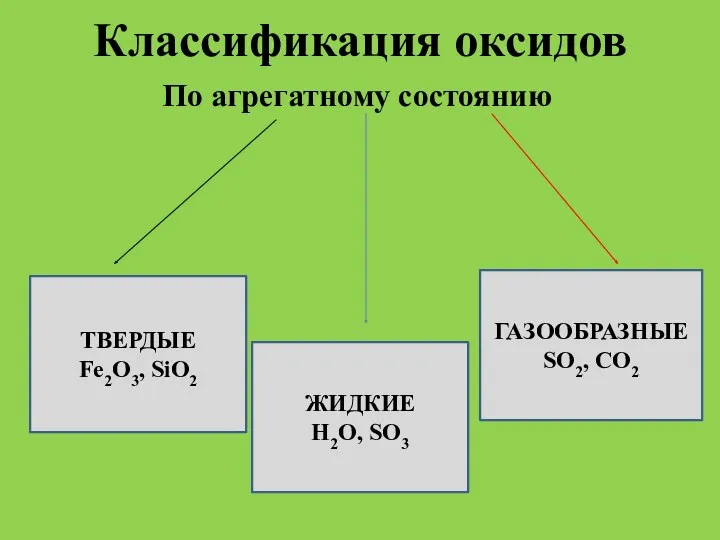
- 3. Классификация оксидов По агрегатному состоянию ТВЕРДЫЕ Fe2O3, SiO2 ЖИДКИЕ Н2О, SO3 ГАЗООБРАЗНЫЕ SO2, CO2
- 4. Пример твердого оксида Песок – диоксид кремния SiO2 с небольшим количеством примесей.
- 5. Пример жидкого оксида Вода – оксид водорода Н2O.
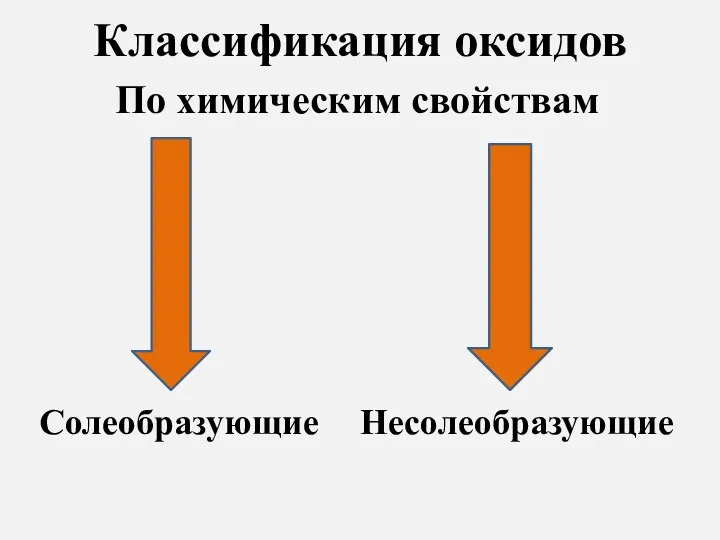
- 6. Классификация оксидов По химическим свойствам Солеобразующие Несолеобразующие
- 7. Классификация оксидов Несолеобразующие оксиды – такие оксиды, которые не взаимодействуют ни с кислотами, ни с щелочами
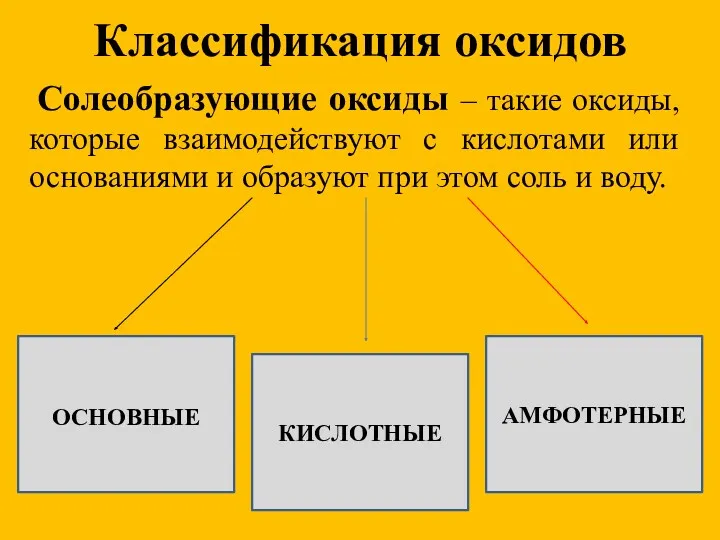
- 8. Классификация оксидов Солеобразующие оксиды – такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при
- 9. Основные оксиды Основные оксиды – это такие оксиды, которым соответствуют основания. Например: MgO соответствует Mg(OH)2 Na2O
- 10. Кислотные оксиды Кислотные оксиды – это такие оксиды, которым соответствуют кислоты. Например: SO3 соответствует H2SO4 CO2
- 11. Типичные реакции основных оксидов 1) Основной оксид + кислота = соль + вода 2) Основной оксид
- 12. Типичные реакции основных оксидов 1) Основной оксид + кислота = соль + вода Например: CuO +
- 13. Типичные реакции основных оксидов 2) Основной оксид + кислотный оксид = соль Например: СaO + N2O5
- 14. Типичные реакции основных оксидов 3) Основной оксид + вода = щелочь Например: K2O + H2O =
- 15. Типичные реакции кислотных оксидов 1) Кислотный оксид + основание = соль + вода 2) Кислотный оксид
- 16. Типичные реакции кислотных оксидов 1) Кислотный оксид + основание = соль + вода Например:SO2 + 2KOH
- 17. Типичные реакции кислотных оксидов 1) Кислотный оксид + основной оксид = соль Например: SO3 + K2O
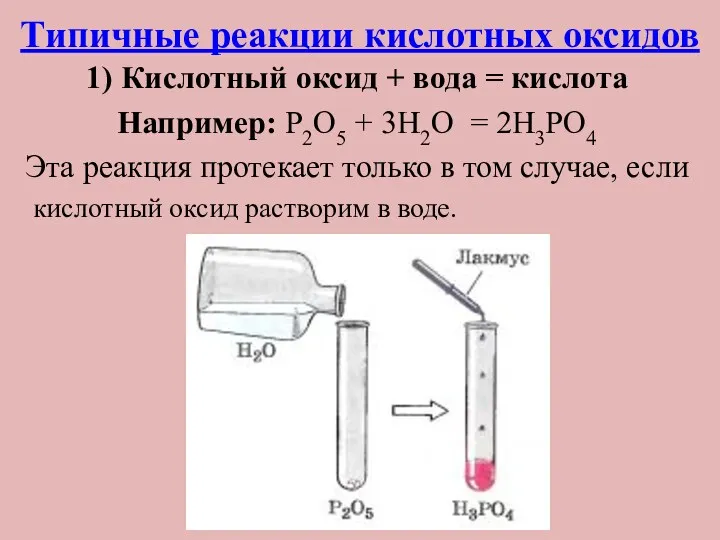
- 18. Типичные реакции кислотных оксидов 1) Кислотный оксид + вода = кислота Например: P2O5 + 3H2O =
- 19. Обобщение темы: Вопрос-ответ: Что такое оксиды? Какие оксиды называются основными? В каком случае кислотный оксид взаимодействует
- 20. Обобщение темы: Тест: «Правильный ответ» 1) Какой из оксидов несолеобразующий: а) P2O5 б) NO в) SO3
- 21. Правильно .
- 22. Неправильно .
- 23. Ответы на вопросы: 1) Оксиды – это сложные вещества, состоящие из двух химических элементов, один из
- 24. Домашнее задание: § 40 Упр. 1, 2, 3.
- 26. Скачать презентацию



















 Аминокислоты
Аминокислоты Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы Хром, марганец
Хром, марганец Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Галогены. Строение атомов фтора и хлора
Галогены. Строение атомов фтора и хлора Производство азотной кислоты
Производство азотной кислоты Оксид серы(4). Сернистая кислота и её соли
Оксид серы(4). Сернистая кислота и её соли Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов Органическая химия
Органическая химия Емтихан сұрақтары
Емтихан сұрақтары Основные виды химических связей
Основные виды химических связей Фенолы
Фенолы Пластик, пластмасса
Пластик, пластмасса Полімери. Їх властивості та застосування
Полімери. Їх властивості та застосування Растворы. Лекция 7
Растворы. Лекция 7 Фосфор и его соединения. 11 класс
Фосфор и его соединения. 11 класс Розчин та його компоненти
Розчин та його компоненти Химическая промышленность
Химическая промышленность Химические свойства оснований, кислот и солей в свете теории электролитической диссоциации
Химические свойства оснований, кислот и солей в свете теории электролитической диссоциации Молекулярно-кинетические свойства дисперсных систем
Молекулярно-кинетические свойства дисперсных систем Карбоновые кислоты. Строение
Карбоновые кислоты. Строение Вредные вещества в продуктах питания
Вредные вещества в продуктах питания Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Растворы ВМС
Растворы ВМС Технологии создания и обработки кристаллических материалов
Технологии создания и обработки кристаллических материалов Nucleic acids
Nucleic acids Швидкість хімічної реакції
Швидкість хімічної реакції Констукционные и функциональные волокнистые композиты
Констукционные и функциональные волокнистые композиты