Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие презентация
Содержание
- 2. Обратимые и необратимые химические реакции Химические реакции, протекающие в одном направлении, называются необратимыми. Химические реакции, протекающие
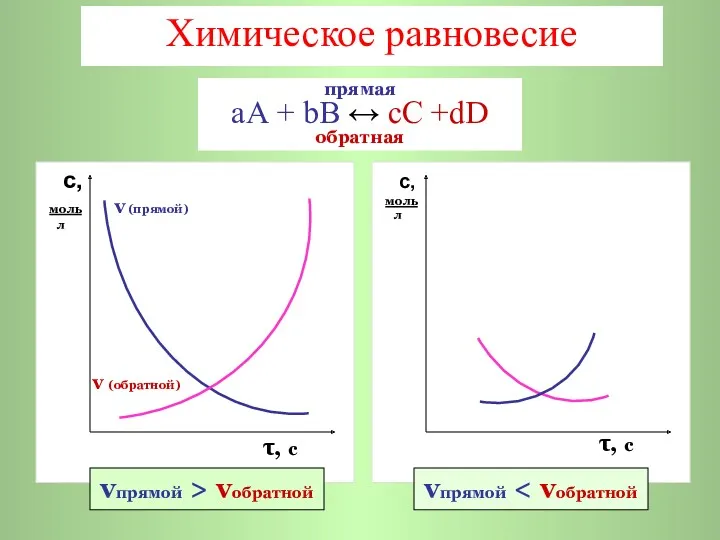
- 3. Химическое равновесие с, моль v (прямой) л v (обратной) τ, с с, моль л τ, с
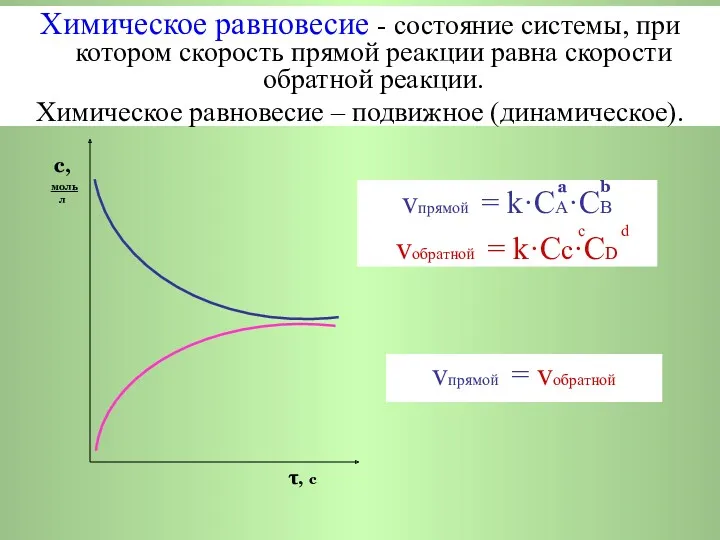
- 4. a b vпрямой = k·CA·СB с d vобратной = k·Cс·СD с, моль л τ, с vпрямой
- 5. Принцип Ле-Шателье: «Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то
- 6. 1. Концентрация: а) при увеличении концентрации исходных веществ равновесие смещается в сторону прямой реакции (вправо); б)
- 8. Скачать презентацию



 Кислоты. Состав кислот
Кислоты. Состав кислот Химические свойства металлов
Химические свойства металлов Физические свойства минералов
Физические свойства минералов Алкены. Пропилен C₃H₆
Алкены. Пропилен C₃H₆ Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Классификация веществ в зависимости от типа химической связи
Классификация веществ в зависимости от типа химической связи Цикли трикарбонових кислот
Цикли трикарбонових кислот Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Растворы. Смеси веществ
Растворы. Смеси веществ Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Ионная химическая связь
Ионная химическая связь Железо. Fe (лат. Феррум)
Железо. Fe (лат. Феррум) Кислород
Кислород Окислительно-восстановительные реакции. Лекция 8
Окислительно-восстановительные реакции. Лекция 8 Химическая посуда и ее назначения (6)
Химическая посуда и ее назначения (6) Дослідження якісного складу солей. Практична робота №1
Дослідження якісного складу солей. Практична робота №1 Дисахариды, моносахариды
Дисахариды, моносахариды Технологическое проектирование процессов переработки пэн
Технологическое проектирование процессов переработки пэн Амінокислоти. Класифікація та номенклатура
Амінокислоти. Класифікація та номенклатура Активизация познавательной деятельности учащихся на уроках химии
Активизация познавательной деятельности учащихся на уроках химии 20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii
20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii Цинк в функциональных пищевых и кормовых продуктах
Цинк в функциональных пищевых и кормовых продуктах Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Оксид кальция (СаО)
Оксид кальция (СаО) Действующие вещества. Лексикон
Действующие вещества. Лексикон