Содержание
- 2. Альдегиды Кетоны 1. Это органические вещества, молекулы которых содержат карбонильную группу, связанную с атомом водорода и
- 3. 20.04.2020 Середа Надежда Гавриловна
- 4. 20.04.2020 Середа Надежда Гавриловна
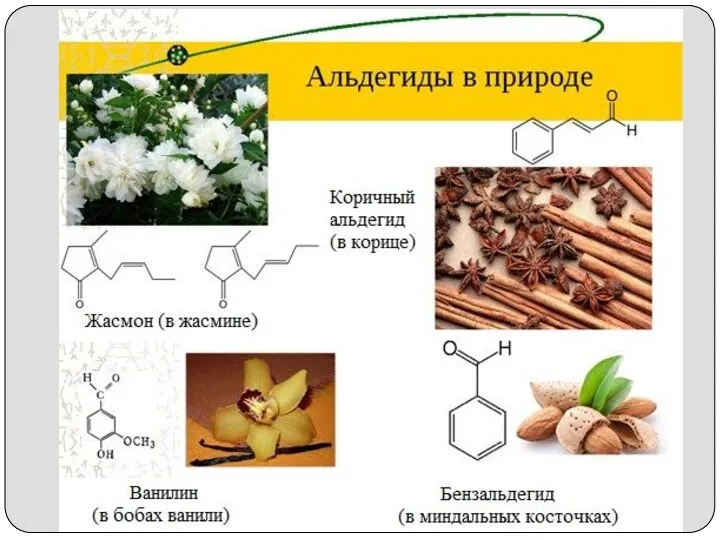
- 5. 20.04.2020 Середа Надежда Гавриловна
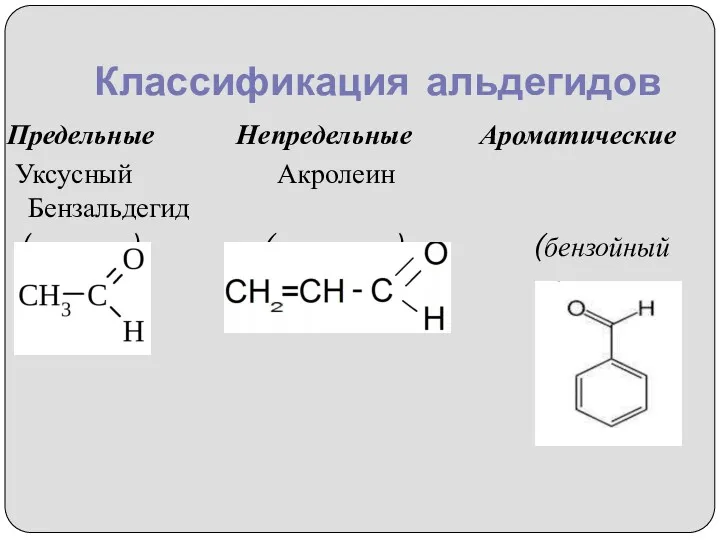
- 6. Классификация альдегидов Предельные Непредельные Ароматические Уксусный Акролеин Бензальдегид (этаналь) (пропеналь) (бензойный альдегид)
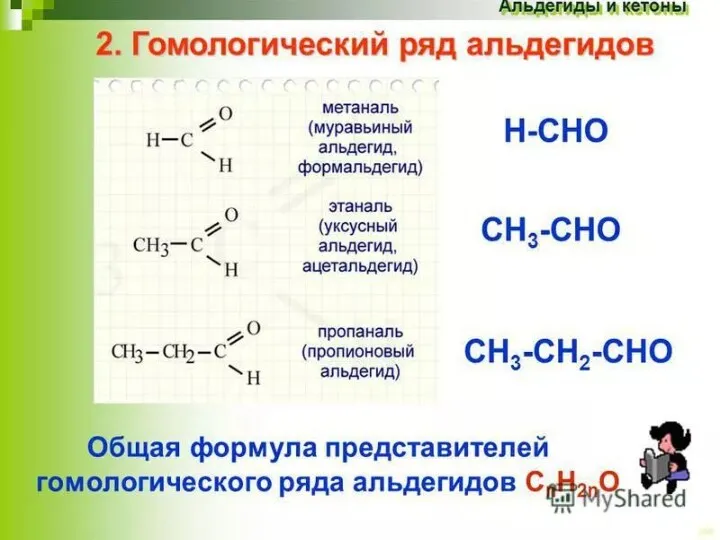
- 8. Номенклатура и изомерия Альдегиды: Бутаналь - Пентаналь - Кетоны: Пропанон -2 - Бутанон -2 - Пентанон
- 9. Физические свойства альдегидов. Метаналь (формальдегид) – газ, альдегиды С2-C5 – жидкости, высшие альдегиды – твердые вещества.
- 10. Получение альдегидов: 1. Окисление первичных спиртов: а) кислородом окислителя (K2Cr2O7 или KMnO4 в кислой среде) CH3−OH
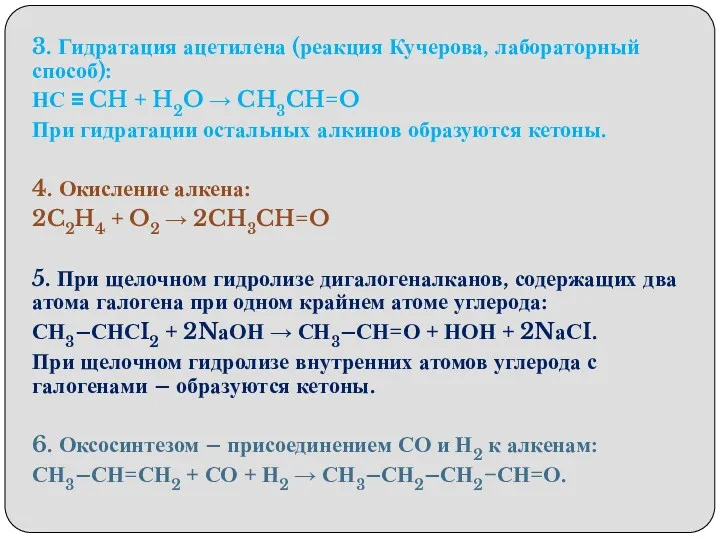
- 11. 3. Гидратация ацетилена (реакция Кучерова, лабораторный способ): НС ≡ CH + H2O → CH3CH=O При гидратации
- 12. Химические свойства I. Реакции восстановления При гидрировании альдегидов образуются первичные спирты: СН3–СН=О + Н2 → СН3–СН2−ОН
- 13. 2. Вступают в реакцию со свежеприготовленным раствором гидроксида меди(II) при нагревании: CH3CH=O + 2Cu(OH)2↓→ CH3COOH +
- 15. Скачать презентацию








 Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ III А – топтың элементтері
III А – топтың элементтері Удивительные свойства воды
Удивительные свойства воды Гидролиз солей (11 класс)
Гидролиз солей (11 класс) Кристаллизация. Структура жидких металлов
Кристаллизация. Структура жидких металлов Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз
Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз Алкены. Строение алкенов, характерные типы химических реакций
Алкены. Строение алкенов, характерные типы химических реакций Кремнийдің құрамы, құрылысы және қасиеттері
Кремнийдің құрамы, құрылысы және қасиеттері Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Химиялық элемент оттегі
Химиялық элемент оттегі Теплота горения
Теплота горения Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Фенолдар, аминдер, альдегидтер
Фенолдар, аминдер, альдегидтер СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ В СИСТЕМЕ Со(II)-ЭДТА-H2O2
СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ В СИСТЕМЕ Со(II)-ЭДТА-H2O2 Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Некоторые d-элементы
Некоторые d-элементы Пенообразование в растворах поверхностно-активных веществ. Лекция 13
Пенообразование в растворах поверхностно-активных веществ. Лекция 13 Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Химические свойства солей
Химические свойства солей Хімічні явища, їх ознаки
Хімічні явища, їх ознаки Особенности органических веществ. Классификация органических соединений. 9 класс
Особенности органических веществ. Классификация органических соединений. 9 класс Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Алюминий. Определите элемент
Алюминий. Определите элемент 20230219_prezentatsiya_k_uroku_neft
20230219_prezentatsiya_k_uroku_neft 20231028_kislorod
20231028_kislorod Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов