Содержание
- 2. Цели урока Знать: строение алкенов, характерные типы химических реакций (реакции присоединения, полимеризации, окисления), применение алкенов на
- 3. Понятие об алкенах Алкены – углеводороды, содержащие в молекуле одну двойную связь между атомами углерода, а
- 4. Характеристика двойной связи (С ═ С) Вид гибридизации – Валентный угол – Длина связи С =
- 5. Гомологический ряд алкенов Этен Пропен Бутен Пентен Гексен Гептен C2H4 C3H6 C4H8 C5H10 C6H12 C7H14 Общая
- 6. Изомерия алкенов Для алкенов возможны два типа изомерии: 1-ый тип – структурная изомерия: углеродного скелета положения
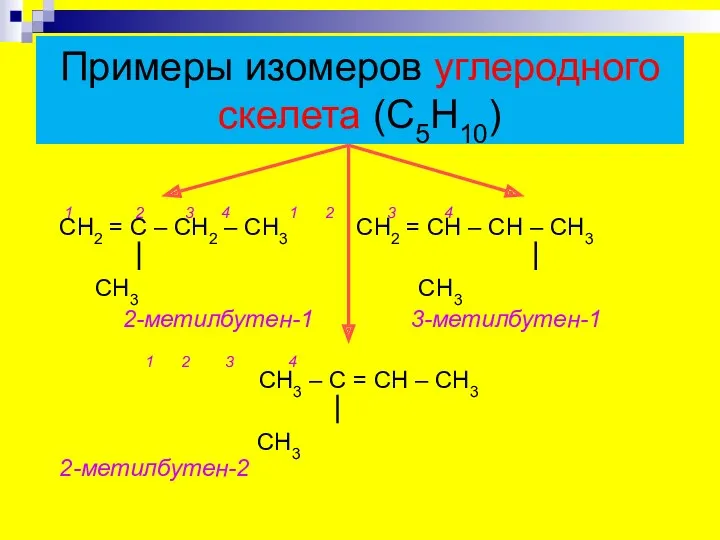
- 7. Примеры изомеров углеродного скелета (С5Н10) 1 2 3 4 1 2 3 4 СН2 = С
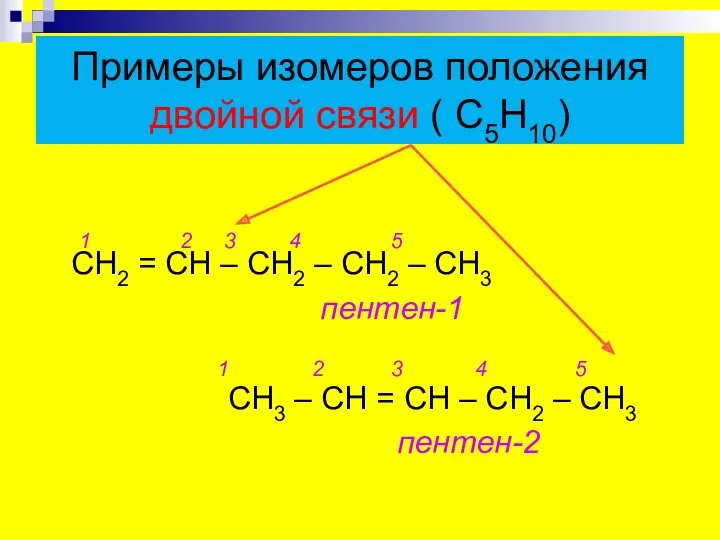
- 8. Примеры изомеров положения двойной связи ( С5Н10) 1 2 3 4 5 СН2 = СН –
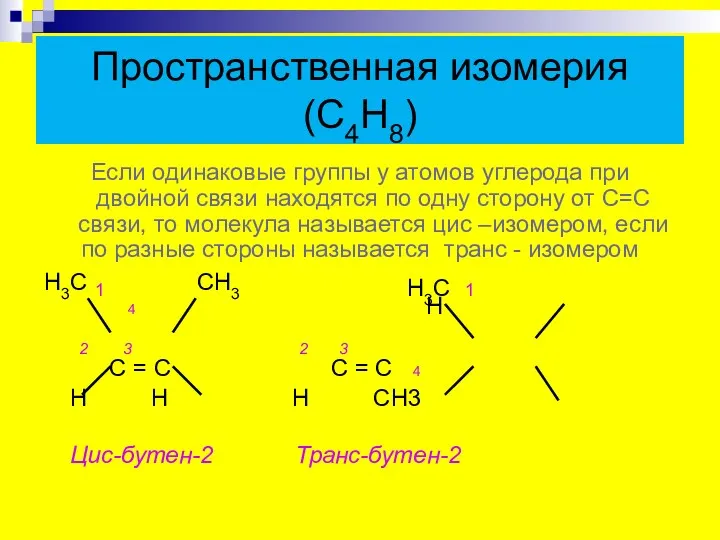
- 9. Пространственная изомерия (С4Н8) Если одинаковые группы у атомов углерода при двойной связи находятся по одну сторону
- 10. Геометрические изомеры бутена Цис-изомер Транс-изомер
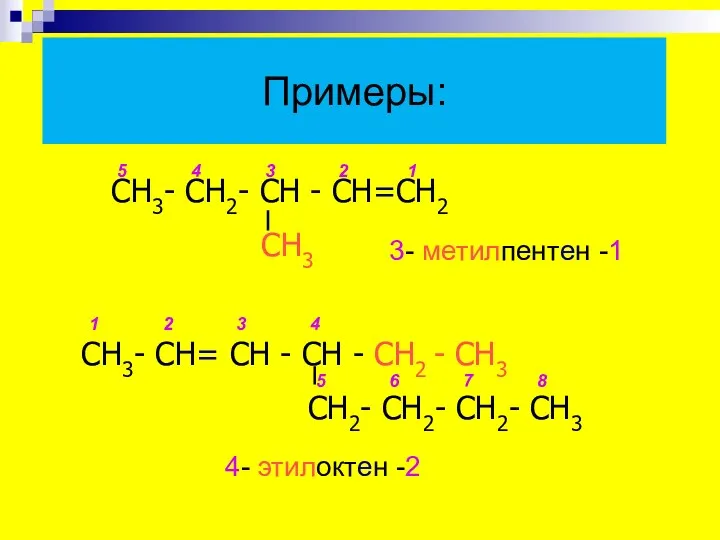
- 11. Примеры: 4- этилоктен -2 СН3- СН2- СН - СН=СН2 СН3 СН3- СН= СН - СН -
- 12. Физические свойства алкенов Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях. С2– С4
- 13. Химические свойства алкенов По химическим свойствам алкены резко отличаются от алканов. Алкены более химически активные вещества,
- 14. Типы химических реакций, которые характерны для алкенов Реакции присоединения. Реакции полимеризации. Реакции окисления.
- 15. Реакции присоединения 1. Гидрирование. CН2 = СН2 + Н2 СН3 – СН3 Этен этан Условия реакции:
- 16. Реакции присоединения 3. Гидрогалогенирование. 1 2 3 4 1 2 3 4 СН2 = СН –
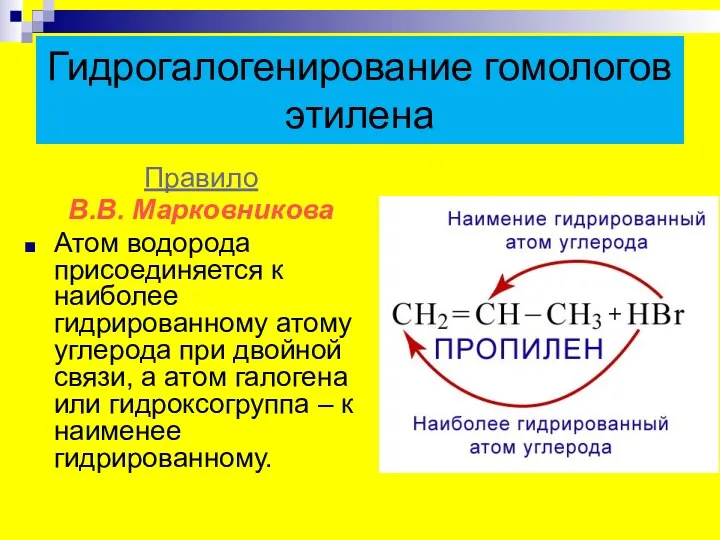
- 17. Гидрогалогенирование гомологов этилена Правило В.В. Марковникова Атом водорода присоединяется к наиболее гидрированному атому углерода при двойной
- 18. Реакции полимеризации (свободно-радикальное присоединение) Полимеризация – это последовательное соединение одинаковых молекул в более крупные. σ σ
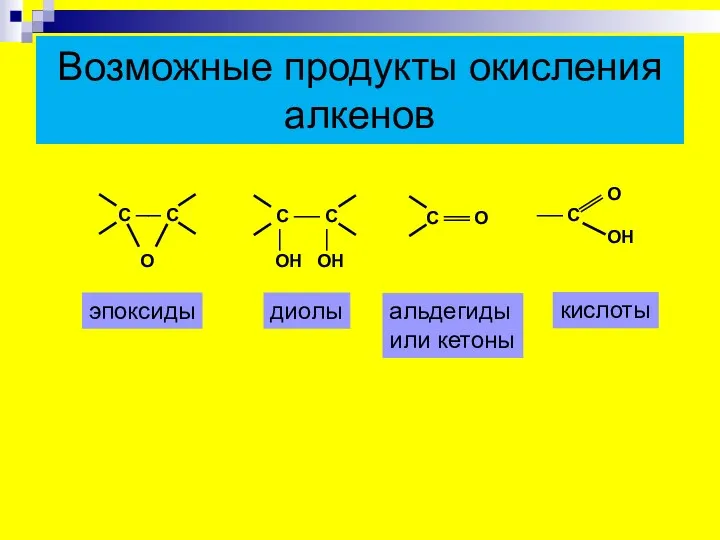
- 19. Возможные продукты окисления алкенов эпоксиды диолы альдегиды или кетоны кислоты
- 20. Реакции окисления Реакция Вагнера. (Мягкое окисление раствором перманганата калия). 3СН2 = СН2 + 2КМnО4 + 4Н2О
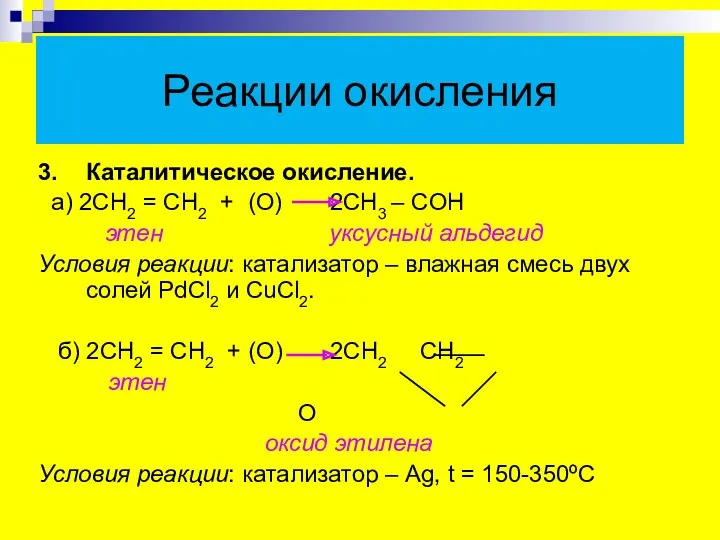
- 21. Реакции окисления 3. Каталитическое окисление. а) 2СН2 = СН2 + (О) 2СН3 – CОН этен уксусный
- 22. Горение алкенов Алкены горят красноватым светящимся пламенем, в то время как пламя предельных углеводородов голубое. Массовая
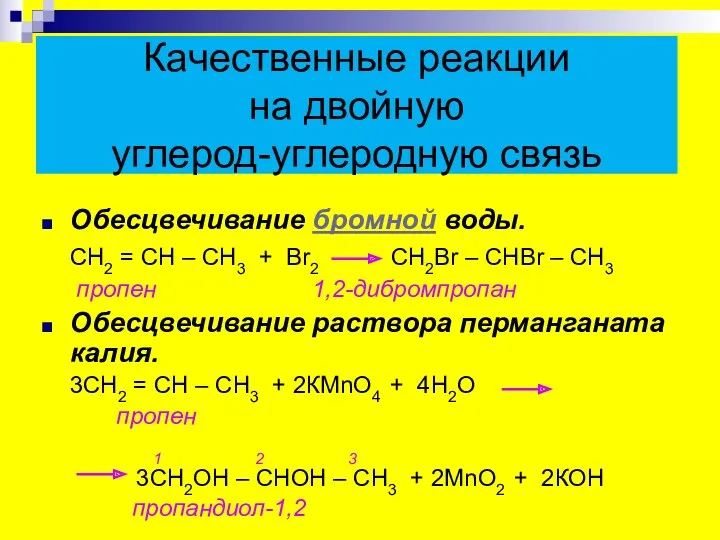
- 23. Качественные реакции на двойную углерод-углеродную связь Обесцвечивание бромной воды. СН2 = СН – СН3 + Вr2
- 24. Применение Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры
- 25. Это интересно Всем известный полиэтилен был получен был получен в 1933 году Э. Фосеттом и Р.
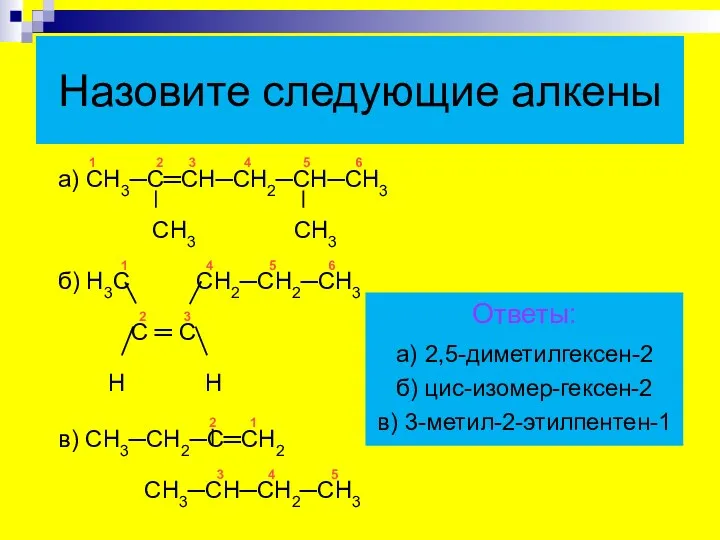
- 26. 1 2 3 4 5 6 а) СН3─С═СН─СН2─СН─СН3 СН3 СН3 1 4 5 6 б) Н3С
- 28. Скачать презентацию
















 Классификация минералов по химическому принципу. Занятие 9
Классификация минералов по химическому принципу. Занятие 9 Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру
Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева Химия и продукты питания
Химия и продукты питания Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Золото
Золото Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Важнейшие нефтепродукты. Области их применения
Важнейшие нефтепродукты. Области их применения 29 Кинетика идеальных проточных ректоров (2)
29 Кинетика идеальных проточных ректоров (2) Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли
Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли Занимательные опыты
Занимательные опыты Роль металлов в нашей жизни
Роль металлов в нашей жизни Керамические материалы
Керамические материалы Нитрофенилалкиламины
Нитрофенилалкиламины Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс Растворы. Часть 2
Растворы. Часть 2 Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Центрифугирование
Центрифугирование Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе
Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе Общая характеристика элементов главной подгруппы второй группы
Общая характеристика элементов главной подгруппы второй группы fosfor_i_ego_soedineniya
fosfor_i_ego_soedineniya Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями