Содержание
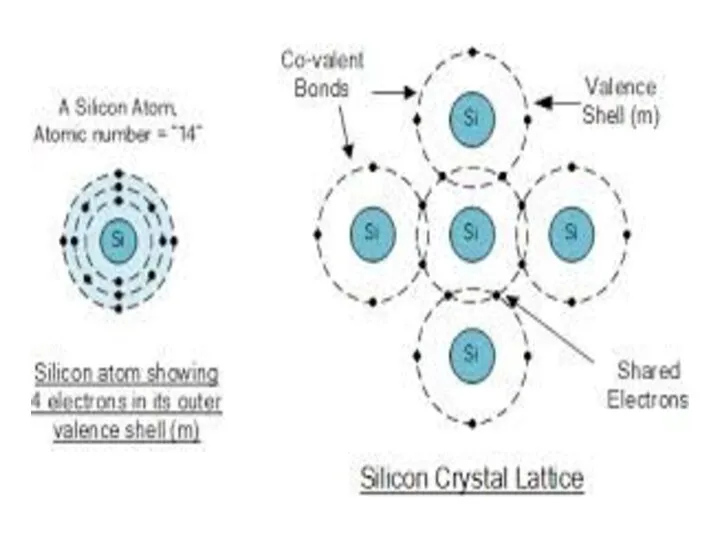
- 4. Атомдар арасында ортақ электрондық жұп арқылы түзілетін байланыс ковалентті байланыс деп аталады. Электртерістілік мәндері өте үлкен
- 5. Кристалдық тордың беріктілігін салыстармалы түрде былай сипаттауға болады: Атомдық ˃ Металдық ˃ Иондық ˃ Молекулалық. Ескеретін
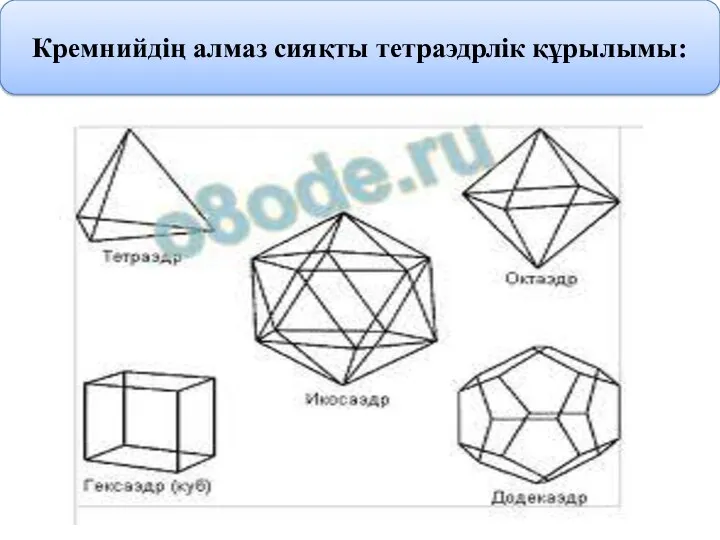
- 7. Кремнийдің алмаз сияқты тетраэдрлік құрылымы:
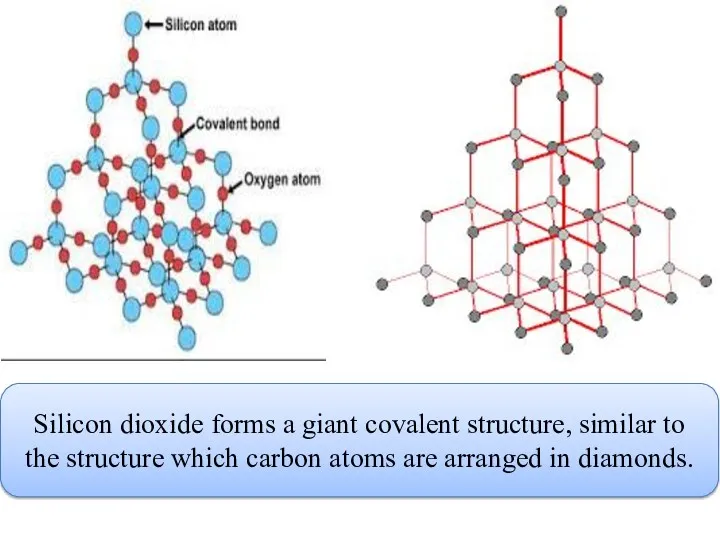
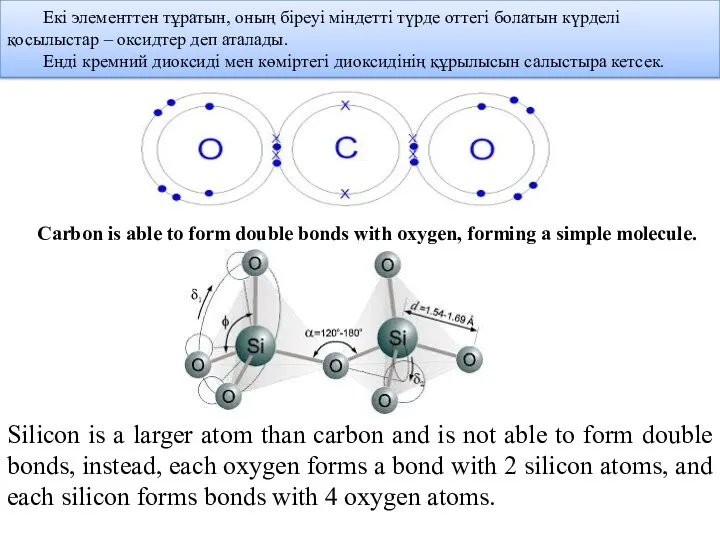
- 8. Silicon dioxide forms a giant covalent structure, similar to the structure which carbon atoms are arranged
- 9. Жоғарыдағы суреттегі кремний диоксидінің молекуласын макромолекула деп атауға болады, бұл жерде тек бір ғана SiO2 молекуласы
- 10. Кремнийдің екі аллотропиялық түр өзгерісі бар: кристалды және аморфты. Кристалл кремний – металдық жылтыры бар, сұр
- 11. Екі элементтен тұратын, оның біреуі міндетті түрде оттегі болатын күрделі қосылыстар – оксидтер деп аталады. Енді
- 12. Кремний диоксиді және оның құрылымы мен қасиеті Кремний оттекпен екі түрлі оксид түзе алады. Кремний (ІІ)
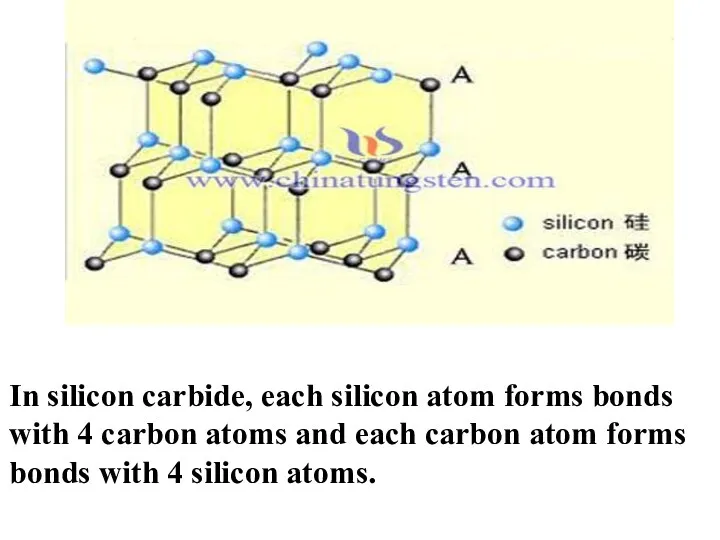
- 13. Кремний карбиді және оның құрылымы мен қасиеті Карби́д кре́мния — бинарное неорганическое химическое соединение кремния с
- 14. In silicon carbide, each silicon atom forms bonds with 4 carbon atoms and each carbon atom
- 15. Кремнийдің жер қыртысында таралуы, кремний кездесетін минералдар Табиғатта таралуы жағынан салмағы бойынша кремний оттектен кейін екінші
- 16. Кристалдық кремний – жартылай өткізгіш. Оның металдан айырмашылығы – температура көбейген сайын электрөткізгіштігі арта түседі. Жартылай
- 17. “A substance, such as germanium or silicon, that has an electrical conductivity that increases with temperature
- 18. Metals tend to be good conductors of electricity because they usually have "free electrons" that can
- 19. Doping silicon You can change the behavior of silicon and turn it into a conductor by
- 20. N-type semi-conductors These are doped phosphorus or arsenic, these are added to the silicon in small
- 21. Кремнийдің бүгінгі өмірде алатын орны. Кристалл кремнийдің балқу температурасы – 17550С, суығанда шыны тәрізді массаға айналады.
- 22. «Бос электрондар» ұғымы Кристалдық тор түзілгенде (егер ол кристалдық тордың құрамында зарядталған бөлшектер болса) оның құрамындағы
- 24. Скачать презентацию















 ВОДОРОД
ВОДОРОД Магматические породы и постмагматические процессы
Магматические породы и постмагматические процессы Количественное определение лекарственных веществ
Количественное определение лекарственных веществ Чистые вещества и смеси
Чистые вещества и смеси Вуглеводні. Лекція 11
Вуглеводні. Лекція 11 Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины
Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины Фенол и его свойства
Фенол и его свойства Химические свойства воды
Химические свойства воды Углеводы Cn(H2O)m
Углеводы Cn(H2O)m Атом - сложная частица
Атом - сложная частица Хлороводород. Соляная кислота
Хлороводород. Соляная кислота Зависимость биохимических изменений в мясе от условий хранения
Зависимость биохимических изменений в мясе от условий хранения Основные понятия и законы химии
Основные понятия и законы химии Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Электролиз
Электролиз Водородная связь
Водородная связь Фторопласт-4 (тефлон, політетрафлуоретен)
Фторопласт-4 (тефлон, політетрафлуоретен) Застосування неметалів
Застосування неметалів Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Углерод. Общая характеристика элементов подгруппы углерода
Углерод. Общая характеристика элементов подгруппы углерода Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс
Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс Контроль качества неорганических лекарственных средств элементов VII группы периодической системы Д. И. Менделеева
Контроль качества неорганических лекарственных средств элементов VII группы периодической системы Д. И. Менделеева Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019
Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019 Сероводород
Сероводород Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс Поширення та колообіг оксигену в природі
Поширення та колообіг оксигену в природі Спирты. Состав, строение спиртов
Спирты. Состав, строение спиртов Введение в геохимию
Введение в геохимию