Молекула фенола состоит из двух радикалов – фенила и гидроксила. Фенилрадикал
(группа атомов С6Н5-) в отличие от радикалов предельных углеводородов обладает свойством несколько оттягивать к себе электроны атома кислорода гидроксильной группы, то есть неподелённые электронные пары атома кислорода гидроксильной группы частично вовлекаются в сферу π-электронов бензольного кольца, в результате чего электронная плотность у атома кислорода уменьшается. Это вызывает дополнительное смещение электронной плотности связи О-Н от водорода к кислороду, и связь между ними ослабевает. Водород становится подвижным и реакционноспособным. То есть атом водорода гидроксильной группы приобретает более выраженные, чем у спиртов, кислотные свойства.
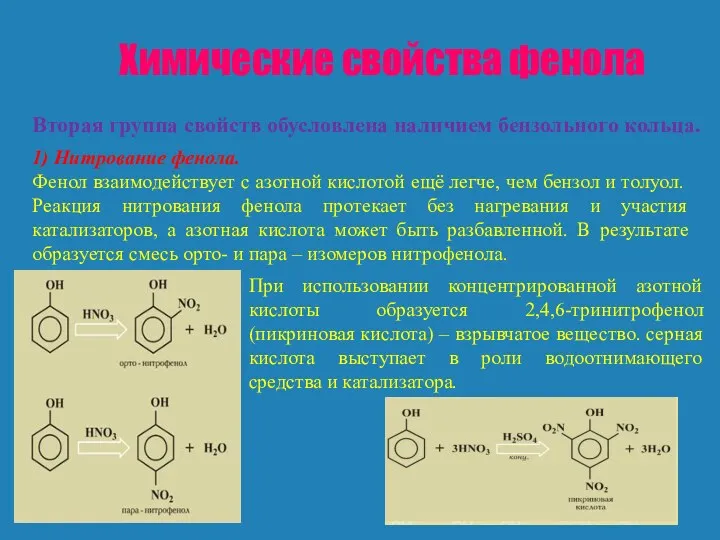
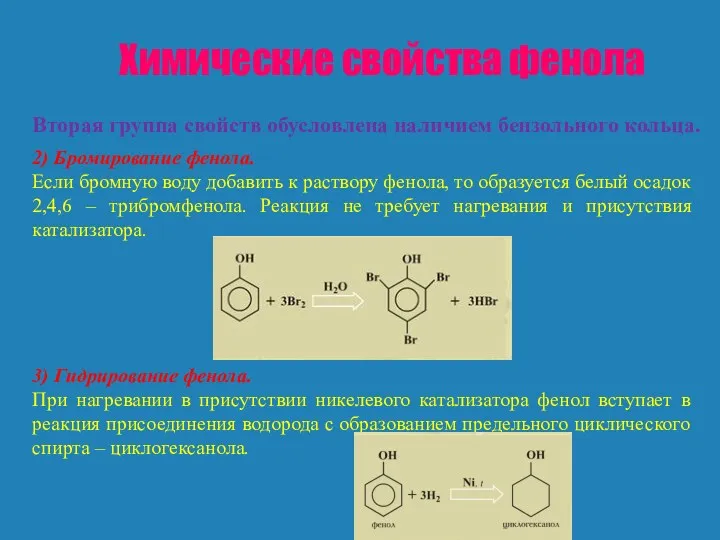
Но не только бензольное ядро влияет на гидроксильную группу. Гидроксильная группа влияет на бензольное ядро и определяет свойства, отличающие фенол от бензола. Бензол не реагирует с бромной водой, фенол же легко вступает в реакцию с бромной водой. Гидроксильная группа направляет заместители (атомы брома) в положения 2, 4, 6.
Строение фенола
Взаимное влияние в молекуле фенола



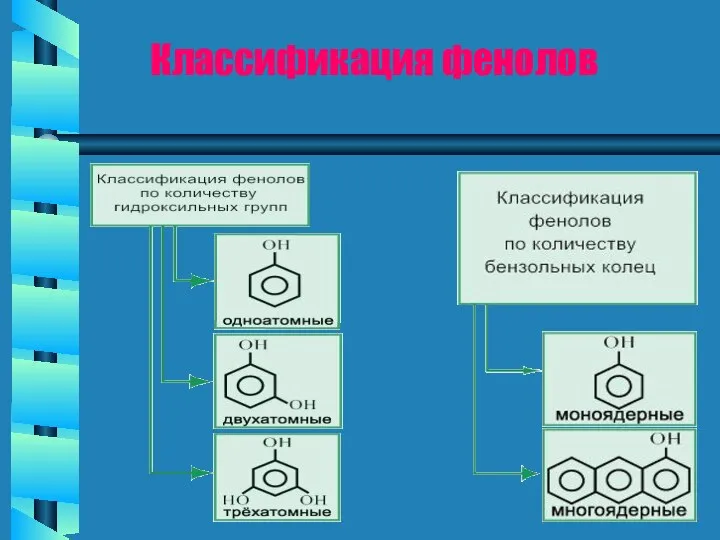
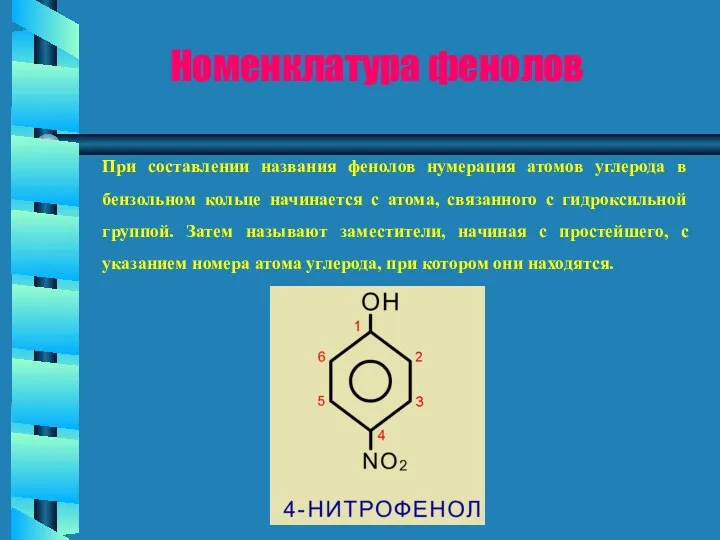
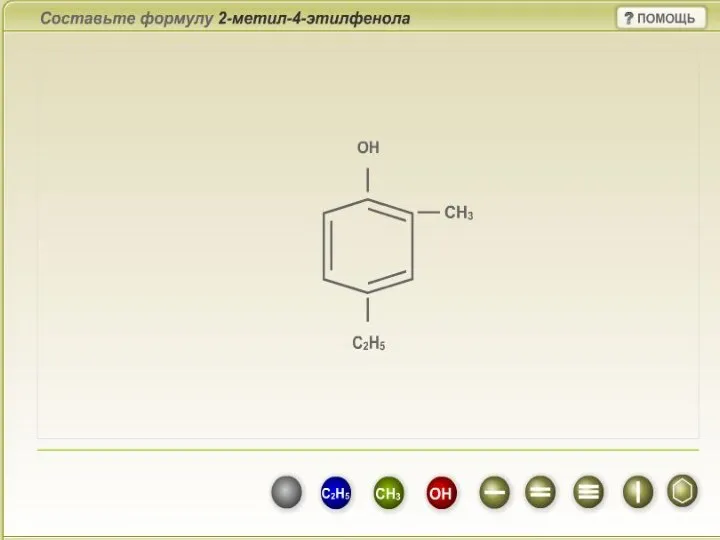







 Строение и химические свойства кислот
Строение и химические свойства кислот Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Химия в пище. Пищевые добавки
Химия в пище. Пищевые добавки 1.1 Взрывчатые вещества и пороха
1.1 Взрывчатые вещества и пороха Проект: жило-было мыло
Проект: жило-было мыло Пластмассы
Пластмассы Гетерогенное ионное равновесие. Реакции обмена
Гетерогенное ионное равновесие. Реакции обмена Alcohols. Learning Objectives
Alcohols. Learning Objectives Тепловой эффект химической реакции. Топливо. Водород. 8 класс
Тепловой эффект химической реакции. Топливо. Водород. 8 класс Азот, строение, свойства. Круговорот Азота в природе
Азот, строение, свойства. Круговорот Азота в природе Спирты
Спирты Электролиз Урок для 11 класса
Электролиз Урок для 11 класса 20230816_himiya_spirty
20230816_himiya_spirty Электронные конфигурации атомов
Электронные конфигурации атомов Электролитическая диссоциация. Степень и константа диссоциации
Электролитическая диссоциация. Степень и константа диссоциации Химия нефти и газа
Химия нефти и газа Общая характеристика неметаллов
Общая характеристика неметаллов Гетероциклічні ароматичні сполуки
Гетероциклічні ароматичні сполуки Introduction to effective permeability and relative permeability
Introduction to effective permeability and relative permeability Добування кисню
Добування кисню Внеклассное мероприятие по химии. 9 класс
Внеклассное мероприятие по химии. 9 класс Проблемный химический эксперимент как составная часть проблемного обучения химии
Проблемный химический эксперимент как составная часть проблемного обучения химии Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Особенности дисперсных систем
Особенности дисперсных систем Происхождение, состав и свойства минералов
Происхождение, состав и свойства минералов Кислород, азот, водород и инертные газы. Раздел 3
Кислород, азот, водород и инертные газы. Раздел 3 Номенклатура органических соединений
Номенклатура органических соединений Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД)