Содержание
- 2. Тема: Электролитическая диссоциация. Степень и константа диссоциации.
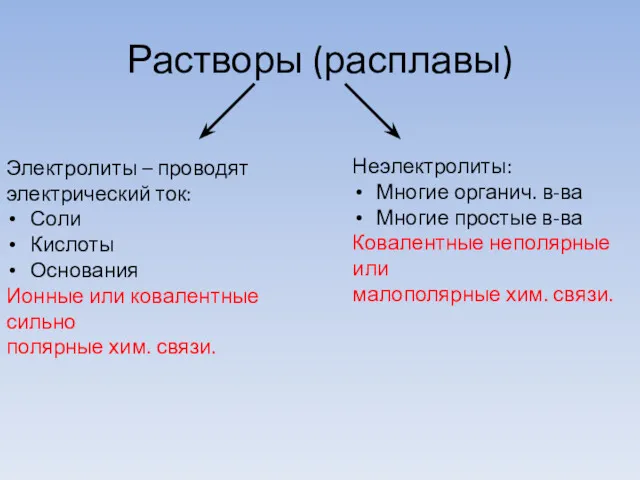
- 3. Растворы (расплавы) Электролиты – проводят электрический ток: Соли Кислоты Основания Ионные или ковалентные сильно полярные хим.
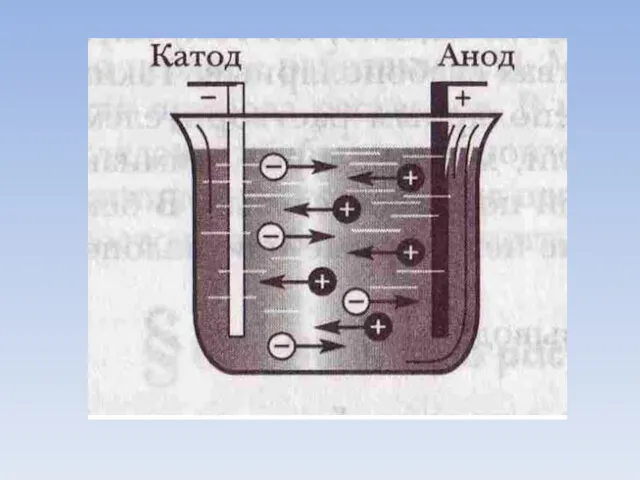
- 4. 2) В растворе или расплаве электролитов оны движутся хаотически. При пропускании через раствор или расплав электрического
- 5. Теория электролитической диссоциации Аррениуса (1887г.) Молекулы электролитов при растворении или расплавлении распадаются на ионы Ионы –
- 7. 3) Диссоциация процесс обратимый.
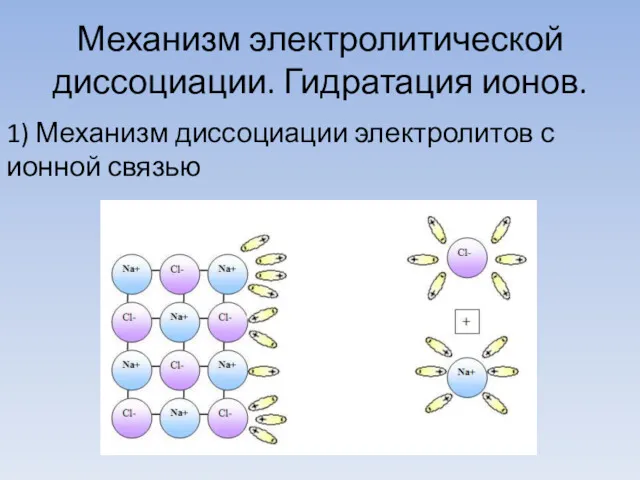
- 8. Механизм электролитической диссоциации. Гидратация ионов. 1) Механизм диссоциации электролитов с ионной связью
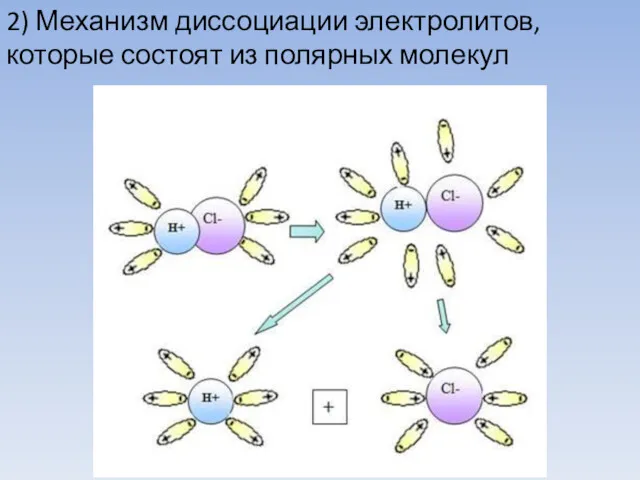
- 9. 2) Механизм диссоциации электролитов, которые состоят из полярных молекул
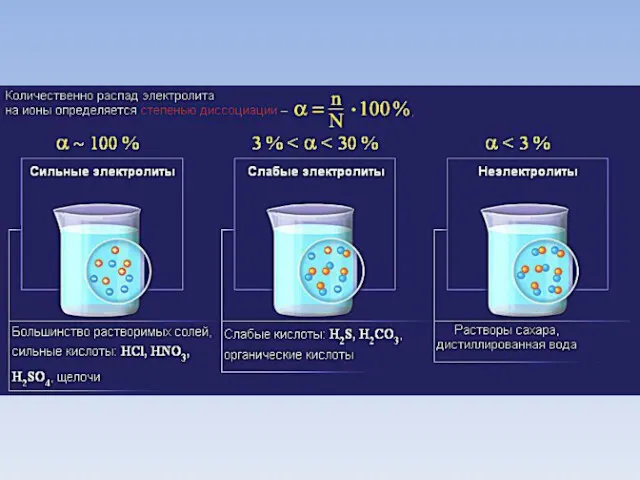
- 10. Степень диссоциации Степень диссоциации зависит: 1)Природы растворяемого вещества 2) Концентрации раствора 3) Температуры
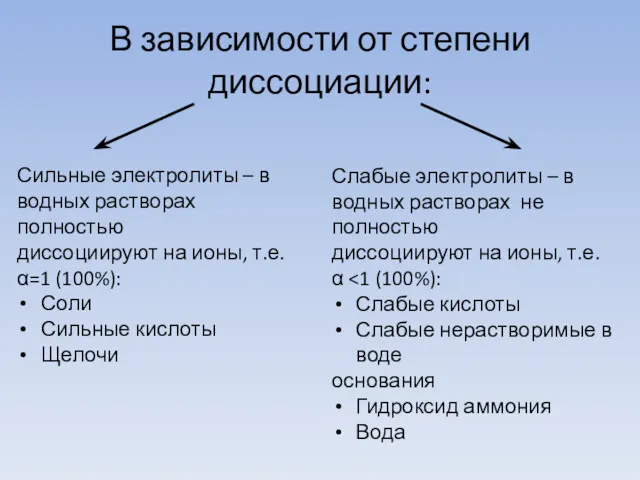
- 11. В зависимости от степени диссоциации: Сильные электролиты – в водных растворах полностью диссоциируют на ионы, т.е.
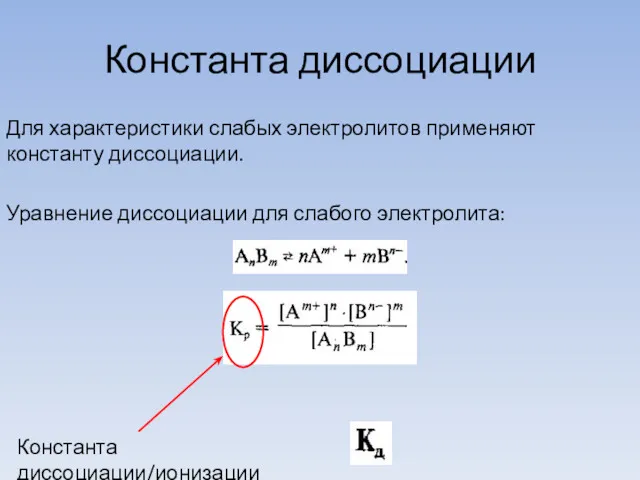
- 13. Константа диссоциации Для характеристики слабых электролитов применяют константу диссоциации. Уравнение диссоциации для слабого электролита: Константа диссоциации/ионизации
- 14. характеризует способность электролита диссоциировать на ионы. Чем больше , тем легче электролит распадается на ионы, тем
- 15. Диссоциация солей, оснований, амфотерных гидроксидов и солей в водных растворах Сильные кислоты Слабые многоосновные кислоты диссоциируют
- 17. Сильные однокислотные Сильные двухкислотные Слабые многокислотные основания диссоциируют ступенчато
- 21. Скачать презентацию











 Electrochemistry
Electrochemistry Алюминий и его свойства
Алюминий и его свойства Комплексиметрическое титрование
Комплексиметрическое титрование Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5
Дослідження окисно-відновних властивостей речовин. Лабораторна робота № 5 Типы химических реакций
Типы химических реакций Алюминий. Химические свойства
Алюминий. Химические свойства Важнейшие нефтепродукты. Области их применения
Важнейшие нефтепродукты. Области их применения Особенности органических веществ. Классификация органических соединений. 9 класс
Особенности органических веществ. Классификация органических соединений. 9 класс Оксиды, их классификация и свойства
Оксиды, их классификация и свойства Гидролиз неорганических веществ - солей. (11 класс)
Гидролиз неорганических веществ - солей. (11 класс) Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций
Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций Плавление и кристаллизация
Плавление и кристаллизация Металдар
Металдар Электоролиз заңы
Электоролиз заңы Химические свойства и получение алканов
Химические свойства и получение алканов Предмет и содержание фармацевтической и косметологической химии
Предмет и содержание фармацевтической и косметологической химии Газовая хроматография
Газовая хроматография Электроотрицательность. Ковалентная полярная связь. (Тема 12)
Электроотрицательность. Ковалентная полярная связь. (Тема 12) Тема 9 - Азотсодержащие и гетероциклические органические соединения
Тема 9 - Азотсодержащие и гетероциклические органические соединения Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Классификация органических соединений. Теория химического строения вещества. 10 класс
Классификация органических соединений. Теория химического строения вещества. 10 класс Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Введение в органическую химию
Введение в органическую химию Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Водород. Химические свойства
Водород. Химические свойства 20231012_metally.fizicheskie_svoystva
20231012_metally.fizicheskie_svoystva