Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций презентация
Содержание
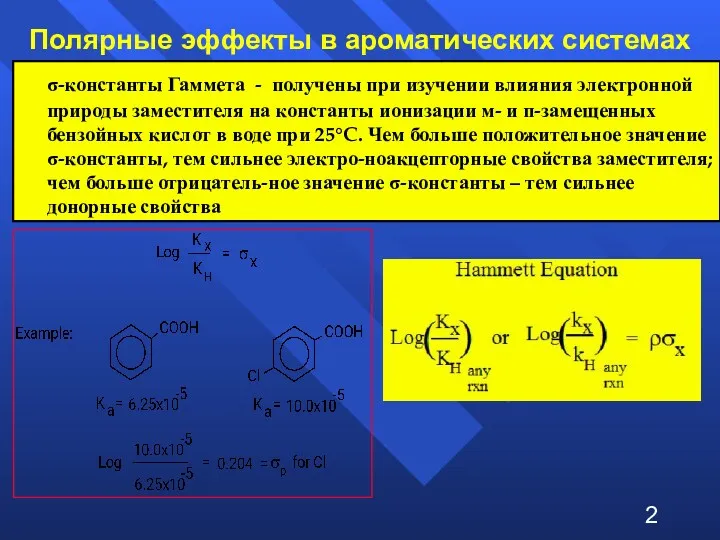
- 2. Полярные эффекты в ароматических системах σ-константы Гаммета - получены при изучении влияния электронной природы заместителя на
- 3. Смысл параметров σ и ρ σ — параметр заместителя (константа) σ > 0 – акцептор (увеличивает
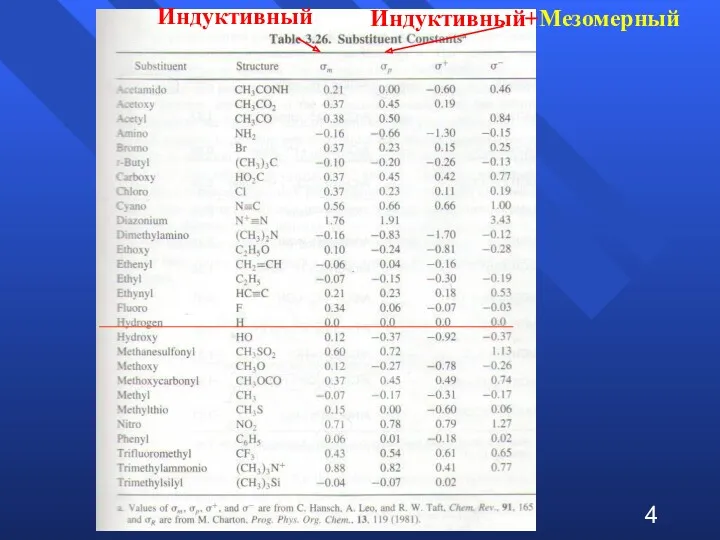
- 4. Индуктивный Индуктивный+Мезомерный 4
- 5. 5
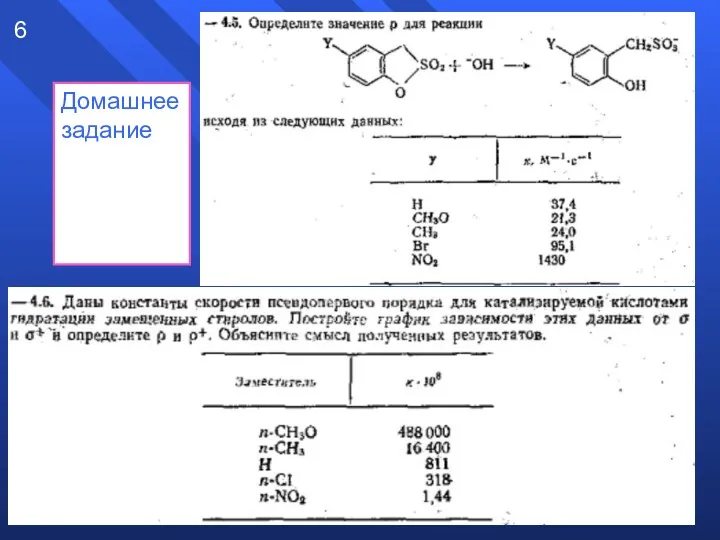
- 6. Домашнее задание 6
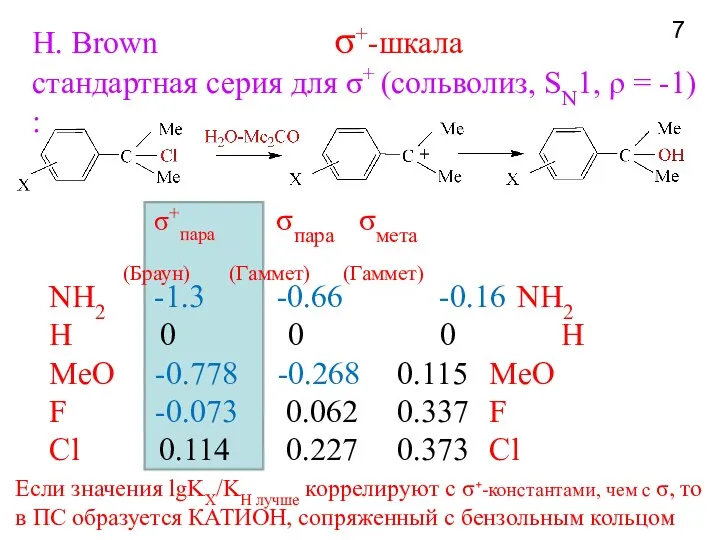
- 7. σ+пара σпара σмета (Браун) (Гаммет) (Гаммет) NH2 -1.3 -0.66 -0.16 NH2 H 0 0 0 H
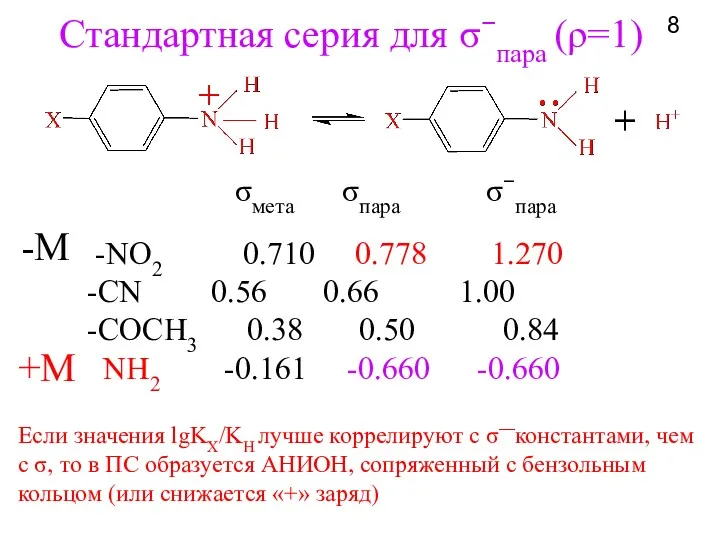
- 8. Стандартная серия для σ−пара (ρ=1) -NO2 0.710 0.778 1.270 -СN 0.56 0.66 1.00 -COCH3 0.38 0.50
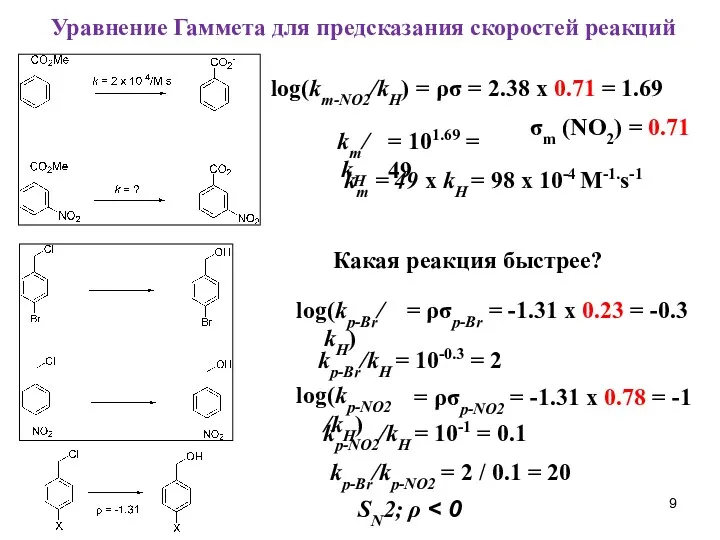
- 9. Уравнение Гаммета для предсказания скоростей реакций log(km-NO2/kH) = ρσ = 2.38 x 0.71 = 1.69 σm
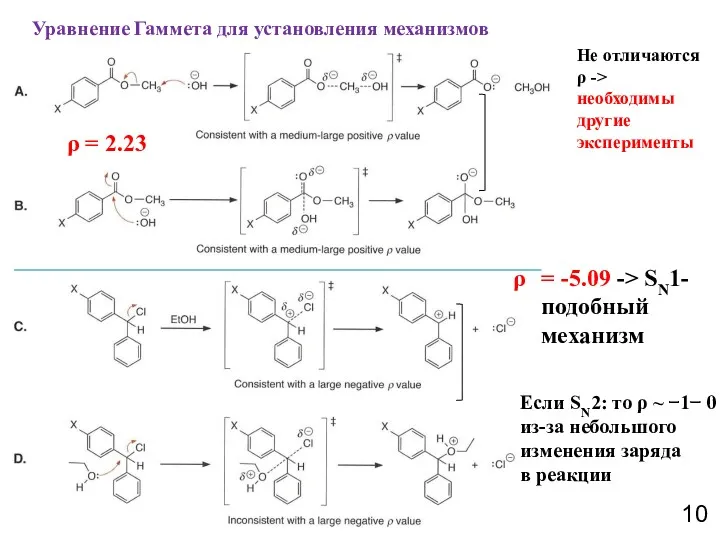
- 10. Уравнение Гаммета для установления механизмов Не отличаются ρ -> необходимы другие эксперименты ρ = 2.23 =
- 11. Изгибы в корреляции Гаммета могут свидетельствовать об изменении лимитирующей стадии процесса
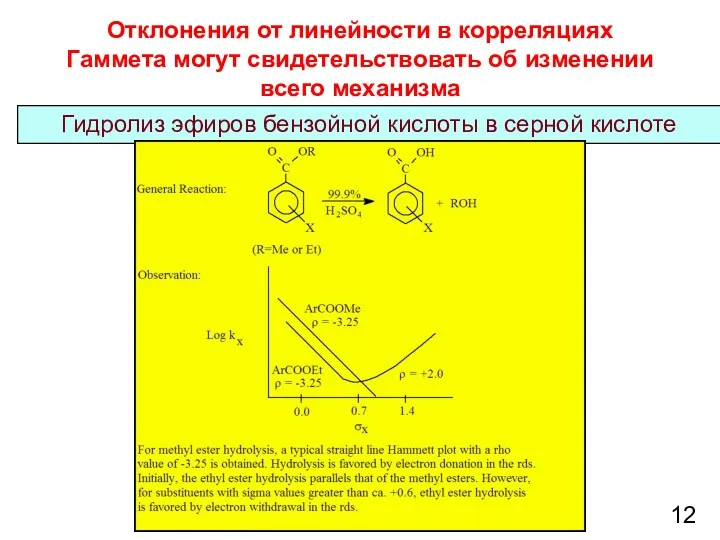
- 12. Отклонения от линейности в корреляциях Гаммета могут свидетельствовать об изменении всего механизма Гидролиз эфиров бензойной кислоты
- 13. Гидролиз эфиров бензойной кислоты в H2SO4 13
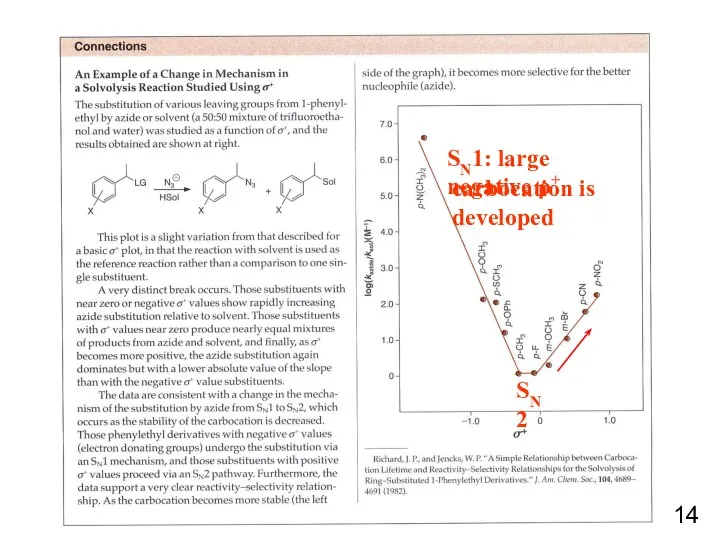
- 14. SN1: large negative ρ+ SN2 carbocation is developed 14
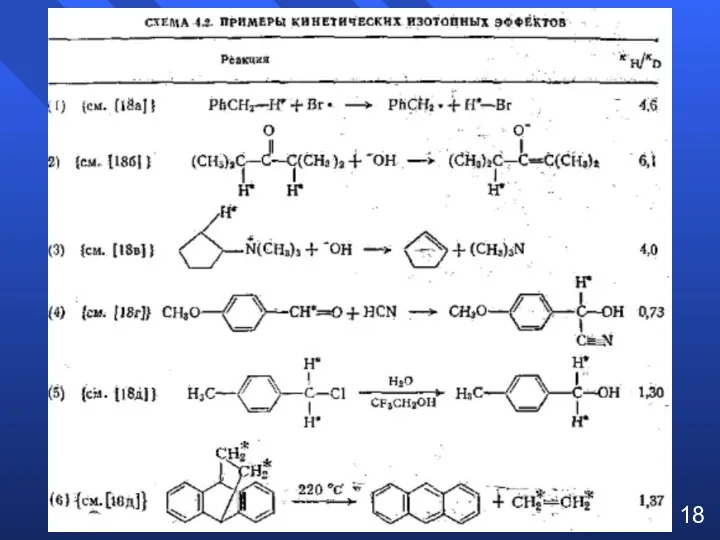
- 15. Кинетические изотопные эффекты (КИП) Хим. природа 12С и 13С (1Н и 2Н) не отличается, но изменяется
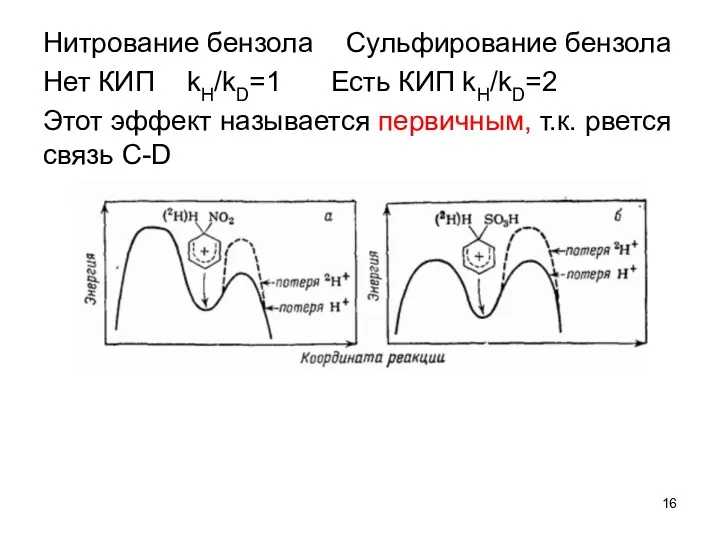
- 16. Нитрование бензола Сульфирование бензола Нет КИП kH/kD=1 Есть КИП kH/kD=2 Этот эффект называется первичным, т.к. рвется
- 17. 17
- 18. 18
- 19. Эффект растворителя 1. Общий 19
- 20. 20
- 21. Количественный учет влияния растворителя: использование различного рода констант растворителей и корреляционных уравнений 21
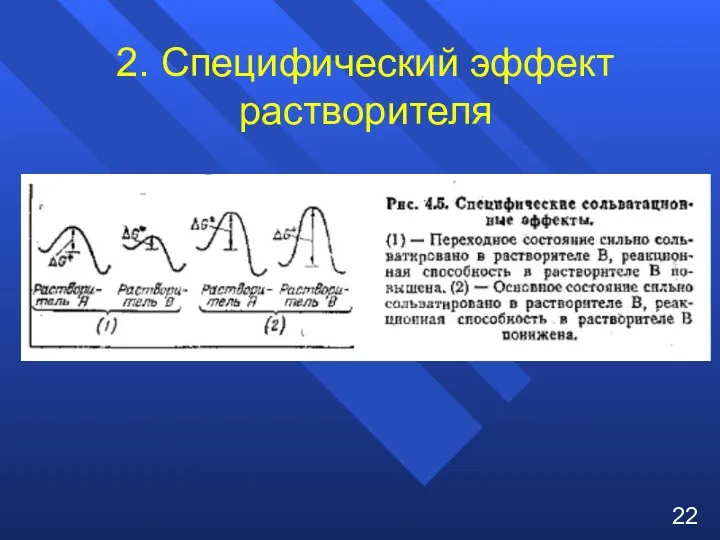
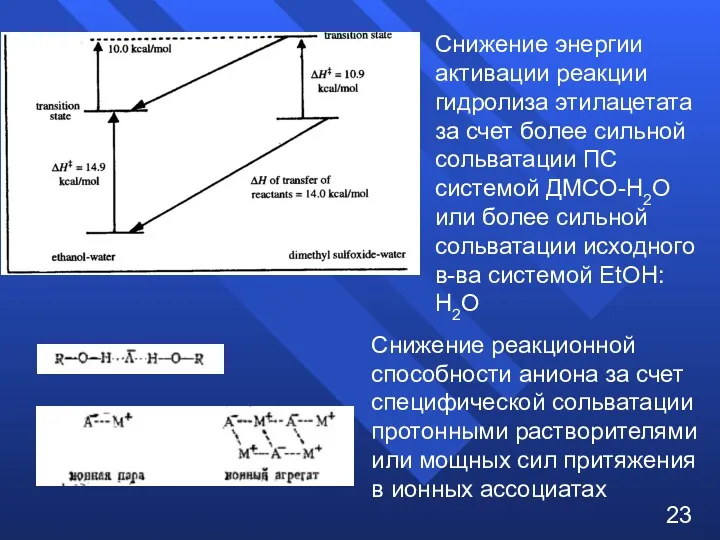
- 22. 2. Специфический эффект растворителя 22
- 23. Снижение реакционной способности аниона за счет специфической сольватации протонными растворителями или мощных сил притяжения в ионных
- 25. Скачать презентацию









 Топливо и топливосжигающие устройства
Топливо и топливосжигающие устройства большая стирка
большая стирка Бытовая химия. Правила безопасного обращения со средствами бытовой химии
Бытовая химия. Правила безопасного обращения со средствами бытовой химии Redox reactions
Redox reactions Железо. Fe (лат. Феррум)
Железо. Fe (лат. Феррум) Фармацевтическая химия натрия гидрокарбоната
Фармацевтическая химия натрия гидрокарбоната Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Диссоциация воды. Водородный и гидроксильный показатели (рН и рОН)
Диссоциация воды. Водородный и гидроксильный показатели (рН и рОН) Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Занимательные опыты
Занимательные опыты Валентність. Хімія. 7 клас
Валентність. Хімія. 7 клас Химические уравнения. Типы химических реакций. А что такое химическая реакция?
Химические уравнения. Типы химических реакций. А что такое химическая реакция? Электронные конфигурации атомов
Электронные конфигурации атомов Общая характеристика неметаллов
Общая характеристика неметаллов Кремний и его соединения
Кремний и его соединения Химия нефти и газа
Химия нефти и газа яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Metal–metal multiple bonded intermediates in catalysis
Metal–metal multiple bonded intermediates in catalysis Закон сохранения массы веществ
Закон сохранения массы веществ Методические проблемы преподавания органической химии и ее основные теоретические понятия
Методические проблемы преподавания органической химии и ее основные теоретические понятия Щелочноземельные металлы
Щелочноземельные металлы Значення хімії у повсякденному житті
Значення хімії у повсякденному житті Неорганические строительные материалы. Стекло
Неорганические строительные материалы. Стекло Теория растворов электролитов и неэлектролитов
Теория растворов электролитов и неэлектролитов Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Кремний и его соединения
Кремний и его соединения Химическая связь и ее типы
Химическая связь и ее типы Превращение веществ
Превращение веществ