Слайд 2

Растворы – гомогенные системы переменного состава, образованные по крайней мере двумя
компонентами, один из которых обычно принимают за растворитель.
Раствор – однофазная система переменного состава, состоящая из двух или более компонентов.
Растворитель – компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает.
В растворе устанавливается равновесие между
всеми формами существования вещества.
Н2С2О4 ⇄ Н+ + НС2О4‾
НС2О4‾ ⇄ Н+ + С2О42-
Уравнение материального баланса имеет вид:
с°(Н2С2О4) = [Н2С2О4] + [НС2О4‾] + [С2О42-].
Слайд 3
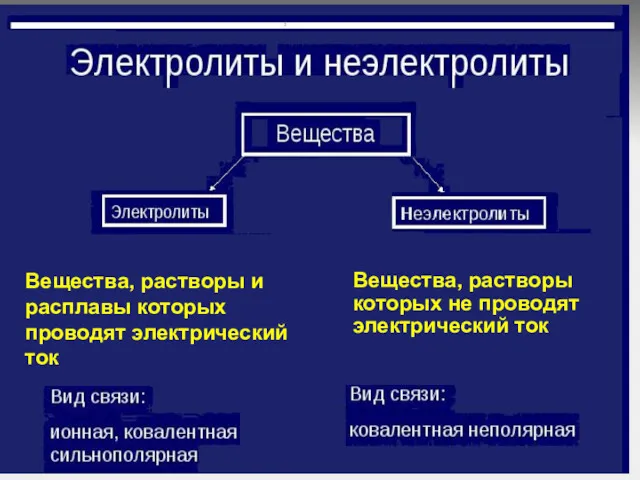
Вещества, растворы и расплавы которых проводят электрический
ток
Вещества, растворы которых не
проводят электрический ток
Слайд 4
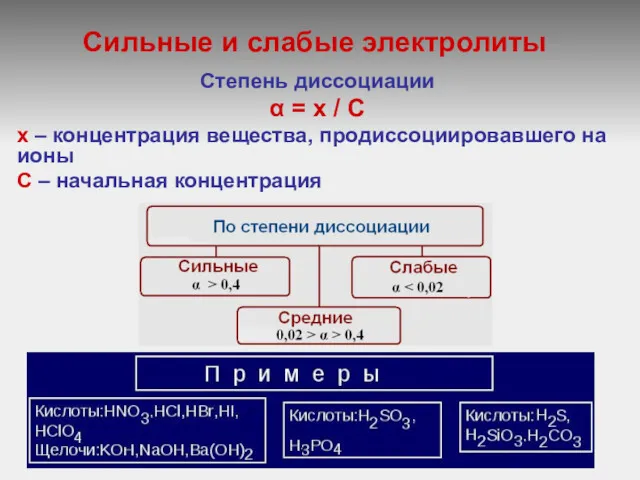
Сильные и слабые электролиты
Степень диссоциации
α = х / С
х – концентрация вещества, продиссоциировавшего на ионы
C – начальная концентрация
Слайд 5
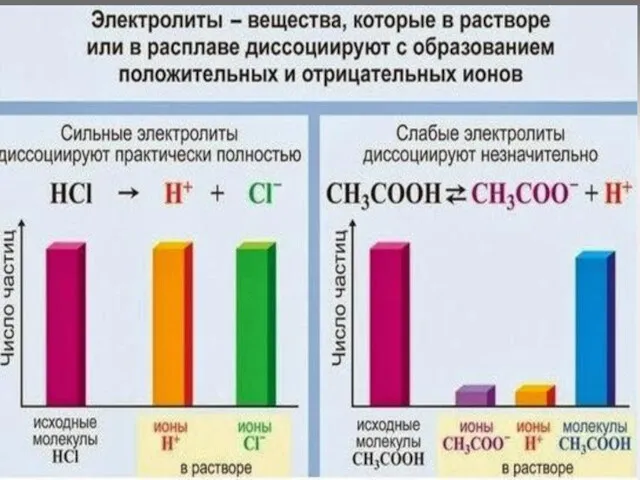
Слайд 6

Слайд 7
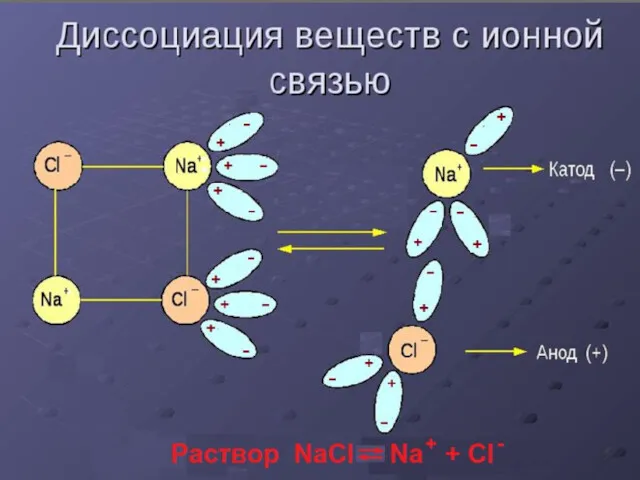
Слайд 8
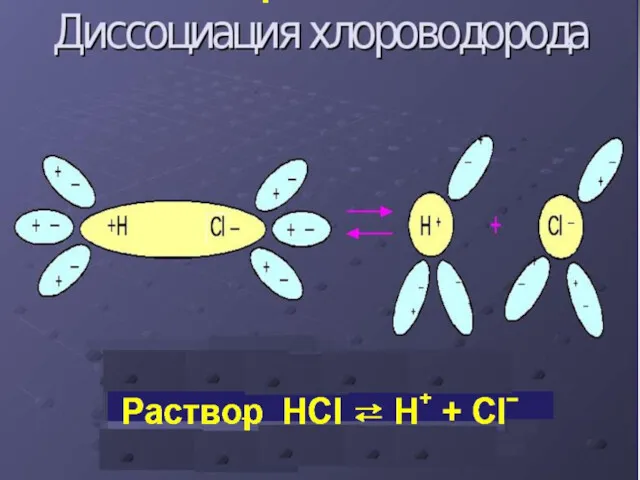
Слайд 9
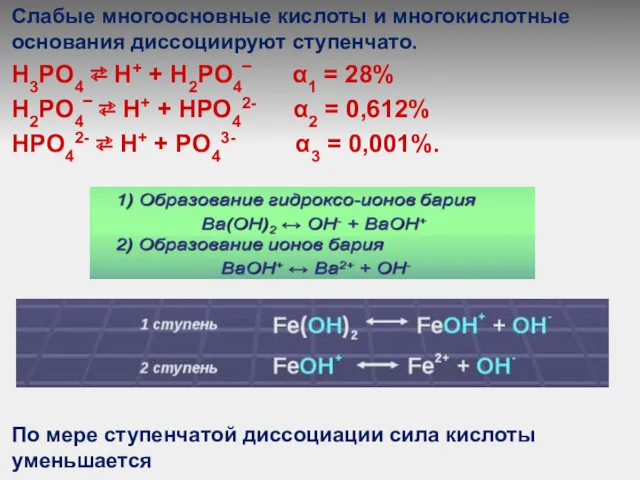
Слабые многоосновные кислоты и многокислотные основания диссоциируют ступенчато.
Н3РO4 ⇄ Н+
+ Н2РO4‾ α1 = 28%
Н2РO4‾ ⇄ Н+ + НРO42- α2 = 0,612%
НРO42- ⇄ Н+ + РO43- α3 = 0,001%.
По мере ступенчатой диссоциации сила кислоты уменьшается
Слайд 10

Слайд 11

Закон действующих масс
применительно к электролитам
aА + bВ ⇄ cС + dD
Для
водных растворов слабых кислот и оснований
НА ⇄ Н+ + А‾
ВОН ⇄ В+ + ОН‾
Равновесные состояния в растворах слабых кислот и оснований характеризуются соответствующими константами равновесия, которые называются константами ионизации (диссоциации).
Слайд 12

Закон разбавления Оствальда
Закон разбавления Оствальда выведен В.Оствальдом в 1888 году
и им же подтвержден опытным
путём. Устанавливает зависимость между степенью диссоциации и константой диссоциации.
НА ⇄ Н+ + А‾
См – концентрация слабой кислоты(моль/дм3);
Α – степень диссоциации;
Смα – число ионизируемых молекул НА Вильгельм Фридрих Оствальд
См(1 – α) – концентрация неионизированных (1853 – 1935)
молекул НА Лауреат Нобелевской премии, 1909
Подставляя полученные значения в уравнение
константы ионизации, получим:
Математическое выражение закона разбавления Оствальда
Слайд 13

Сильные электролиты
Ионная атмосфера – каждый ион окружается
противоположными ионами, что приводит
к
замедлению движения заряженной частицы.
(теория Дебая-Гюккеля)
Активностью иона называется эффективная,
кажущаяся концентрация, согласно которой он участвует в химических реакциях.
а = С·f
F – коэффициент активности
Понятие f введено датским ученым Бьеррумом в 1918 г.
Слайд 14

Ионная сила раствора
Силы межионного взаимодействия зависят от концентрации не только данного
электролита, но и концентрации всех других электролитов, присутствующих в растворе.
Ионная сила раствора - мера интенсивности
электрического поля, создаваемого ионами в
растворе.
Поэтому величина f зависит от ионной силы раствора, обозначаемой I, которая учитывает влияние всех присутствующих в растворе электролитов.
Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом.
I = ½(с1z12 + с2z22 +......сnzn2)
с – концентрация данного иона; z – заряд иона.
Слайд 15

Ионное произведение воды
Вода – слабый электролит
Н2O ⇄ Н+ + OН‾
Константа ионизации
(диссоциации)
После преобразования
К∙[Н2O] = [Н+]·[OН‾] = Kв = 1,0·10-14
Произведение концентраций ионов водорода и ионов гидроксида называется ионным произведением воды.
В воде и водных растворах произведение ионов водорода и гидроксид-ионов есть величина постоянная.
Слайд 16

Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов Н+, если
известна концентрация ионов ОНˉ и наоборот.
Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл.
Нейтральная среда
[Н+] = [ОН‾] = 10-7 моль/дм3
Кислая среда
[Н+] > [ОН‾] [Н+] > 10-7 моль/дм3
Щелочная среда
[Н+] < [ОН‾] [Н+] < 10-7 моль/дм3















 Sulfur and its compounds. Contact method for producing sulfuric acid
Sulfur and its compounds. Contact method for producing sulfuric acid Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Спирты. Многоатомные спирты
Спирты. Многоатомные спирты Соли. Определение солей
Соли. Определение солей The role of chemistry in the solution of the food problem
The role of chemistry in the solution of the food problem Адсорбция. Физическая и химическая адсорбция
Адсорбция. Физическая и химическая адсорбция Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Стекловолокно. Что такое стекловолокно?
Стекловолокно. Что такое стекловолокно? Три правила взаимодействия элементов симметрии
Три правила взаимодействия элементов симметрии Простые и сложные полиэфиры. Пентапласт
Простые и сложные полиэфиры. Пентапласт Вольфрам — химический элемент
Вольфрам — химический элемент Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Совйства спиртов. 10 класс
Совйства спиртов. 10 класс Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Растворы. Процесс растворения
Растворы. Процесс растворения Сульфиды. Лекция 6
Сульфиды. Лекция 6 Термопластичные полимеры
Термопластичные полимеры Состав, свойства и роль молока в жизни человека
Состав, свойства и роль молока в жизни человека Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Биологически важные окислительно-восстановительные реакции органических соединений
Биологически важные окислительно-восстановительные реакции органических соединений Непредельные углеводороды. Алкены. Номенклатура алкенов
Непредельные углеводороды. Алкены. Номенклатура алкенов Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Явища природи. Фізичні явища, їх різноманітність. Хімічні явища, їх ознаки. Горіння. Гниття
Явища природи. Фізичні явища, їх різноманітність. Хімічні явища, їх ознаки. Горіння. Гниття Азотные удобрения
Азотные удобрения Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю
Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю Количество вещества. Единица измерения вещества моль
Количество вещества. Единица измерения вещества моль