Содержание
- 2. План: Основные положения теории электролитической диссоциации Механизм электролитической диссоциации (самостоятельно) Степень и константа электролитической диссоциации. Диссоциация
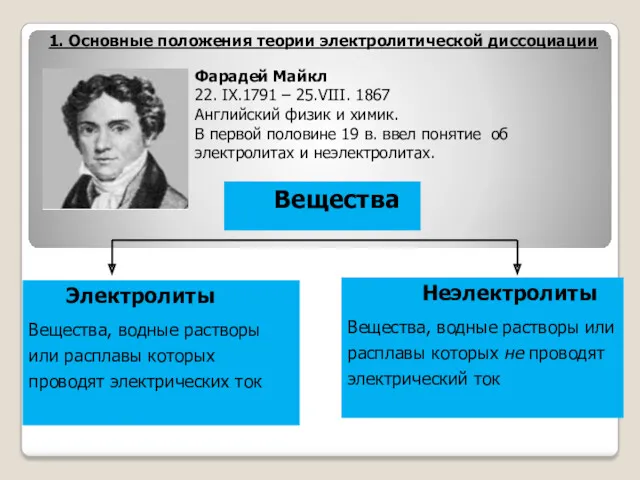
- 3. 1. Основные положения теории электролитической диссоциации Фарадей Майкл 22. IX.1791 – 25.VIII. 1867 Английский физик и
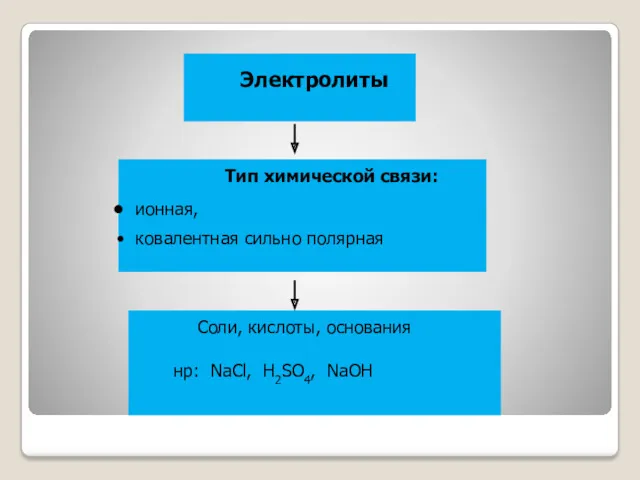
- 4. Тип химической связи: ионная, ковалентная сильно полярная Электролиты Соли, кислоты, основания нр: NaCl, H2SO4, NaOH
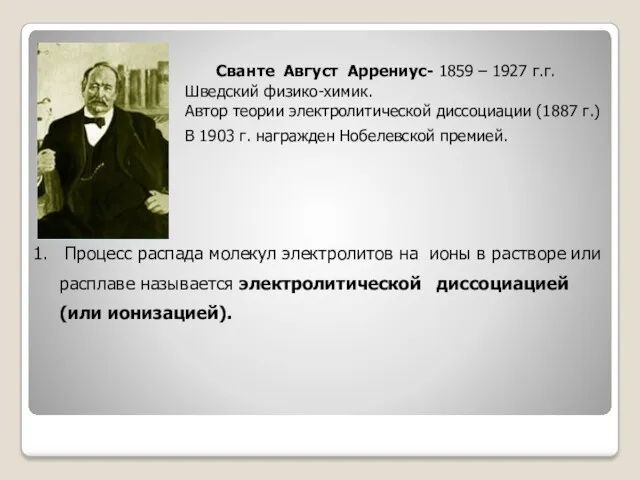
- 6. Сванте Август Аррениус- 1859 – 1927 г.г. Шведский физико-химик. Автор теории электролитической диссоциации (1887 г.) В
- 7. Ионы - это атомы или группы атомов, имеющие заряд Катионы - положительно заряженные ионы Нр: Н+,
- 8. 2. Диссоциация – процесс обратимый. Процесс соединения ионов в молекулы называется ассоциацией (или моляризацией). Диссоциацию молекул
- 9. 3. Ионы и атомы одних и тех же элементов отличаются друг от друга по строению и
- 10. Степень диссоциации (α) зависит от природы растворяемого вещества и растворителя. концентрации раствора. При разбавлении раствора, α
- 11. Сильные электролиты (α → 1 или 100%) 1) соли 2) сильные кислоты (H2SO4, HCl, HNO3, HClO4,
- 12. Кд (NH4OH) = 1,8 · 10-5 Кд (H2O) = 1,8 · 10-16 Константа диссоциации (Кд )
- 13. 4. Диссоциация кислот, оснований, амфотерных гидроксидов и солей в воде Уравнение электролитической диссоциации сильных кислот: HCl
- 14. Уравнение диссоциации сильных оснований (щелочей) NaOH ↔ Na+ + OH- Ba(OH)2 ↔ Ba2+ + 2OH- Слабые
- 15. Уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 (без учета её ступенчатого характера) 2H+ + ZnO22- ↔ H2ZnO2
- 16. K2CO3 ↔ 2K+ + CO32- Al2(SO4)3 ↔ 2Al3+ + 3SO42- Средние (нормальные) соли – сильные электролиты,
- 17. Основные соли – электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из
- 18. 5. Реакции обмена в водных растворах электролитов Реакции, протекающие между ионами, называются ионными реакциями. Условия течения
- 19. 1. Реакции с образованием малорастворимых веществ, выпадающих в осадок AgNO3 + HCl → AgCl↓ + HNO3
- 20. 3. Реакции, идущие с образованием малодиссоциирующих веществ – слабых электролитов NaOH + HCl → NaCl +
- 21. Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих
- 22. Если [Н+] = 10-7 моль/л , то рН = - lg 10-7 = 7 среда раствора
- 23. 6. Диссоциация воды. Водородный показатель H2O ↔ H+ + OH- При 250С [Н+] = [ОН-] =
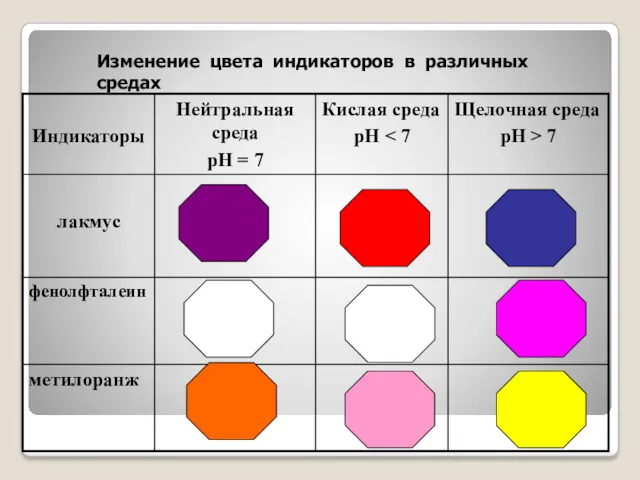
- 24. Изменение цвета индикаторов в различных средах
- 25. 7. Буферные растворы и их состав Буферные растворы (синоним: буферные смеси, буферные системы, буферы) — растворы,
- 26. Типы буферных растворов по составу Буфер кислых солей разной основности, например, фосфатный буфер Na2HPO4 + NaH2PO4
- 27. За единицу буферной емкости условно принимают емкость такого буферного раствора, для изменения рН которого на единицу
- 28. Буфер крови = угольная кислота Н2СО3 + гидрокарбонат натрия NaHCO3. Добавление кислоты: Н+ (водн.) + НСО3-
- 29. 8. Протолитическая (протонная) теория кислот и оснований. Согласно протонной теории кислот и оснований, выдвинутой Й.Н.Бренстедом и
- 30. На самом деле свободные протоны не могут существовать в растворе несвязанными и переходят от кислоты к
- 31. Наиболее общей считается теория кислот и оснований Г.Н.Льюиса. Согласно Льюису, кислотой является соединение, принимающее электронную пару,
- 32. Контрольные вопросы для закрепления: 1. При повреждении кожи (ранке) наблюдается свертывание крови – коагуляция золя. В
- 34. Скачать презентацию

















![Если [Н+] = 10-7 моль/л , то рН = -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/125665/slide-21.jpg)









 Поверхностные явления
Поверхностные явления Химическая связь
Химическая связь Летучие яды. Токсичные газы
Летучие яды. Токсичные газы Коррозионная стойкость и повышение долговечности полимерных строительных материалов
Коррозионная стойкость и повышение долговечности полимерных строительных материалов Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Химические соединения в организме человека
Химические соединения в организме человека Создание косметических средств
Создание косметических средств Электронное строение атома. Периодический закон
Электронное строение атома. Периодический закон Изотопная геохимия. U-Pb метод
Изотопная геохимия. U-Pb метод Основные классы органических соединений и их роль в живых организмах
Основные классы органических соединений и их роль в живых организмах Якісні реакції на деякі йони
Якісні реакції на деякі йони Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Фенолдар. Физикалық қасиеттері
Фенолдар. Физикалық қасиеттері Борьба с биологической коррозией
Борьба с биологической коррозией Свойства фосфора
Свойства фосфора Химический элемент: йод
Химический элемент: йод Периодический закон Менделеева
Периодический закон Менделеева Stirring in liquid media
Stirring in liquid media Улыхимикаттармен жұмыс жасау барысындағы қауіпсіздік шаралары
Улыхимикаттармен жұмыс жасау барысындағы қауіпсіздік шаралары Определение содержания общего белка и казеина в молоке формольным методом
Определение содержания общего белка и казеина в молоке формольным методом Алкины. Гомологический ряд, получение, свойства и применение
Алкины. Гомологический ряд, получение, свойства и применение Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Тяжёлая вода
Тяжёлая вода Хімічні властивості кислот
Хімічні властивості кислот Галогены. Строение атома
Галогены. Строение атома Скорость химических реакций
Скорость химических реакций Открытие хлора
Открытие хлора