Содержание
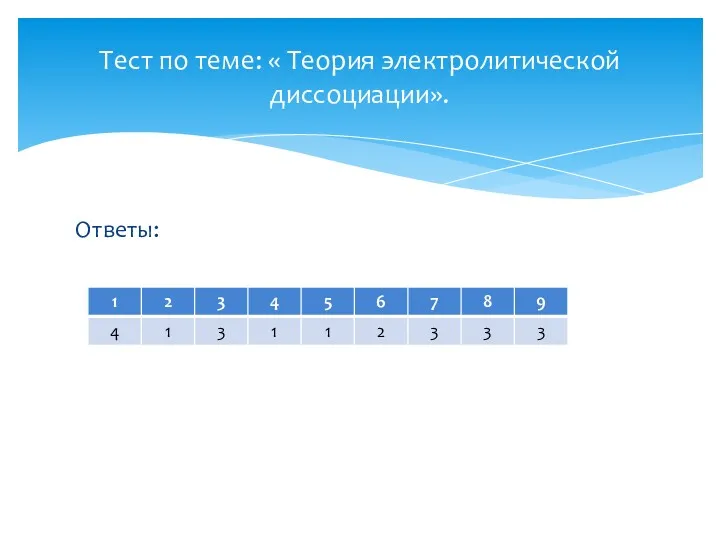
- 2. Ответы: Тест по теме: « Теория электролитической диссоциации».
- 3. Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате
- 4. Гидролизу не подвергается нерастворимые соли и соли, образованные сильным основанием (щёлочи) и сильной кислотой (HCl, HClO4,
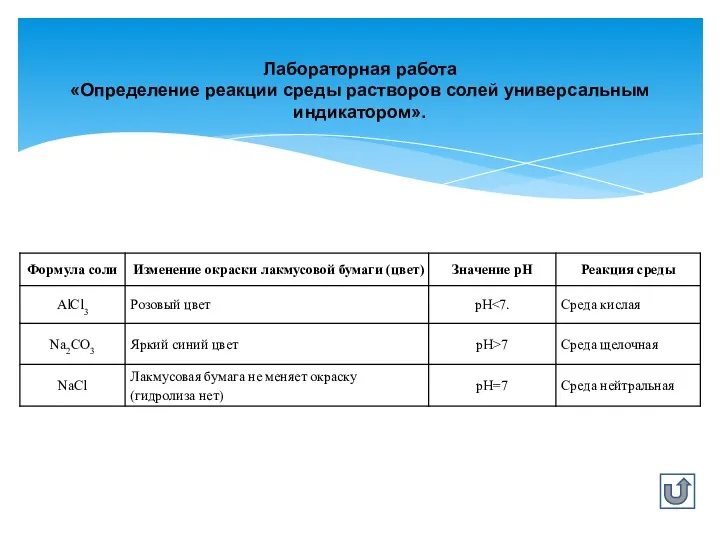
- 5. Лабораторная работа «Определение реакции среды растворов солей универсальным индикатором».
- 6. Алгоритм составления гидролиза солей Дана соль AlCl3 – образована слабым основанием и сильной кислотой.
- 7. Гидролиз соли Na2CO3, образованной сильным основанием и слабой кислотой.
- 8. Гидролиз соли СН3 СООNН4, образованной слабым основанием и слабой кислотой В случае гидролиз соли, образованной слабым
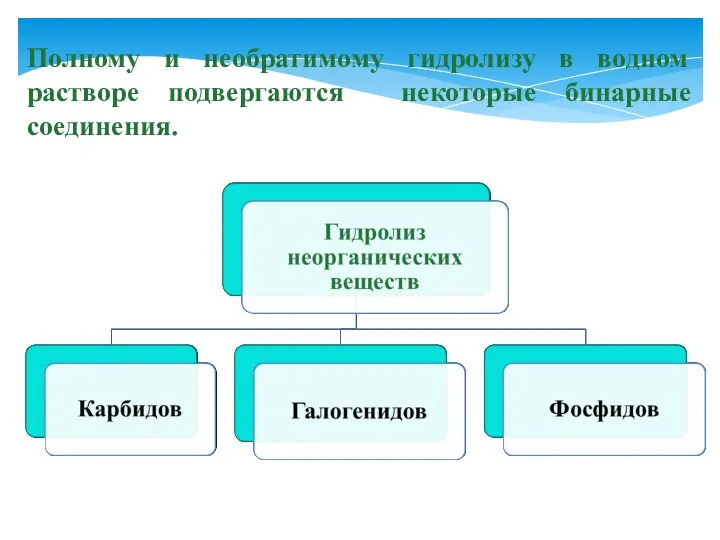
- 9. Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения.
- 10. Гидролиз карбидов: CaC2 + 2H2O = Ca(OH)2 + C2 H2↑ Карбид ацетилен кальция Al4C3 + 12H2O
- 11. Гидролиз галогенидов: SiCl4 + 3H2O = H2SiO4↓ + 4HСl хлорид кремниевая кремния (+4) кислота Гидролиз фосфидов:
- 12. Для обратимого гидролиза условия смещения равновесия определяются принципом Ле Шателье. Условия усиления и ослабления гидролиза:
- 13. Разбор примера ( задание частиВ) Как скажется на состоянии химического равновесия в системе Zn2+ + H2O↔
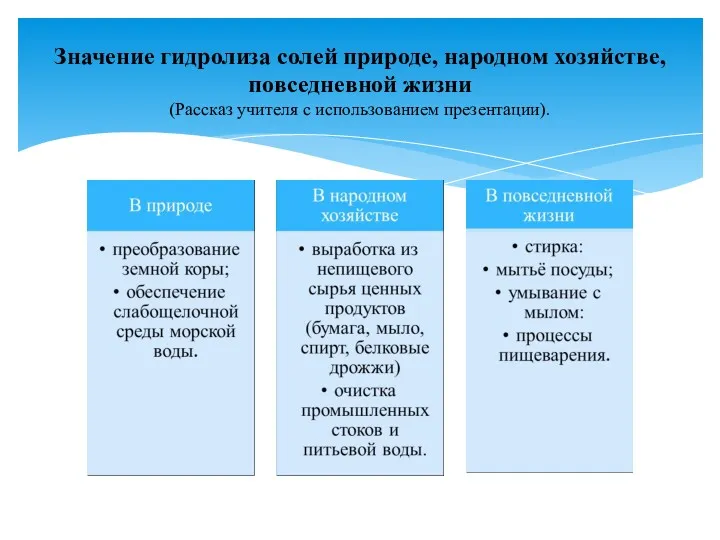
- 14. Значение гидролиза солей природе, народном хозяйстве, повседневной жизни (Рассказ учителя с использованием презентации).
- 15. Ответы к заданиям самостоятельной работы Правильные ответы :
- 16. 1.Тема нашего сегодняшнего урока … 2. Передо мной на уроке стояла цель … 3. Сегодня я
- 18. Скачать презентацию











 Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Синтетические топлива
Синтетические топлива Определение витамина “С” в продуктах питания с помощью иодометрии
Определение витамина “С” в продуктах питания с помощью иодометрии Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Этапы гравиметрического анализа. (Лекция 3)
Этапы гравиметрического анализа. (Лекция 3) Искусственная и синтетическая резина
Искусственная и синтетическая резина Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах
Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах Галогены (солеобразующие)
Галогены (солеобразующие) Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Свойства воды. Оценка качества
Свойства воды. Оценка качества Теплота сгорания топлива
Теплота сгорания топлива Железо и его соединения
Железо и его соединения Коррозия металлов
Коррозия металлов Классы неорганических веществ. Соли
Классы неорганических веществ. Соли Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Анионы. Группы анионов
Анионы. Группы анионов Электронное строение атома
Электронное строение атома Metal–metal multiple bonded intermediates in catalysis
Metal–metal multiple bonded intermediates in catalysis Магний (Mg)
Магний (Mg) Химические свойства солей в свете теории электролитической диссоциации
Химические свойства солей в свете теории электролитической диссоциации Удивительный мир камня
Удивительный мир камня Щелочные металлы
Щелочные металлы Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)
Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)