Содержание
- 2. Амины Аминами называют органические соединения, которые получают замещением атомов водорода в аммиаке углеводородными В зависимости от
- 3. По типу радикалов амины делят на: Предельные; Непредельные; Ароматические. По количеству аминогрупп амины делят на: Моноамины;
- 4. Номенклатура Универсальная. Название амина строят из двух слов: названия углеводородных радикалов по радикальной номенклатуре и слова
- 5. Первичные Вторичные Третичные
- 6. Положения аминогрупп Структурная (углеродного скелета) Метамерия - ???? Изомерия
- 7. Способы получения 1. В 1850 году немецкий химик Гофман впервые получил амин в результате химической реакции
- 8. 2. В промышленности первичные амины получают восстановлением нитросоединений. 3. Взаимодействие спиртов с аммиаком
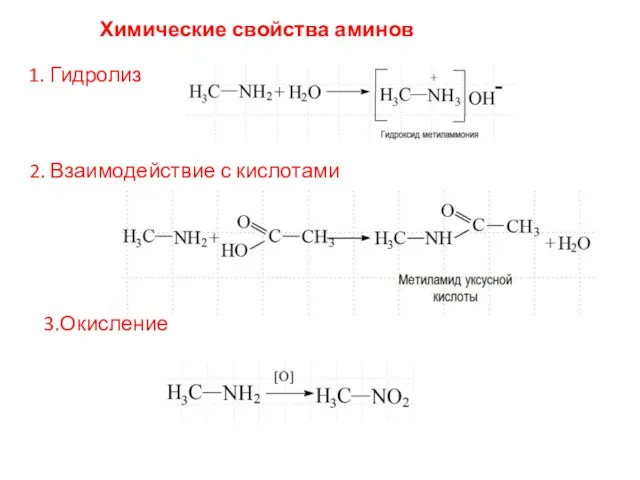
- 9. Химические свойства аминов 1. Гидролиз 2. Взаимодействие с кислотами 3.Окисление
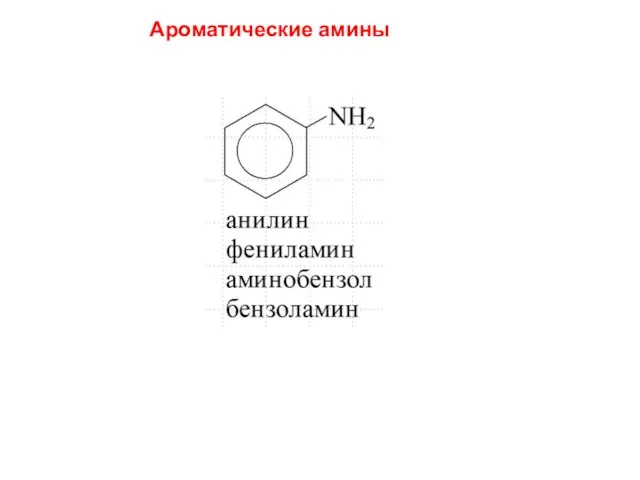
- 10. Ароматические амины
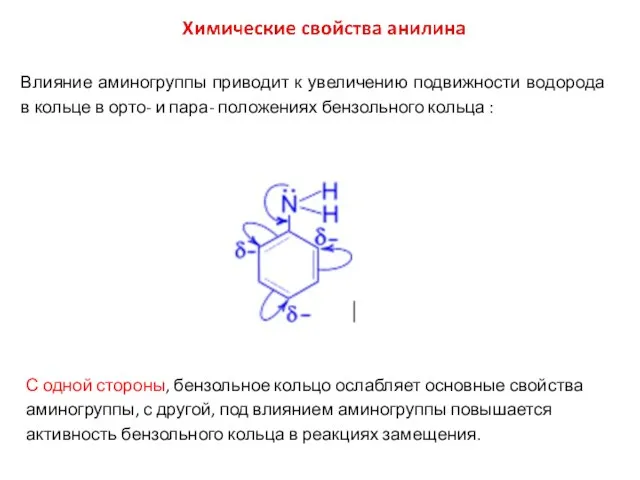
- 11. Влияние аминогруппы приводит к увеличению подвижности водорода в кольце в орто- и пара- положениях бензольного кольца
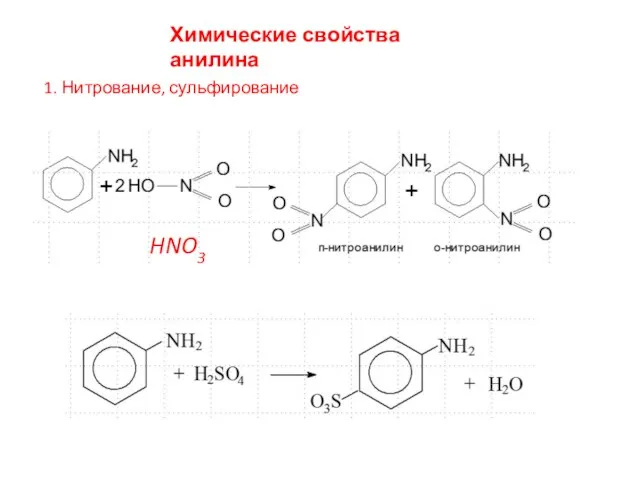
- 12. Химические свойства анилина 1. Нитрование, сульфирование HNO3
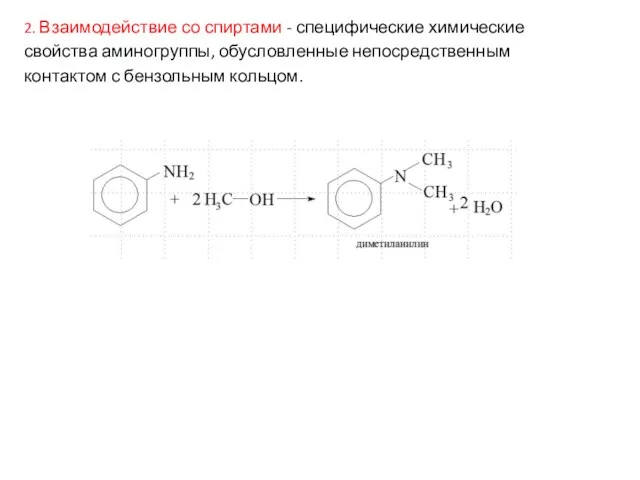
- 13. 2. Взаимодействие со спиртами - специфические химические свойства аминогруппы, обусловленные непосредственным контактом с бензольным кольцом.
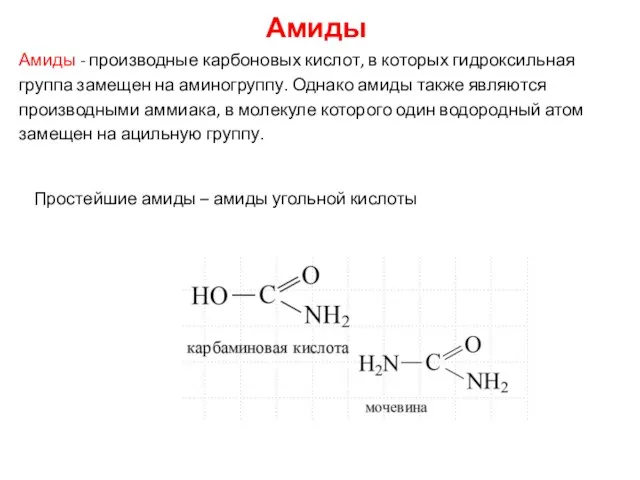
- 14. Амиды Амиды - производные карбоновых кислот, в которых гидроксильная группа замещен на аминогруппу. Однако амиды также
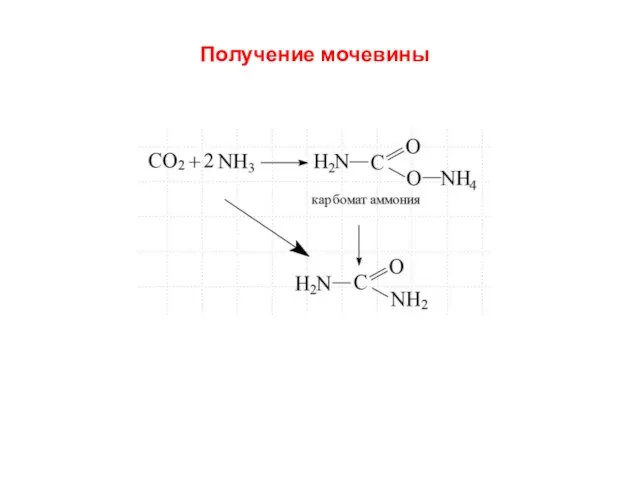
- 15. Получение мочевины
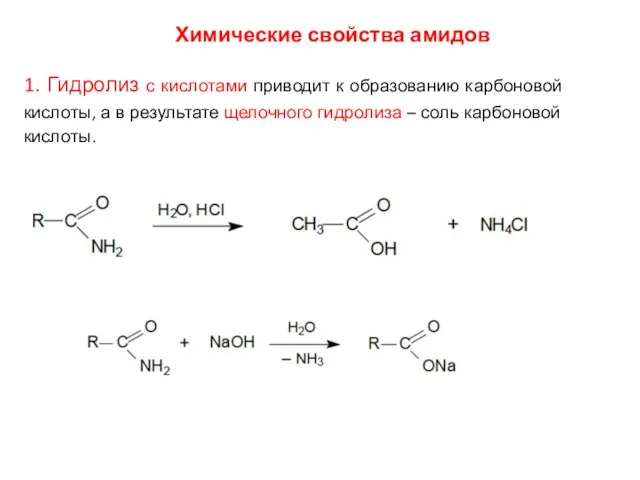
- 16. Химические свойства амидов 1. Гидролиз с кислотами приводит к образованию карбоновой кислоты, а в результате щелочного
- 17. 2. При взаимодействии с водой идет гидролиз с образованием аммиака 3. При восстановлении амидов образуются первичные
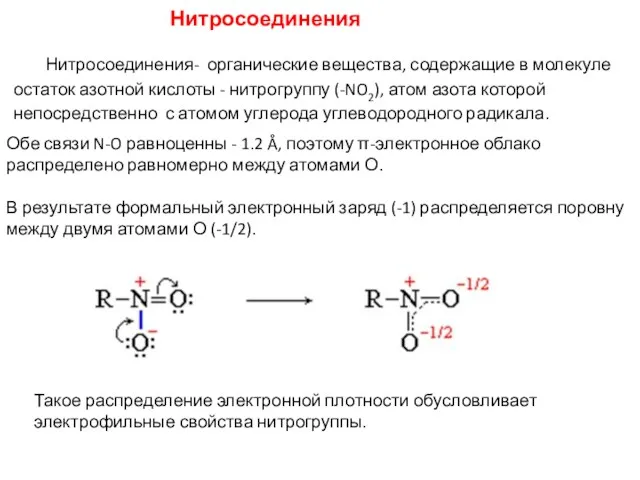
- 18. Нитросоединения Нитросоединения- органические вещества, содержащие в молекуле остаток азотной кислоты - нитрогруппу (-NO2), атом азота которой
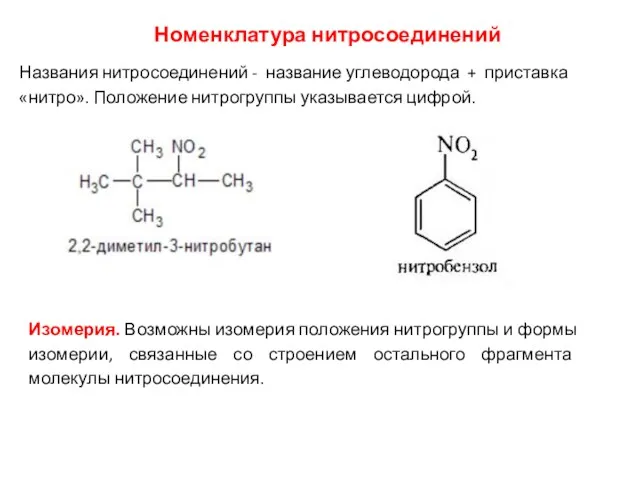
- 19. Номенклатура нитросоединений Названия нитросоединений - название углеводорода + приставка «нитро». Положение нитрогруппы указывается цифрой. Изомерия. Возможны
- 20. Химические свойства нитросоединений Для нитросоединений характерны реакции с разрывом связи С—N, по связям N-O и реакции
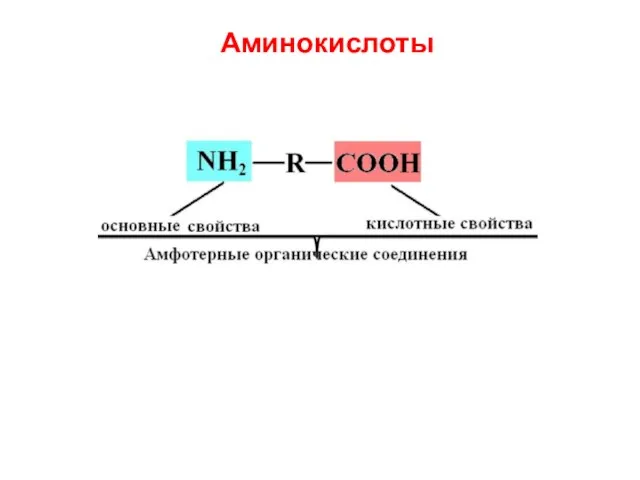
- 21. Аминокислоты
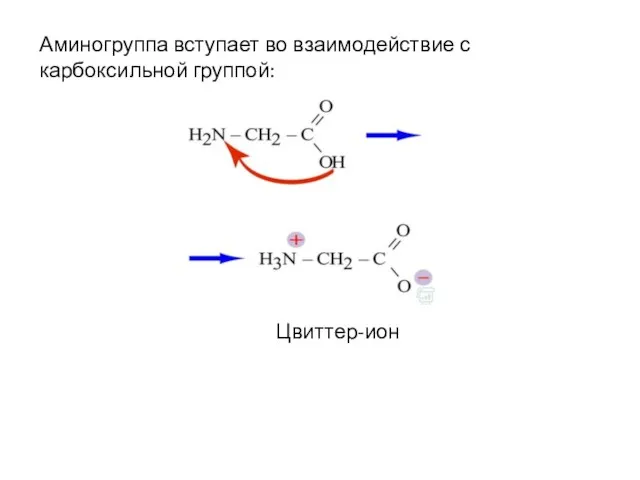
- 22. Аминогруппа вступает во взаимодействие с карбоксильной группой: Цвиттер-ион
- 23. Реакции с участием карбоксильной группы С активными металлами Оксидами металлов Гидроксидами металлов Солями слабых летучих кислот
- 25. Реакции с участием аминогруппы Взаимодействие с кислотами
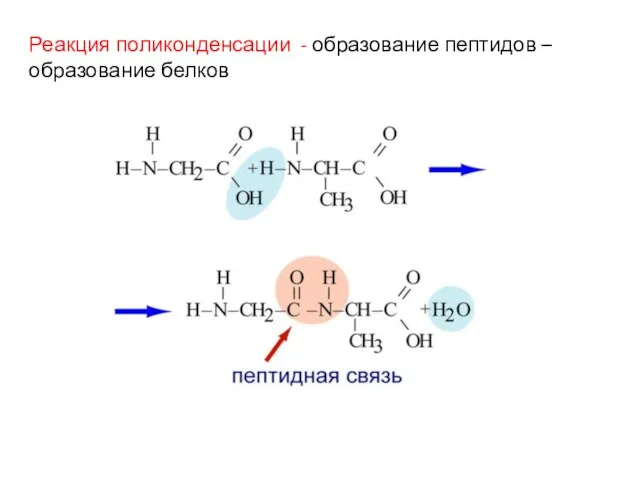
- 26. Реакция поликонденсации - образование пептидов – образование белков
- 27. Гетероциклическими называются соединения, имеющие циклическую структуру и содержащие в цикле неуглеродные атомы (гетероатомы). Наибольшее распространение и
- 28. Классификация и номенклатура гетероциклов Гетероциклы классифицируются: 1) по величине цикла 2) по виду и количеству гетероатомов
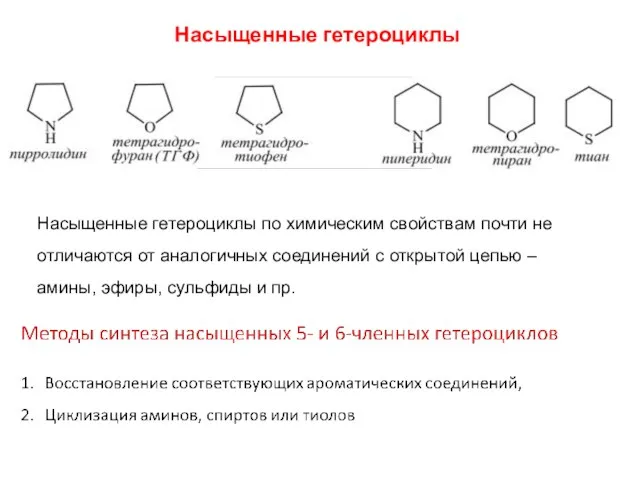
- 29. Насыщенные гетероциклы Насыщенные гетероциклы по химическим свойствам почти не отличаются от аналогичных соединений с открытой цепью
- 31. Пятичленные гетероциклы с одним гетероатомом Пятичленные гетероциклы с одним гетероатомом и двумя двойными С-С-связями отвечают требованиям
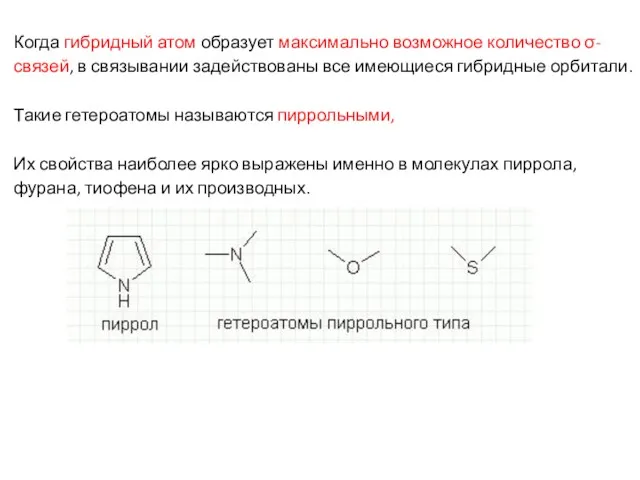
- 32. Когда гибридный атом образует максимально возможное количество σ-связей, в связывании задействованы все имеющиеся гибридные орбитали. Такие
- 33. Химические свойства гетероциклов: - кислотно-основные превращения с участием гетероатома; - реакции присоединения; реакции замещения: относительная активность
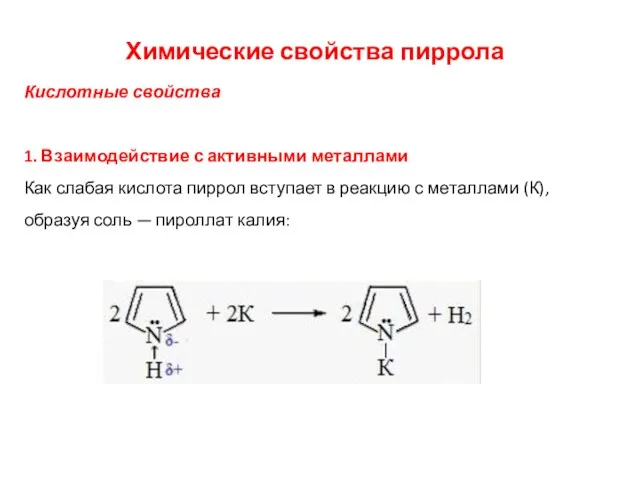
- 34. Химические свойства пиррола Кислотные свойства 1. Взаимодействие с активными металлами Как слабая кислота пиррол вступает в
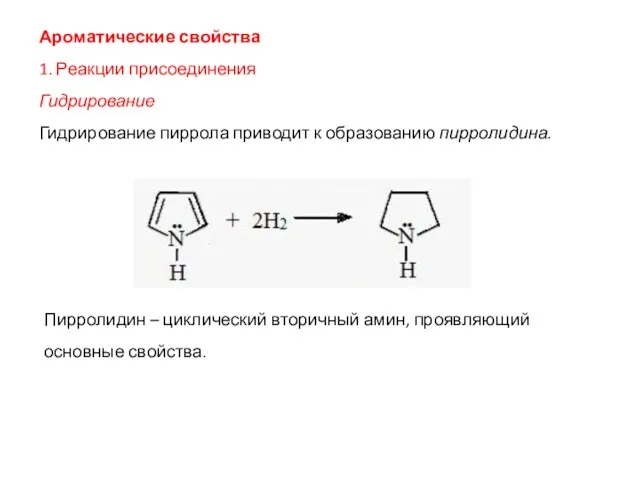
- 35. Ароматические свойства 1. Реакции присоединения Гидрирование Гидрирование пиррола приводит к образованию пирролидина. Пирролидин – циклический вторичный
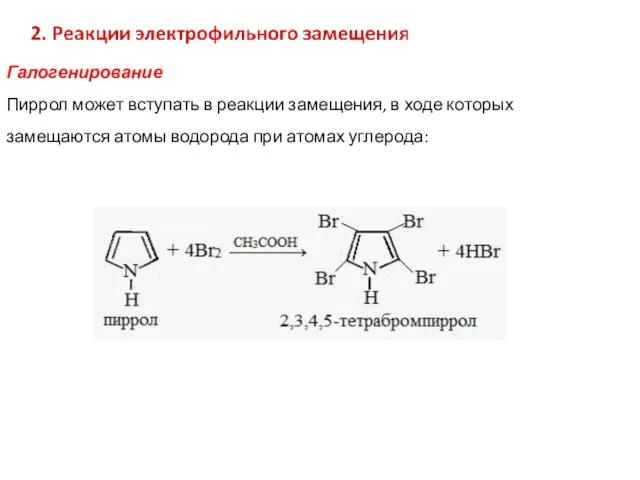
- 36. Галогенирование Пиррол может вступать в реакции замещения, в ходе которых замещаются атомы водорода при атомах углерода:
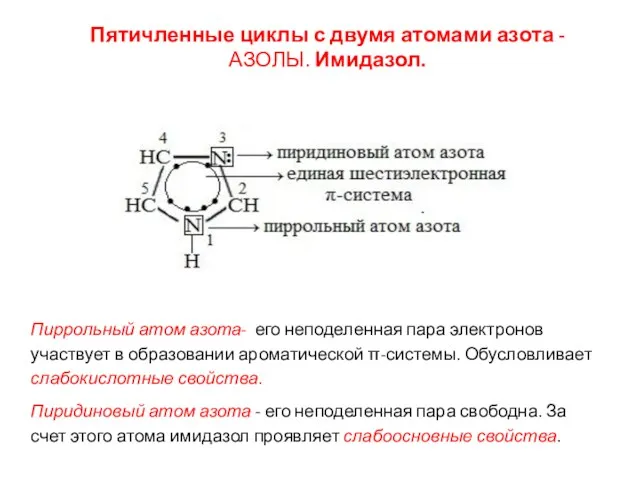
- 37. Пятичленные циклы с двумя атомами азота - АЗОЛЫ. Имидазол. Пиррольный атом азота- его неподеленная пара электронов
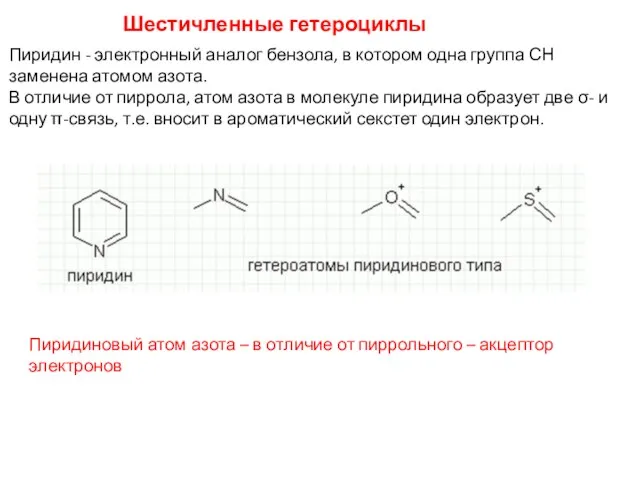
- 38. Шестичленные гетероциклы Пиридин - электронный аналог бензола, в котором одна группа СН заменена атомом азота. В
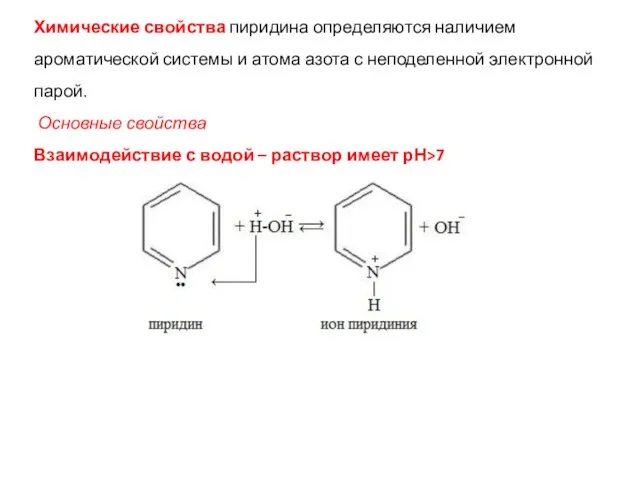
- 39. Химические свойства пиридина определяются наличием ароматической системы и атома азота с неподеленной электронной парой. Основные свойства
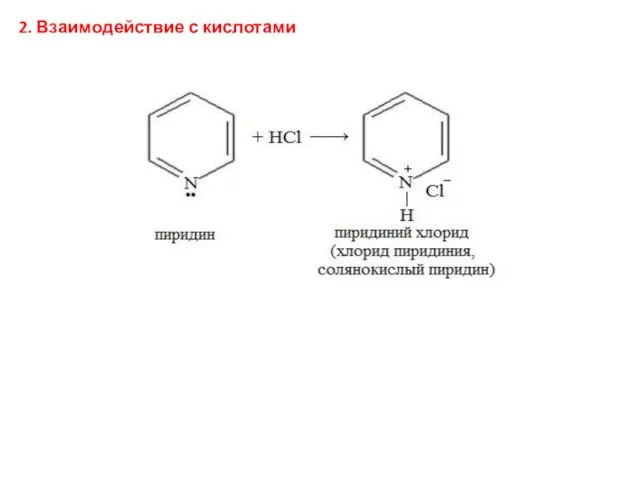
- 40. 2. Взаимодействие с кислотами
- 41. Ароматические свойства Реакции электрофильного замещения Азот как более электроотрицательный элемент оттягивает электроны на себя и понижает
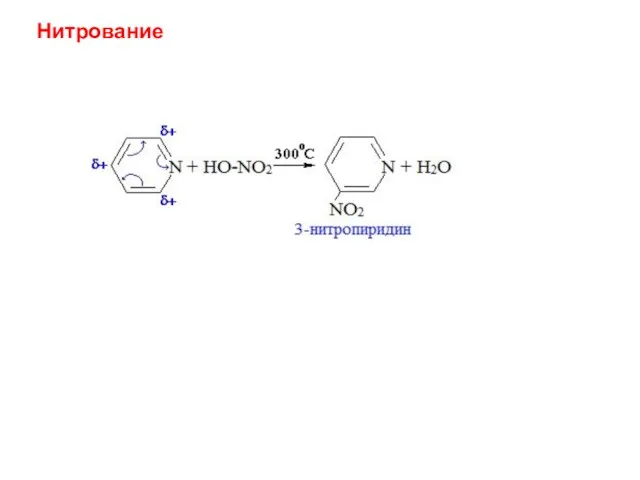
- 42. Нитрование
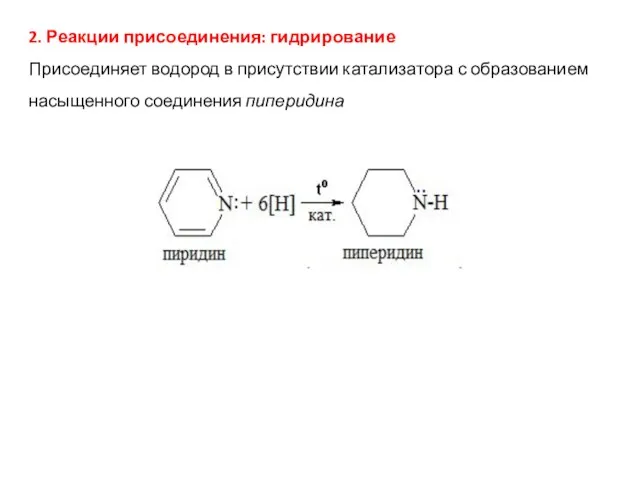
- 43. 2. Реакции присоединения: гидрирование Присоединяет водород в присутствии катализатора с образованием насыщенного соединения пиперидина
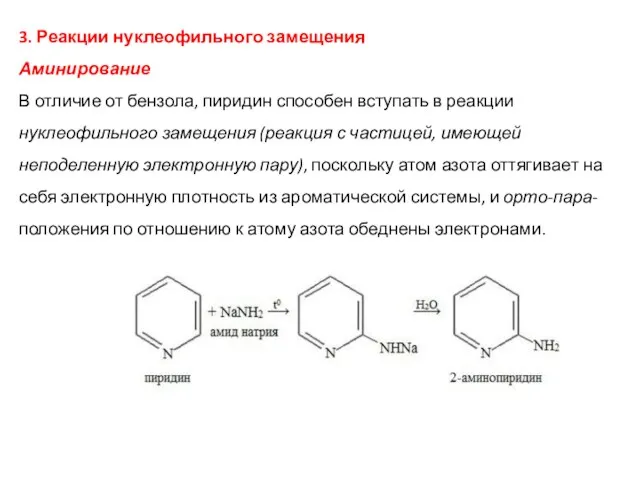
- 44. 3. Реакции нуклеофильного замещения Аминирование В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения
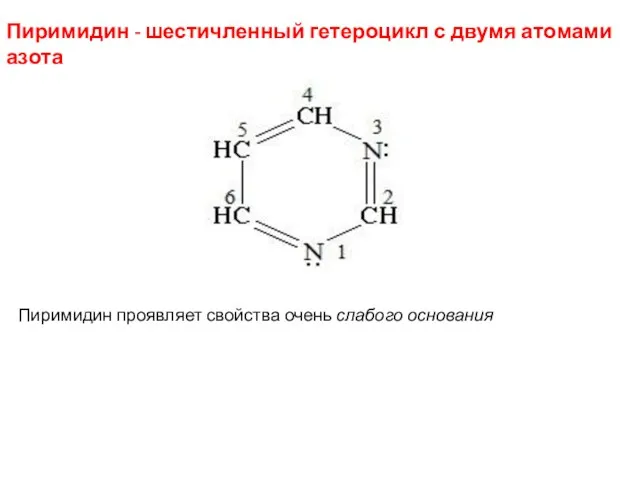
- 45. Пиримидин - шестичленный гетероцикл с двумя атомами азота Пиримидин проявляет свойства очень слабого основания
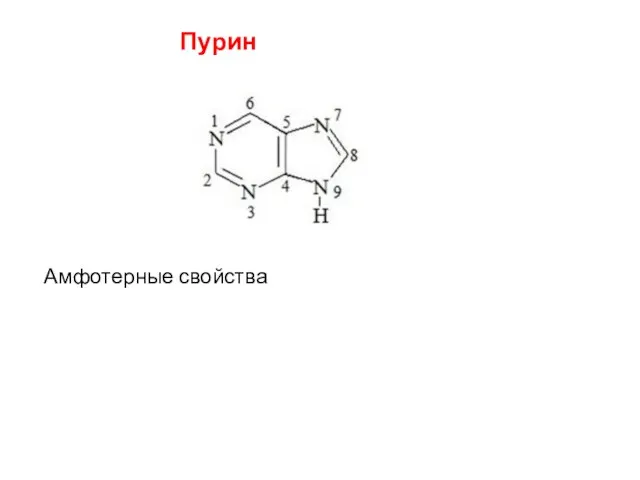
- 46. Пурин Амфотерные свойства
- 48. Скачать презентацию

















 Гидродинамические модели реакторов. Лекция № 2
Гидродинамические модели реакторов. Лекция № 2 Массовая доля вещества в растворе. Урок химии. 8 класс
Массовая доля вещества в растворе. Урок химии. 8 класс Жидкостная хроматография
Жидкостная хроматография Своя игра по химии
Своя игра по химии Железо и его соединения
Железо и его соединения Строение атома (лекция 3)
Строение атома (лекция 3) Экстракция. Понятия в экстракции
Экстракция. Понятия в экстракции Свойства воды. Оценка качества
Свойства воды. Оценка качества Химическая кинетика
Химическая кинетика Аллотропные модификации алмаза
Аллотропные модификации алмаза Электроотрицательность химических элементов. Виды химической связи
Электроотрицательность химических элементов. Виды химической связи Способы получения металлов. (11 класс)
Способы получения металлов. (11 класс) Железо и его соединения
Железо и его соединения Углерод. Carbon
Углерод. Carbon Оксиды, классификация и свойства
Оксиды, классификация и свойства Železo. Železo je polymorfní kov, který se vyskytuje ve více modifikacích
Železo. Železo je polymorfní kov, který se vyskytuje ve více modifikacích Теория электролитической диссоциации. Водородный показатель
Теория электролитической диссоциации. Водородный показатель Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша) Сополимеризация. Основные количественные характеристики процесса сополимеризации
Сополимеризация. Основные количественные характеристики процесса сополимеризации Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Современные тенденции развития химии
Современные тенденции развития химии Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Подготовка учащихся к практическим турам олимпиад по химии
Подготовка учащихся к практическим турам олимпиад по химии Disperse systems. True solution
Disperse systems. True solution Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів