Содержание
- 2. Что изучает химическая кинетика? Химическая кинетика изучает закономерности протекания химических процессов во времени и их механизм
- 3. Скорость химической реакции Скорость гомогенной химической реакции (в газовой фазе или в растворе) – это изменение
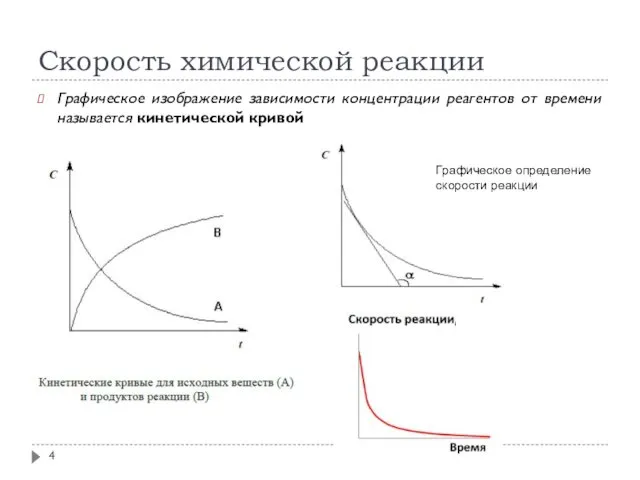
- 4. Скорость химической реакции Графическое изображение зависимости концентрации реагентов от времени называется кинетической кривой Графическое определение скорости
- 5. Скорость химической реакции Если химическая реакция описывается стехиометрическим уравнением aA + bB → rR + sS
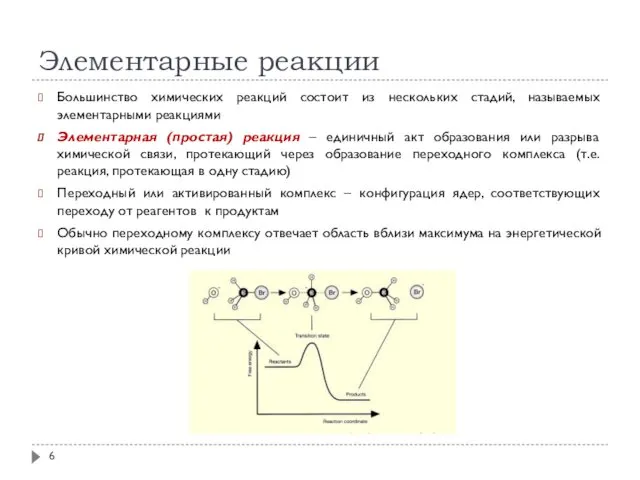
- 6. Элементарные реакции Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями Элементарная (простая) реакция –
- 7. Молекулярность реакции Для характеристики элементарных реакций используют понятие молекулярности реакции Молекулярностью реакции называют число частиц, участвующих
- 8. Механизм реакции Сложная реакция состоит из нескольких элементарных реакций Совокупность элементарных реакций называют механизмом реакции Скорость
- 9. Факторы, влияющие на скорость реакции Природа реагирующих веществ (тип химических связей в молекулах реагентов, прочность связей,
- 10. Постулаты химической кинетики Законы химической кинетики основаны на принципах (постулатах): скорость химической реакции прямо пропорциональна произведению
- 11. Влияние концентрации реагирующих веществ на скорость реакции Функциональная зависимость скорости химической реакции от концентраций компонентов называется
- 12. Порядок сложной реакции Порядок сложной реакции по веществу в общем случае не совпадает с коэффициентами в
- 13. Реакции нулевого порядка Реакциями нулевого порядка по данному веществу являются реакции в закрытой системе про постоянном
- 14. Примеры реакций нулевого порядка Реакции нулевого порядка встречаются в гетерогенных процессах, гетерогенном катализе и всегда указывают
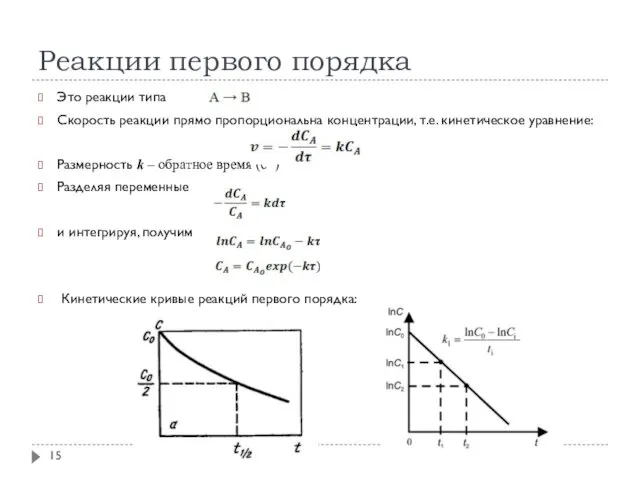
- 15. Реакции первого порядка Это реакции типа Скорость реакции прямо пропорциональна концентрации, т.е. кинетическое уравнение: Размерность k
- 16. Реакции первого порядка Особенности реакций первого порядка: Скорость реакции экспоненциально зависит от концентрации График зависимости lnC
- 17. Примеры реакций первого порядка Разложение оксида азота (V) в газовой фазе Разложение ацетона Радиоактивный распад Гидролиз
- 18. Реакции второго порядка В реакции участвуют два реагента Возможны два случая Случай 1. А+В→продукты, начальные концентрации
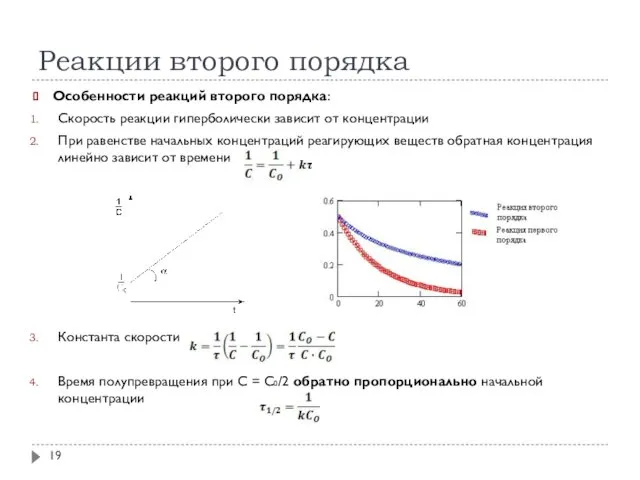
- 19. Реакции второго порядка Особенности реакций второго порядка: Скорость реакции гиперболически зависит от концентрации При равенстве начальных
- 20. Реакции второго порядка Случай 2. А+В→продукты, начальные концентрации веществ не равны, т.е. Кинетическое уравнение Разделяя переменные
- 21. Примеры реакций второго порядка Газофазное разложение иодоводорода Разложение оксида азота (IV) Разложение гипохлорит-иона в растворе Газофазное
- 22. Реакции n-го порядка Это реакции типа nА→продукты Кинетическое уравнение Решение уравнения: Время полупревращения
- 23. Реакции других порядков Необычный — дробный или отрицательный — порядок реакции однозначно указывает на её сложный
- 24. Определение порядка реакции Методы определения порядка реакции базируются на методах вычислительной математики, которые позволяют по кинетическим
- 25. Прием избытка (метод понижения концентрации)
- 26. Метод Вант-Гоффа Порядок реакции определяют по скоростям превращения Для реакции А+В→продукты записывают уравнение закона действующих масс:
- 27. Метод подстановки Заключается в том, что экспериментальные данные последовательно подставляют в интегральные кинетические уравнения для реакций
- 28. Метод Оствальда-Нойеса Порядок реакции определяют по времени достижения определённой доли превращения α: Отсюда порядок реакции
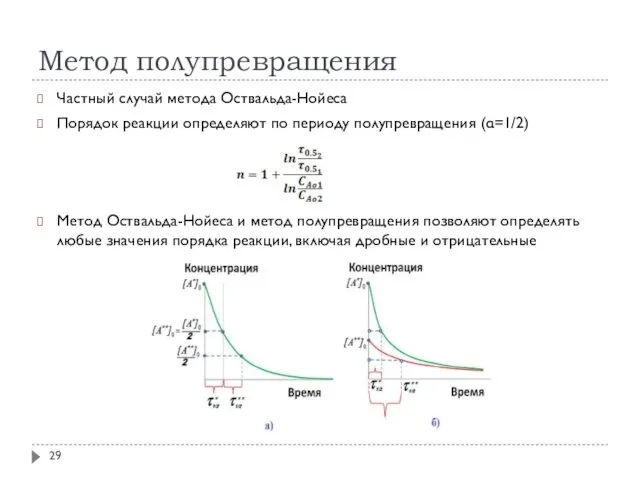
- 29. Метод полупревращения Частный случай метода Оствальда-Нойеса Порядок реакции определяют по периоду полупревращения (α=1/2) Метод Оствальда-Нойеса и
- 30. Влияние температуры на скорость реакции Скорость большинства реакций увеличивается с ростом температуры, т.к. при этом возрастает
- 31. Уравнение Аррениуса Описывает зависимость константы скорости k от температуры (экспоненциальная): Энергия активации – энергетический барьер на
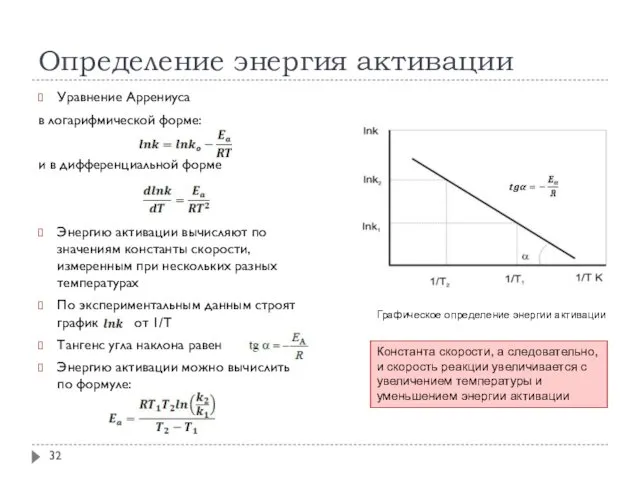
- 32. Определение энергия активации Уравнение Аррениуса в логарифмической форме: и в дифференциальной форме Энергию активации вычисляют по
- 33. Аномальная зависимость константы скорости от температуры Характерна для некоторых реакций третьего порядка, ферментативных и цепных реакций
- 34. Кинетика сложных реакций Сложными называют химические реакции, протекающие более чем в одну стадию. При изучении сложных
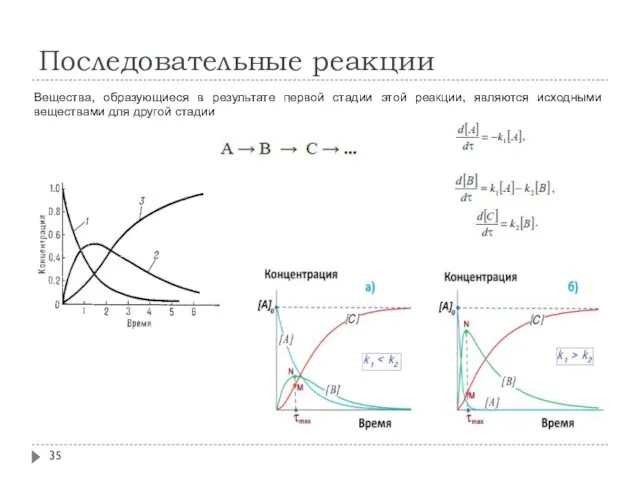
- 35. Последовательные реакции Вещества, образующиеся в результате первой стадии этой реакции, являются исходными веществами для другой стадии
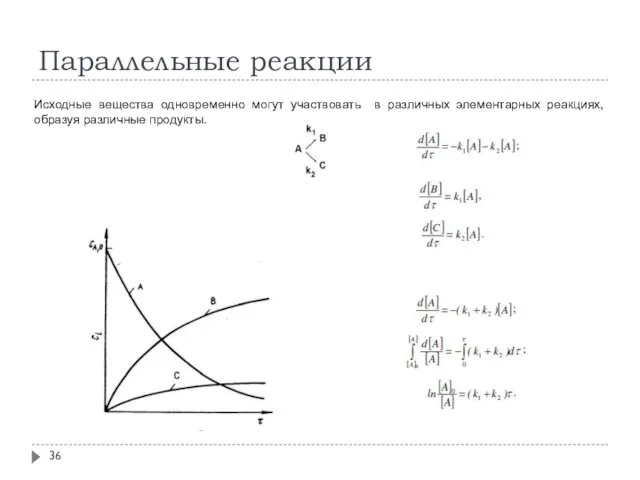
- 36. Параллельные реакции Исходные вещества одновременно могут участвовать в различных элементарных реакциях, образуя различные продукты.
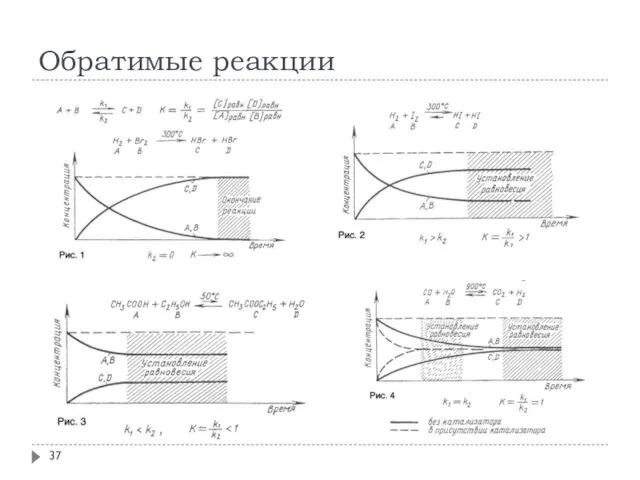
- 37. Обратимые реакции
- 38. Сопряженные реакции
- 39. Цепные реакции
- 40. Цепные реакции
- 41. Фотохимические реакции
- 43. Скачать презентацию































 Классификация минералов по химическому принципу. Занятие 9
Классификация минералов по химическому принципу. Занятие 9 Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру
Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева Химия и продукты питания
Химия и продукты питания Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Золото
Золото Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Важнейшие нефтепродукты. Области их применения
Важнейшие нефтепродукты. Области их применения 29 Кинетика идеальных проточных ректоров (2)
29 Кинетика идеальных проточных ректоров (2) Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли
Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли Занимательные опыты
Занимательные опыты Роль металлов в нашей жизни
Роль металлов в нашей жизни Керамические материалы
Керамические материалы Нитрофенилалкиламины
Нитрофенилалкиламины Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс Растворы. Часть 2
Растворы. Часть 2 Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Центрифугирование
Центрифугирование Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе
Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе Общая характеристика элементов главной подгруппы второй группы
Общая характеристика элементов главной подгруппы второй группы fosfor_i_ego_soedineniya
fosfor_i_ego_soedineniya Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями