Содержание
- 2. Бор Бор (B, лат. borum) — химический элемент 13-й группы, второго периода периодической системы (по устаревшей
- 3. Нахождение в природе Среднее содержание бора в земной коре составляет 4 г/т. Несмотря на это, известно
- 4. Физические свойства Бор расположен во втором периоде, значит, он имеет две оболочки, одна из которых внешняя,
- 5. Химические свойства Химически Бор при обычных условиях довольно инертен. С повышением температуры активность Бора возрастает, и
- 6. Химические свойства 1. Взаимодействие с фтором 2В + 3F2 = 2BF3 2. Взаимодействие с кислородом при
- 7. Основные классы соединений бора Бороводороды и борорганические соединения— соединения бора, углерода и некоторых других элементов. Такими
- 8. Тетраборан Получение: Химические свойства: 3. 4. 5.
- 9. Пентаборан Пентаборан - химическое соединение, которое рассматривалось военными 1950-х годов в США и СССР, в качестве
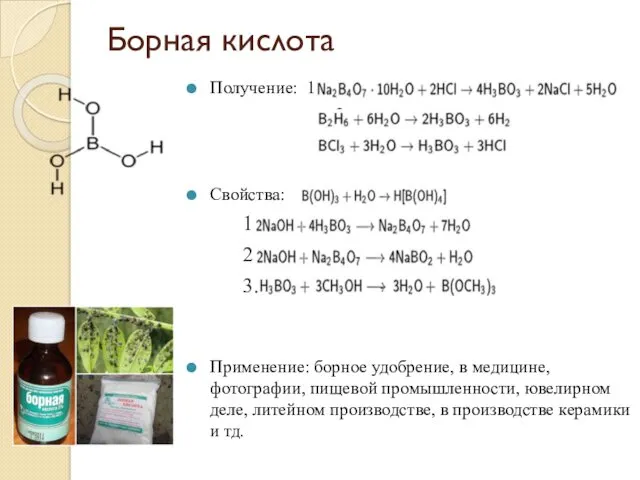
- 10. Борная кислота Получение: 1. 2. Свойства: 1. 2. 3. Применение: борное удобрение, в медицине, фотографии, пищевой
- 11. Борорганические соединения Получение: 1. Реакция Франклада, 1859 год. 2. Гидроборирование.
- 12. Полимерные соединения данного класса имеют вид: Полибороорганосилоксаны
- 13. Реакция алкил- или арилацетоксисиланов с бутиловым эфиром борной кислоты: Получение полибороорганосилоксанов
- 14. Гибридные покрытия Безгалогенные антипирены Прекурсоры для керамики и высокотемпературные клеи Модифицирование жидких каучуков Практическое применение
- 15. Карборановая система С2В10Н12
- 16. Получение
- 17. Химические свойства
- 18. Химические свойства
- 19. Химические свойства
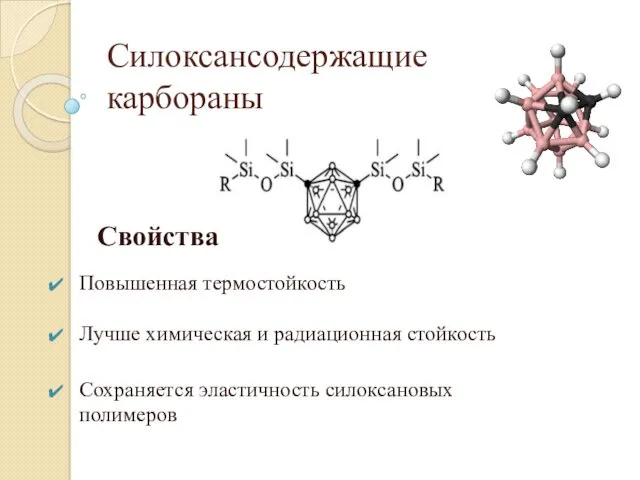
- 20. Свойства Повышенная термостойкость Лучше химическая и радиационная стойкость Сохраняется эластичность силоксановых полимеров Силоксансодержащие карбораны
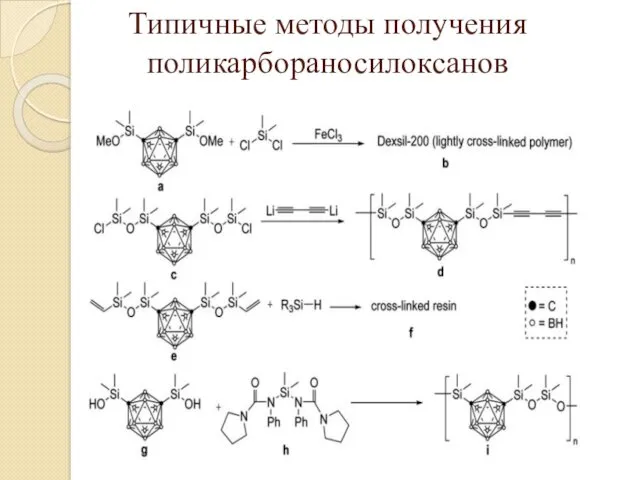
- 21. Типичные методы получения поликарбораносилоксанов
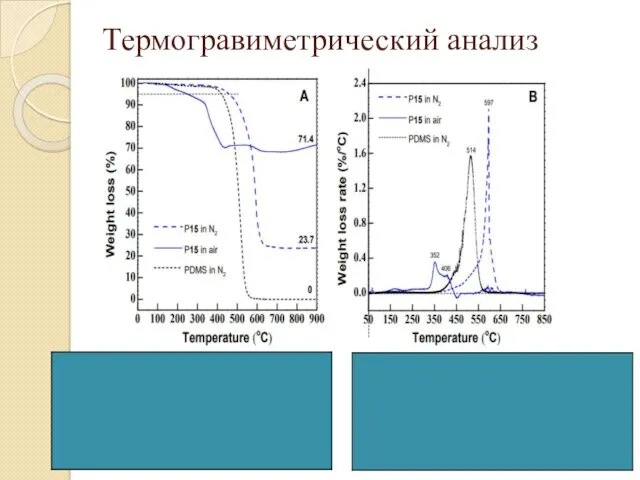
- 23. Термогравиметрический анализ Р15 - РDMS -
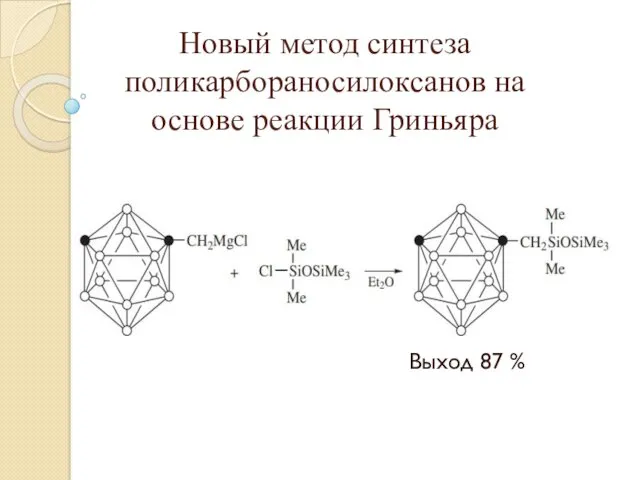
- 24. Новый метод синтеза поликарбораносилоксанов на основе реакции Гриньяра Выход 87 %
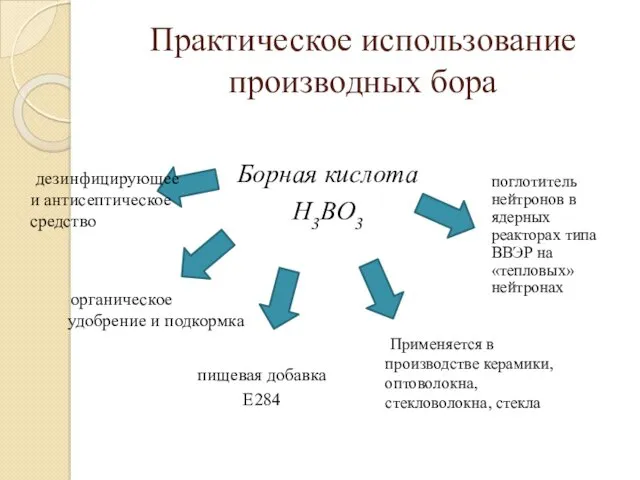
- 25. Практическое использование производных бора Борная кислота H3BO3 Применяется в производстве керамики, оптоволокна, стекловолокна, стекла пищевая добавка
- 26. Практическое использование производных бора Борорганические соединения: количественное определение ОН-групп, а так же их «защиту» в спиртах,
- 27. Практическое использование производных бора Борорганические соединения: катализаторы и сокатализаторы полимеризации непредельных углеводородов; применяются в координационно-радикальной полимеризации
- 28. Практическое использование производных бора Бораны и их органических производные применяют в качестве энергетических добавок и компонентов
- 29. Практическое использование производных бора Бор-нейтронозахватная терапия Принцип воздействия на раковые клетки методом бор-нейтронозахватной терапии достаточно прост.
- 30. Практическое использование производных бора Бор-нейтронозахватная терапия Агенты для доставки бора Требования к агентам доставки 10В для
- 31. Практическое использование производных бора устойчивы к окислению, образуют покрытия на металлах с прочностью до 20 Н/м2
- 33. Скачать презентацию
























 Практическая работа. Химический состав клетки
Практическая работа. Химический состав клетки Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация B13. Задачи на концентрацию и сплавы
B13. Задачи на концентрацию и сплавы Химические элементы в организме человека
Химические элементы в организме человека Типы заданий. ЕГЭ №32
Типы заданий. ЕГЭ №32 Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы
Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы Аммиак. 9 класс
Аммиак. 9 класс Sulfur and its compounds. Contact method for producing sulfuric acid
Sulfur and its compounds. Contact method for producing sulfuric acid Состав, строение и свойства аминокислот
Состав, строение и свойства аминокислот Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання Коррозия и защита строительных материалов
Коррозия и защита строительных материалов Методы очистки нефтяных фракций
Методы очистки нефтяных фракций Классификация химических реакций
Классификация химических реакций Амины. Номенклатура аминов
Амины. Номенклатура аминов 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Химико-аналитический контроль. Основы химико-аналитического контроля товаров
Химико-аналитический контроль. Основы химико-аналитического контроля товаров Кислородные соединения азота
Кислородные соединения азота Природные источники углеводородов
Природные источники углеводородов Атомы химических элементов
Атомы химических элементов Анализ качества лекарственных веществ, определяемых методом комплексонометрии
Анализ качества лекарственных веществ, определяемых методом комплексонометрии Аргентум, или серебро
Аргентум, или серебро Система питания двигателя от газобаллонной установки
Система питания двигателя от газобаллонной установки Оксиды и гидроксиды
Оксиды и гидроксиды Целлюлоза
Целлюлоза Металлические сплавы
Металлические сплавы Химия, как часть естествознания. Предмет химии
Химия, как часть естествознания. Предмет химии Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1) Химическая термодинамика. Задачи
Химическая термодинамика. Задачи