Прильем к раствору глюкозы несколько капель раствора сульфата меди (II) и
раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок CuOН, который с течением времени образует более крупные кристаллы Cu2O красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
СН2ОН – (СНОН)4 – СОН + 2Сu(ОН)2
= СН2ОН – (СНОН)4 – СООН + Сu2О↓+ 2Н2О
Проведение опыта
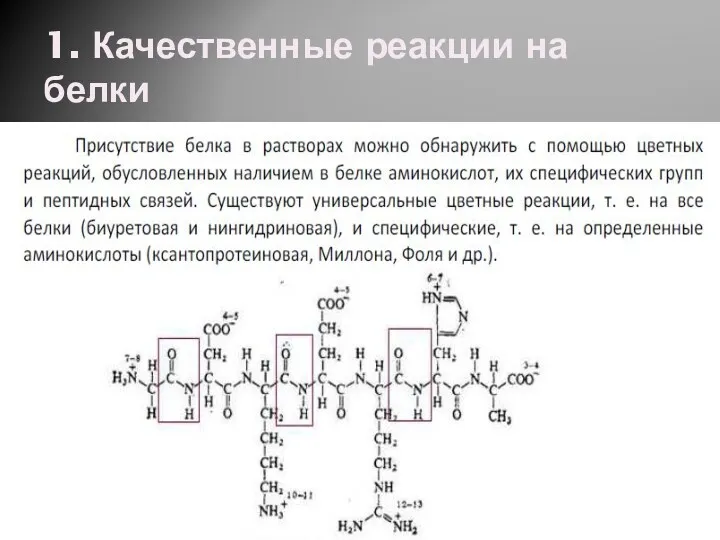








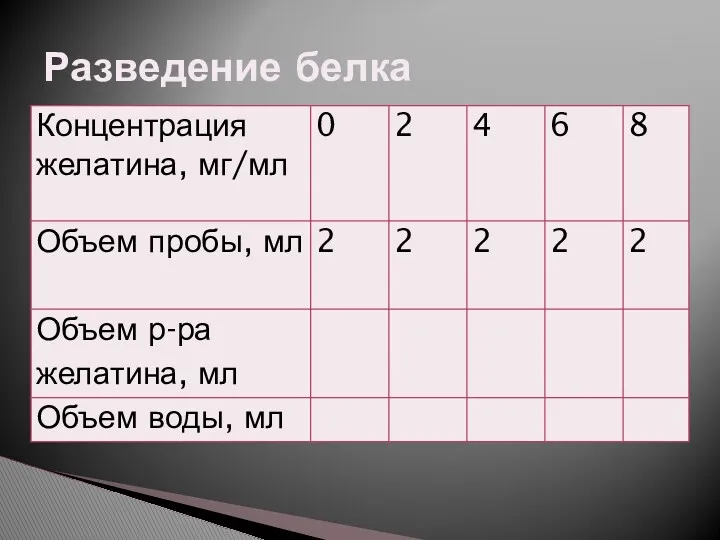
 Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества Строение атомов. Понятие о квантовой механике
Строение атомов. Понятие о квантовой механике Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Теория электролитической диссоциации
Теория электролитической диссоциации Свойства неорганических веществ. (Задание 37. ЕГЭ по химии)
Свойства неорганических веществ. (Задание 37. ЕГЭ по химии) Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Химия тория и протактиния
Химия тория и протактиния Ионоселективные электроды
Ионоселективные электроды Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Такой разный песок
Такой разный песок Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс
Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс Реакция обменного разложения веществ водой - гидролиз
Реакция обменного разложения веществ водой - гидролиз Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Свободные радикалы и болезни человека
Свободные радикалы и болезни человека Строение и химические свойства кислот
Строение и химические свойства кислот Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Игра-квест на уроке химии
Игра-квест на уроке химии Никель қаптамаларын алу жолдары
Никель қаптамаларын алу жолдары Методы выращивания кристаллов
Методы выращивания кристаллов Энергетика химических процессов. Химическая термодинамика
Энергетика химических процессов. Химическая термодинамика Контроль качества пищевых товаров
Контроль качества пищевых товаров Александр Евгеньевич Ферсман
Александр Евгеньевич Ферсман Ізомери у природі
Ізомери у природі Цветные металлы
Цветные металлы Теория химического строения органических соединений
Теория химического строения органических соединений Химический элемент. Изотопы. 11 класс
Химический элемент. Изотопы. 11 класс Алкины. Номенклатура и изомерия
Алкины. Номенклатура и изомерия