Содержание
- 2. Антиоксиданты, и способы их изучения
- 3. Антиоксиданты - соединения, тормозящие процессы оксидативного стресса Оксидативный стресс - процесс, повреждения биологических структур, протекающий с
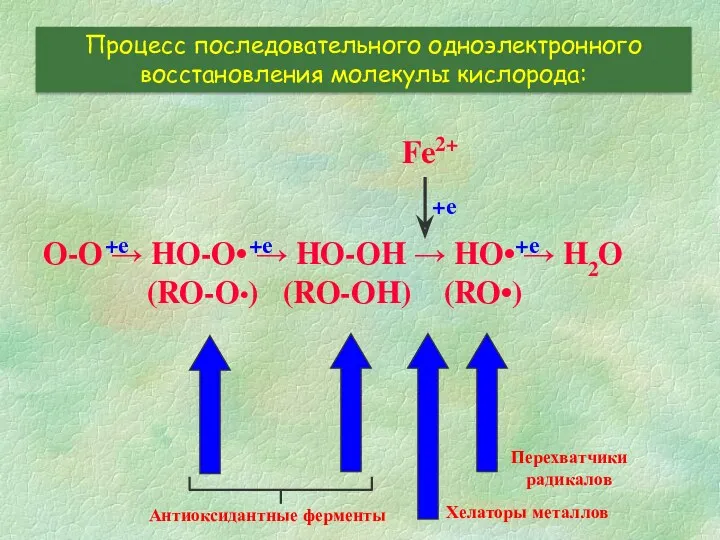
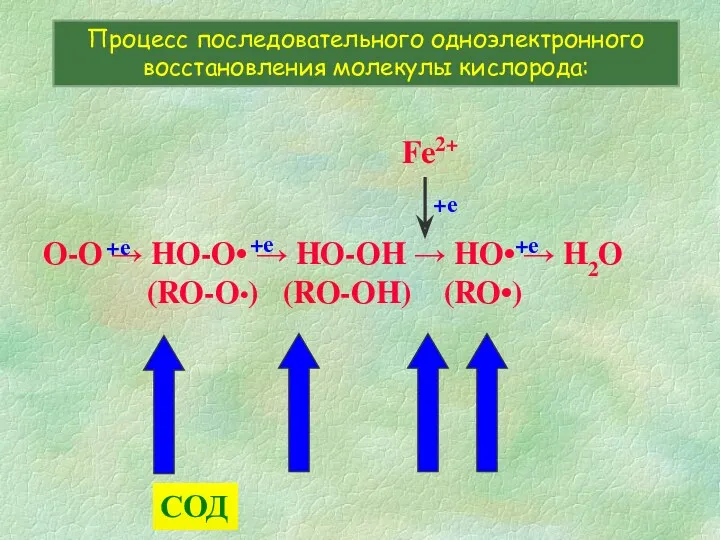
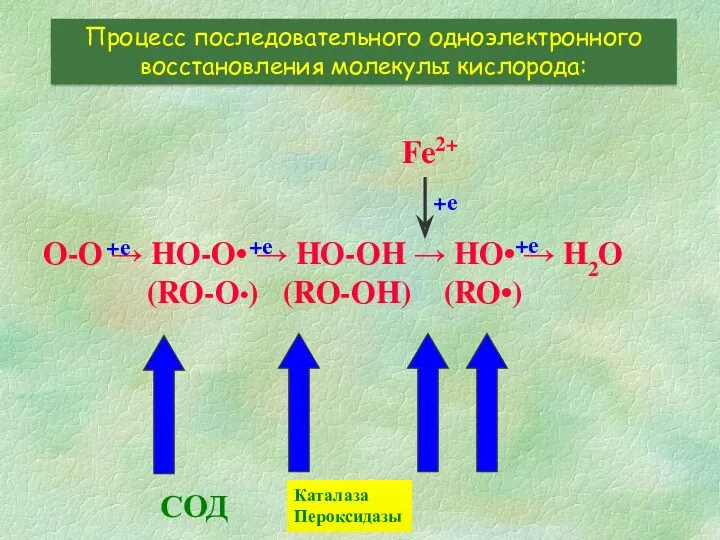
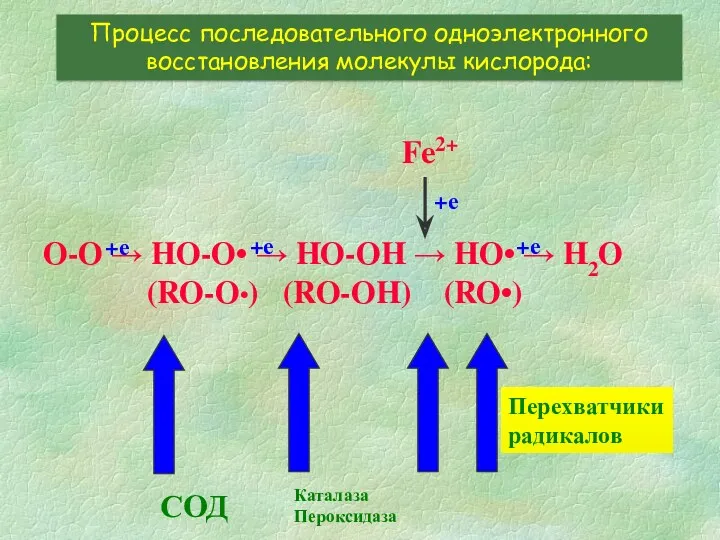
- 4. O-O → HO-O• → HO-OH → HO• → H2O (RO-O•) (RO-OH) (RO•) Процесс последовательного одноэлектронного восстановления
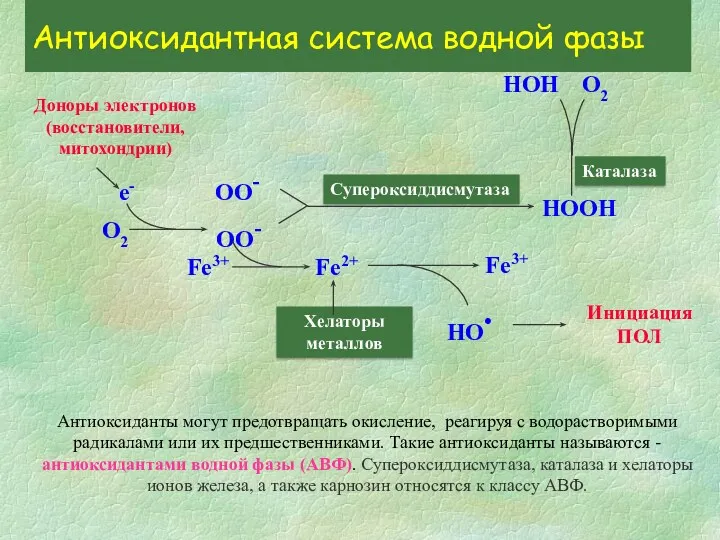
- 5. О2 Доноры электронов (восстановители, митохондрии) е- ОО- ОО- Супероксиддисмутаза НООН Каталаза Fe3+ Fe2+ Хелаторы металлов Инициация
- 6. Антиоксидантные ферменты Супероксид дисмутаза
- 7. O-O → HO-O• → HO-OH → HO• → H2O (RO-O•) (RO-OH) (RO•) Процесс последовательного одноэлектронного восстановления
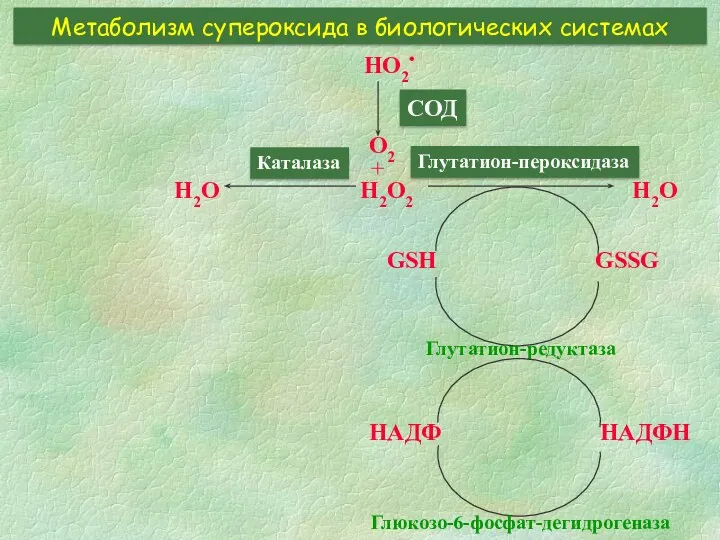
- 8. Метаболизм супероксида в биологических системах HO2• СОД O2 + H2O2 GSH GSSG Глутатион-редуктаза НАДФ НАДФН Глюкозо-6-фосфат-дегидрогеназа
- 9. Супероксиддисмутаза Супероксиддисмутаза (СОД) - единственный известный в настоящее время фермент, субстратом которого являются свободные радикалы. Супероксиддисмутаза
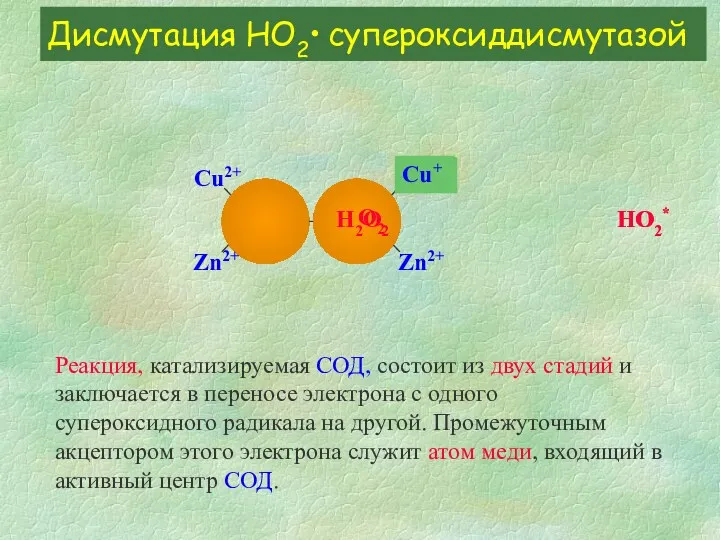
- 10. Дисмутация HО2• супероксиддисмутазой Реакция, катализируемая СОД, состоит из двух стадий и заключается в переносе электрона с
- 11. Дисмутация HО2• супероксиддисмутазой Сu2+ Zn2+ Zn2+ Сu2+ HO2* H2O2 Реакция, катализируемая СОД, состоит из двух стадий
- 12. Измерение активности СОД Генерацию радикалов осуществляют: -физически (например, радиолиз, электролиз); -химически (например, распад пероксида и автоокисление);
- 13. Антиоксидантные ферменты Каталаза и Пероксидазы
- 14. O-O → HO-O• → HO-OH → HO• → H2O (RO-O•) (RO-OH) (RO•) Процесс последовательного одноэлектронного восстановления
- 15. Дезактивация перекиси водорода Перекись водорода (Н2О2) - основной источник самых токсичных радикалов в живых системах -
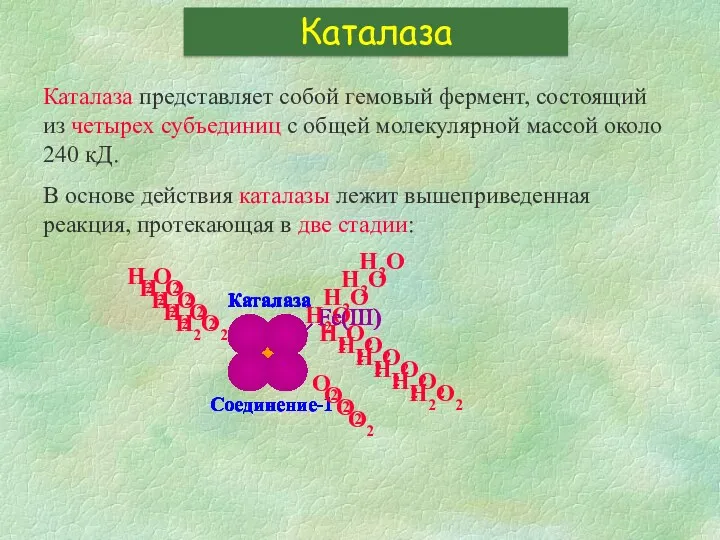
- 16. Как работают каталаза и пероксидаза? Стадии ферментативного цикла каталазы: Стадии ферментативного цикла пероксидазы: 1. Cat-Fe3+ +
- 17. Каталаза представляет собой гемовый фермент, состоящий из четырех субъединиц с общей молекулярной массой около 240 кД.
- 18. Пероксидазы Пероксидазы также являются ферментами, разрушающими Н2О2 нерадикальным путем и образующими Н2О; при этом окислению подвергается
- 19. Перехватчики радикалов Антиоксиданты, и способы их изучения
- 20. O-O → HO-O• → HO-OH → HO• → H2O (RO-O•) (RO-OH) (RO•) Процесс последовательного одноэлектронного восстановления
- 21. Перехватчики радикалов В качестве системы защиты организма от повреждающего действия радикалов кислорода могут выступать низкомолекулярные вещества,
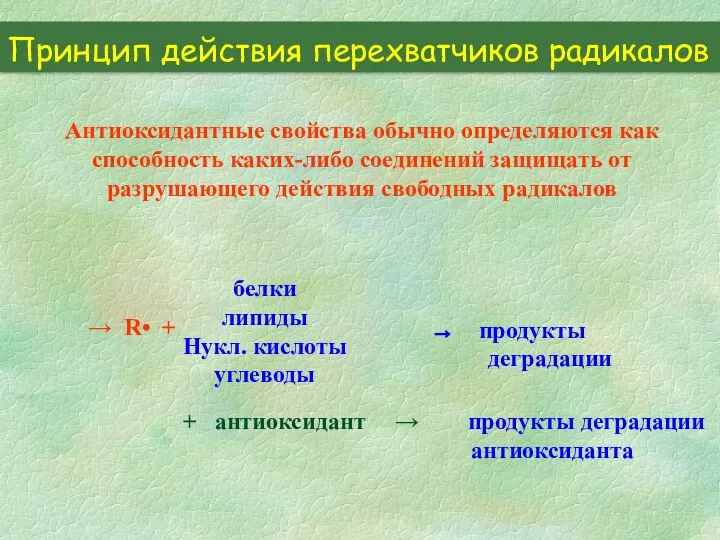
- 22. Принцип действия перехватчиков радикалов Антиоксидантные свойства обычно определяются как способность каких-либо соединений защищать от разрушающего действия
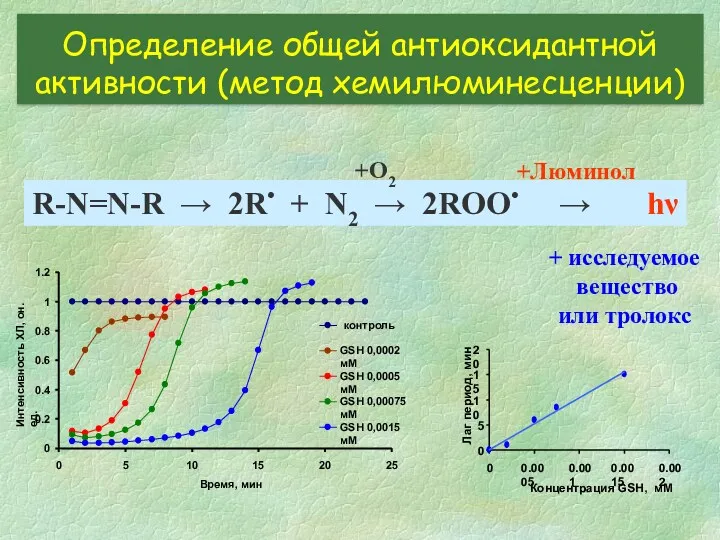
- 23. R-N=N-R → 2R• + N2 → 2ROO• → hν +O2 +Люминол 0 0.2 0.4 0.6 0.8
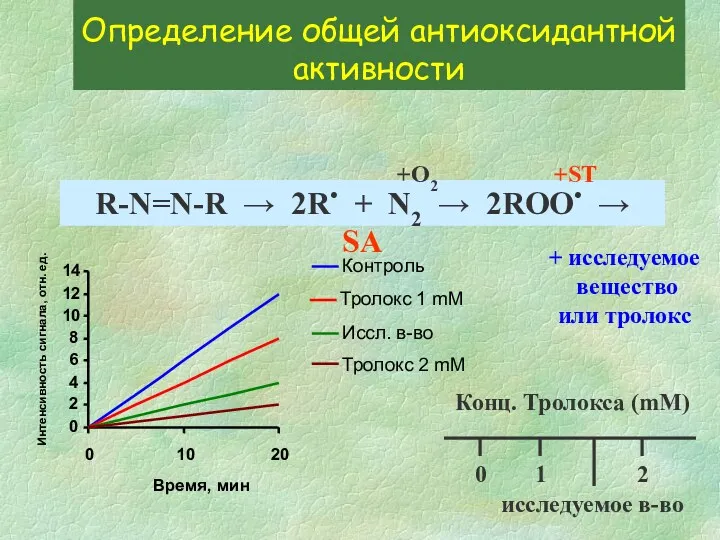
- 24. Определение общей антиоксидантной активности R-N=N-R → 2R• + N2 → 2ROO• → SA +O2 +ST 0
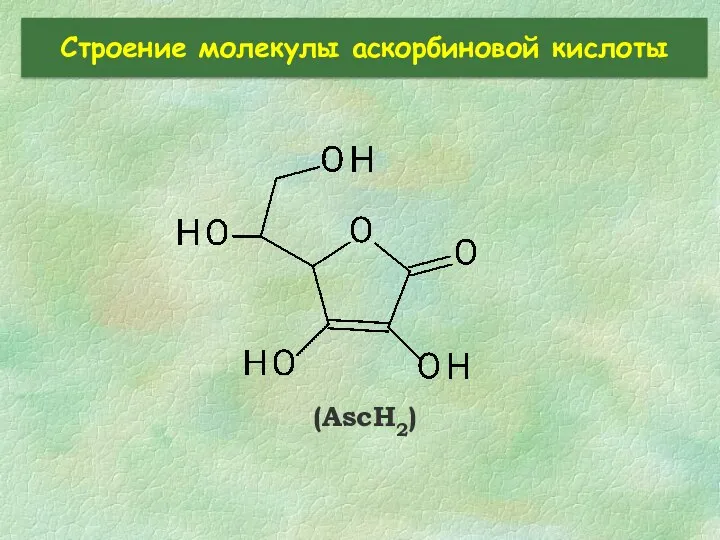
- 25. Строение молекулы аскорбиновой кислоты (AscH2)
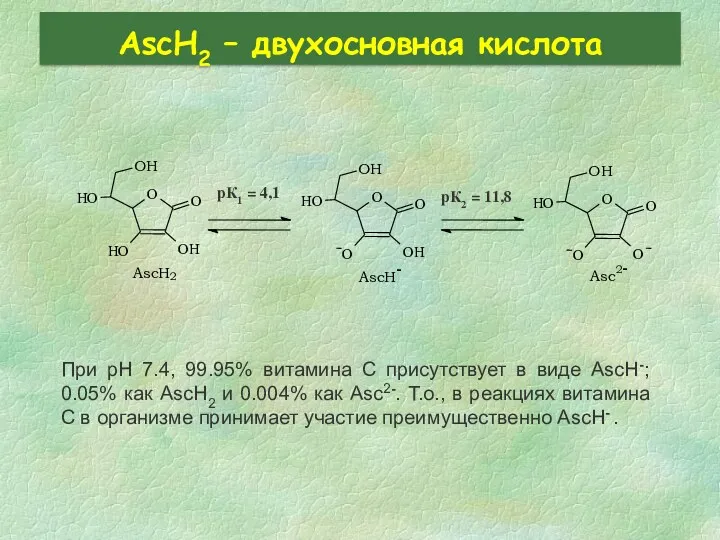
- 26. AscH2 – двухосновная кислота При pH 7.4, 99.95% витамина C присутствует в виде AscH-; 0.05% как
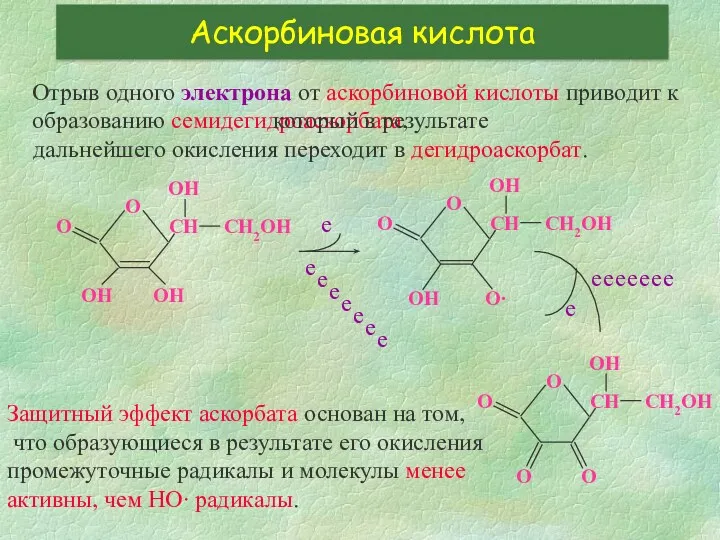
- 27. Аскорбиновая кислота Отрыв одного электрона от аскорбиновой кислоты приводит к образованию семидегидроаскорбата, е е е е
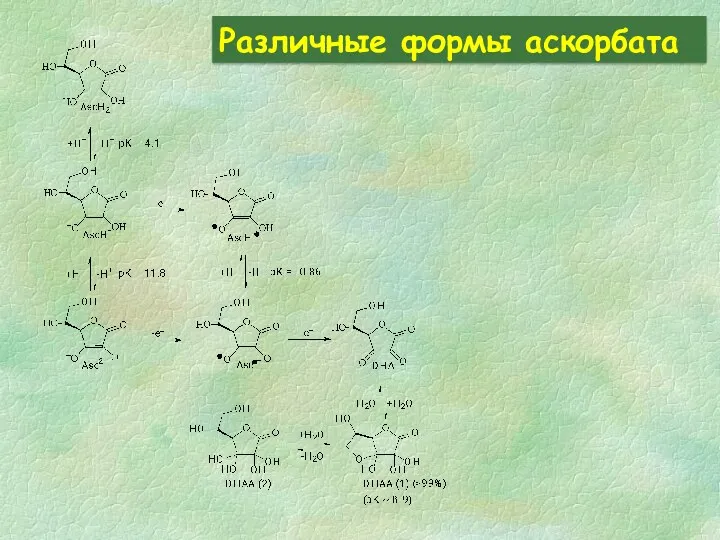
- 28. Различные формы аскорбата
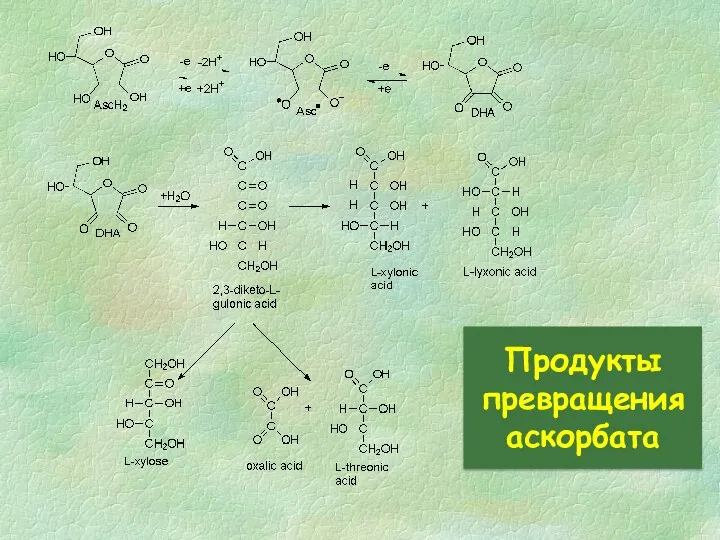
- 29. Продукты превращения аскорбата
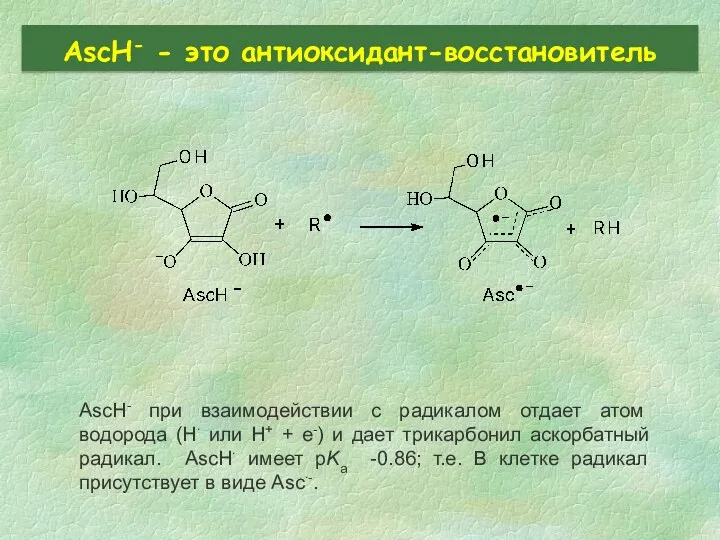
- 30. AscH- - это антиоксидант-восстановитель AscH- при взаимодействии с радикалом отдает атом водорода (H∙ или H+ +
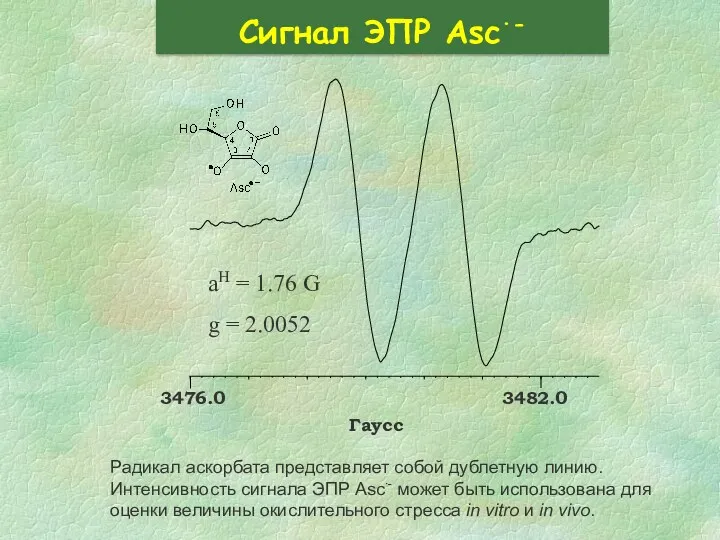
- 31. Сигнал ЭПР Asc∙- Радикал аскорбата представляет собой дублетную линию. Интенсивность сигнала ЭПР Asc∙- может быть использована
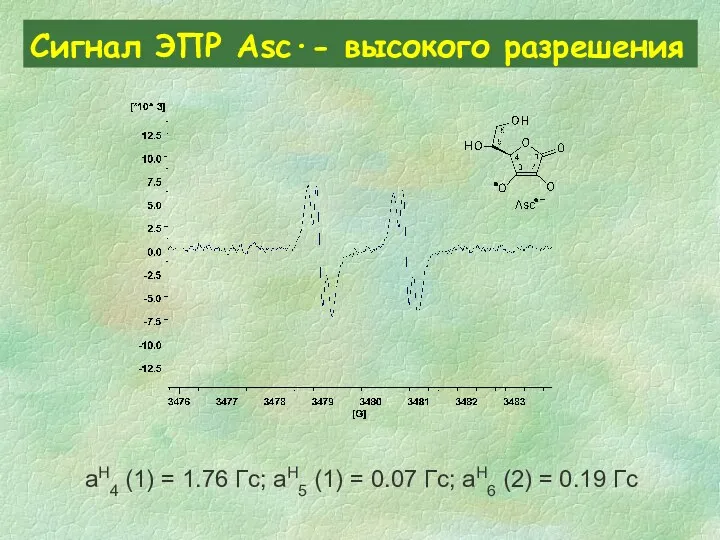
- 32. Сигнал ЭПР Asc∙- высокого разрешения aH4 (1) = 1.76 Гс; aH5 (1) = 0.07 Гс; aH6
- 33. Константы скорости взаимодействия аскорбата с некоторыми радикалами Приведенные константы скорости соответствуют реакции: AscH− + R∙ →
- 34. Asc∙- - маркер окислительного стресса [Asc∙-] – пропорциональна степени окисления аскорбата
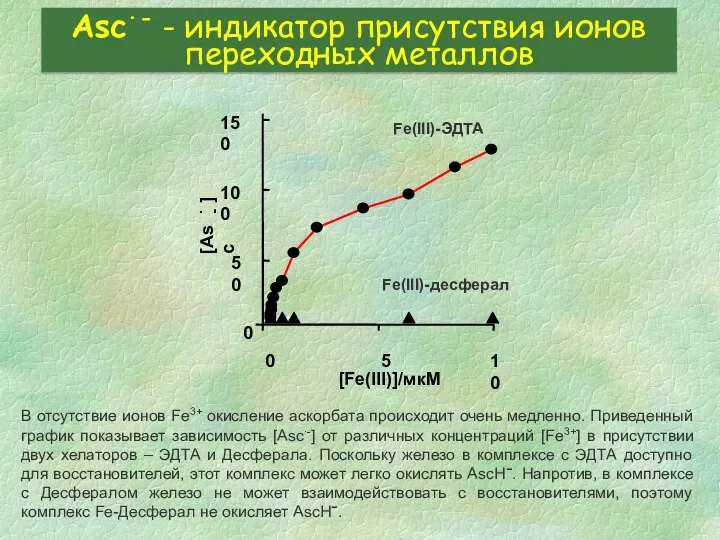
- 35. Asc∙- - индикатор присутствия ионов переходных металлов В отсутствие ионов Fe3+ окисление аскорбата происходит очень медленно.
- 37. Скачать презентацию













![Asc∙- - маркер окислительного стресса [Asc∙-] – пропорциональна степени окисления аскорбата](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/344112/slide-33.jpg)
 Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Алюминий, его амфотерные свойства
Алюминий, его амфотерные свойства Крахмал. Физические свойства
Крахмал. Физические свойства Оксид углерода II. Угарный газ
Оксид углерода II. Угарный газ Нано-порошки. Способы получения нано-порошков
Нано-порошки. Способы получения нано-порошков Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5) Стратегия химической промышленности
Стратегия химической промышленности Своя игра Знаешь ли ты химические элементы?
Своя игра Знаешь ли ты химические элементы? Олимпиадные задачи муниципального этапа по химии
Олимпиадные задачи муниципального этапа по химии Хімічний зв'язок і будова речовини
Хімічний зв'язок і будова речовини Типы химических реакций
Типы химических реакций Виды химической связи
Виды химической связи Теплота горения
Теплота горения Химические свойства альдегидов
Химические свойства альдегидов Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1
Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1 Признаки химических реакций. (Практическая работа 5,4)
Признаки химических реакций. (Практическая работа 5,4) Галогены. Нахождение в природе
Галогены. Нахождение в природе Эквиваленты веществ. Жидкое состояние, растворы
Эквиваленты веществ. Жидкое состояние, растворы Природные источники углеводородов
Природные источники углеводородов Химия элементов VA группы (пниктогены или пникти́ды)
Химия элементов VA группы (пниктогены или пникти́ды) Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Трансформация ионной химической связи в металлическую при восстановлении металлов в комплексных оксидах
Трансформация ионной химической связи в металлическую при восстановлении металлов в комплексных оксидах Бытовая химия
Бытовая химия Химия элементов VIA группы
Химия элементов VIA группы Р-элементы IV группы
Р-элементы IV группы Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Использование информационных технологий при обучении химии
Использование информационных технологий при обучении химии Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7