Трансформация ионной химической связи в металлическую при восстановлении металлов в комплексных оксидах презентация
Содержание
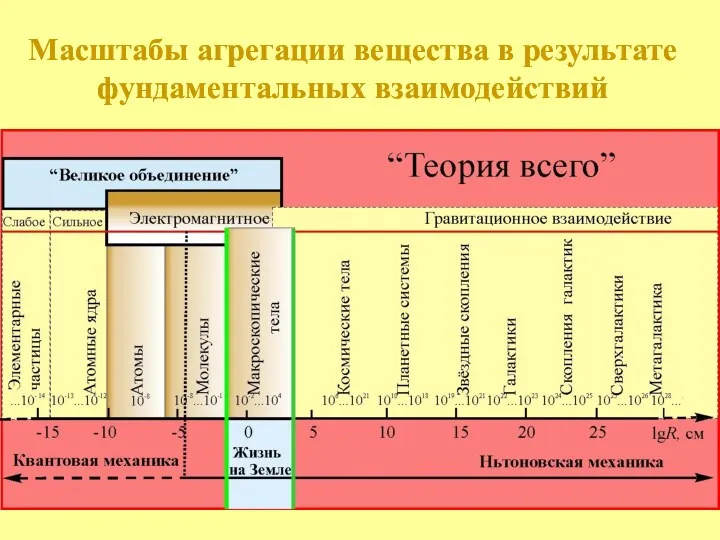
- 2. Масштабы агрегации вещества в результате фундаментальных взаимодействий Ньютоновская механика Квантовая механика Масштабы агрегации вещества в результате
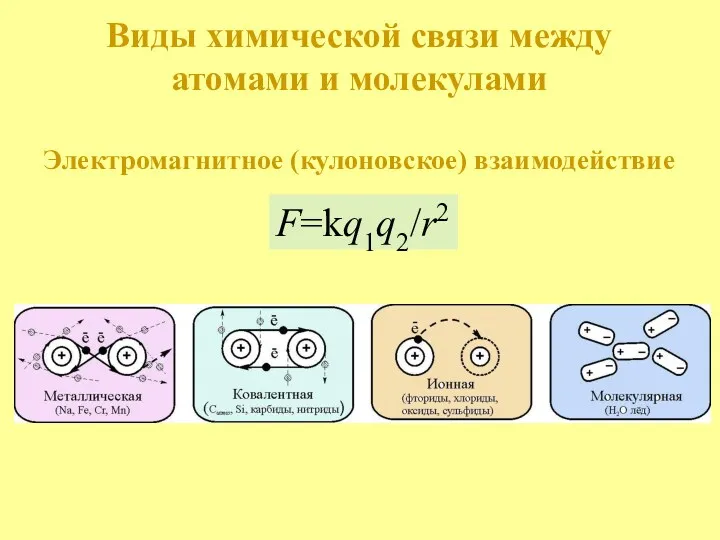
- 3. Виды химической связи между атомами и молекулами Электромагнитное (кулоновское) взаимодействие F=kq1q2/r2
- 4. «Механизм химических процессов может быть понят лишь на основе физических теорий, описывающих движение реагирующих молекул и
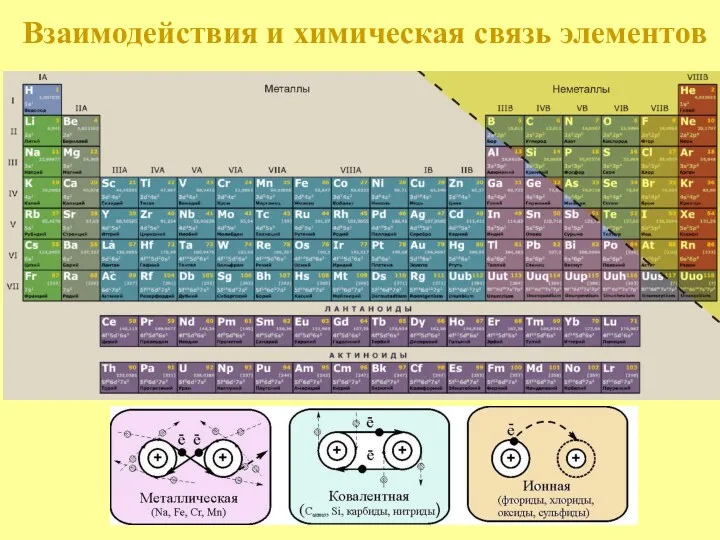
- 5. Взаимодействия и химическая связь элементов
- 6. Время разработки и авторы квантовой механики
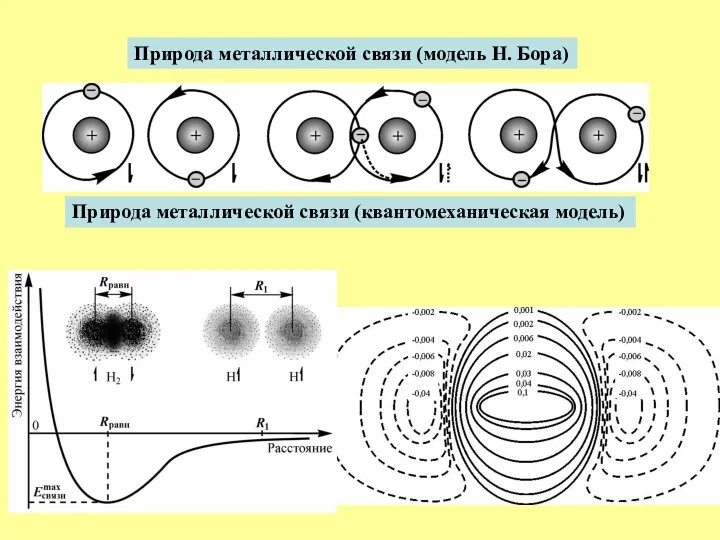
- 7. Природа металлической связи (модель Н. Бора) Природа металлической связи (квантомеханическая модель)
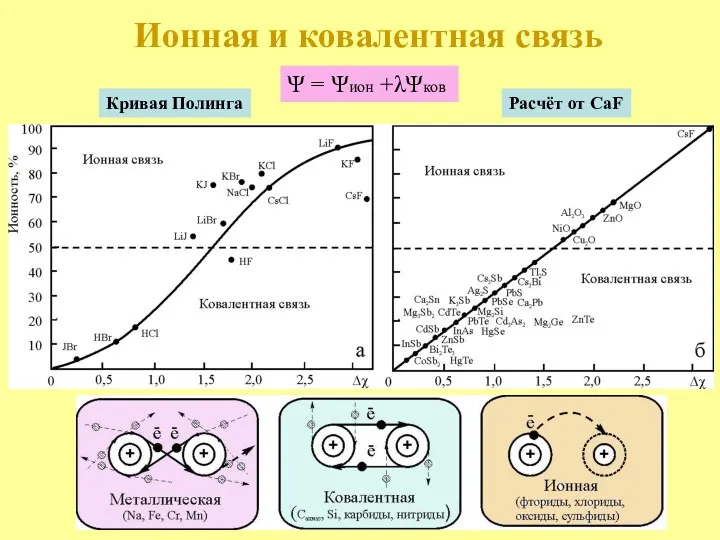
- 8. Ионная и ковалентная связь Кривая Полинга Расчёт от CaF Ψ = Ψион +λΨков
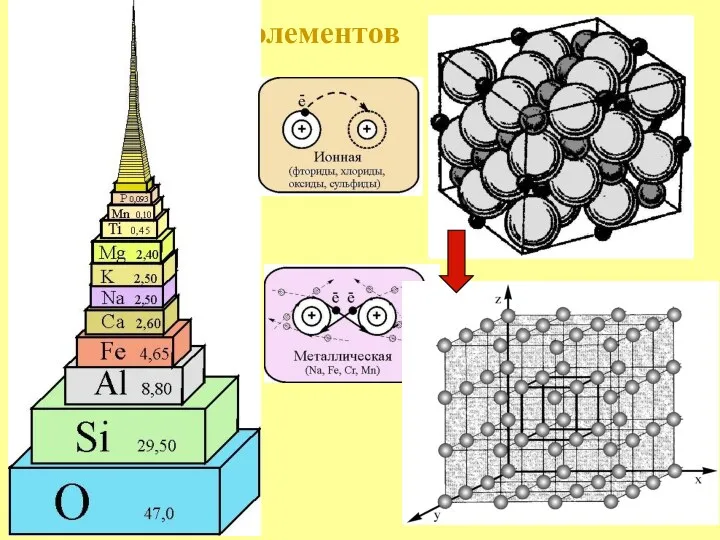
- 9. Кларк элементов
- 10. Кристаллическая решётка шпинели (Mg2m+, Fe2n+)[Fe3x+,Al3y+,Cr3z+]O4: плотнейшая упаковка анионов и множество катионных вакансий а – плотнейшая упаковка
- 11. Окисление и восстановление – это потеря электронов атомом металла с превращением его в катион и возвращение
- 12. В основе теоретических построений лежат два очевидных, но ещё недооцененных принципиальных положения: 1. При твёрдофазном восстановлении
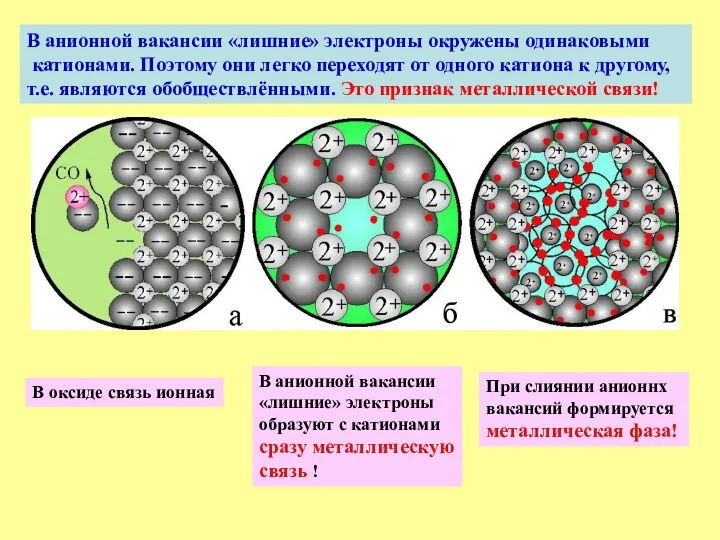
- 13. В анионной вакансии «лишние» электроны окружены одинаковыми катионами. Поэтому они легко переходят от одного катиона к
- 14. Восстановление железа происходит не только в кристаллах шпинели, но и в «пустой» породе Размер частиц железа
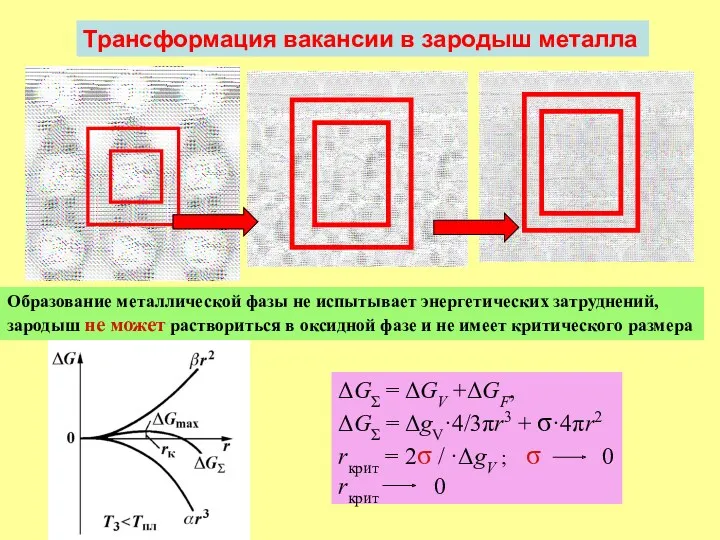
- 15. ΔGΣ = ΔGV +ΔGF, ΔGΣ = ΔgV·4/3πr3 + σ·4πr2 rкрит = 2σ / ·ΔgV ; σ
- 16. При медленном восстановлении формируются идиоморфные кристаллы
- 17. Спектр O Na Mg Al Si K Ca Ti V Mn Fe Ni Спектр 1 0
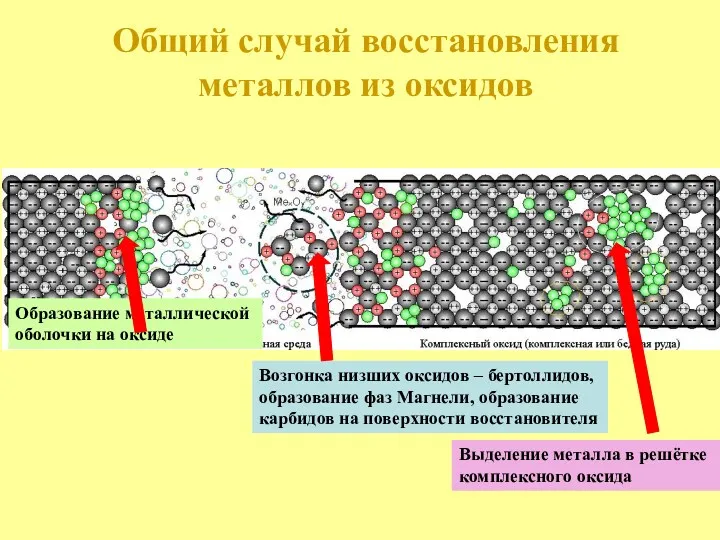
- 18. Образование металлической оболочки на оксиде Возгонка низших оксидов – бертоллидов, образование фаз Магнели, образование карбидов на
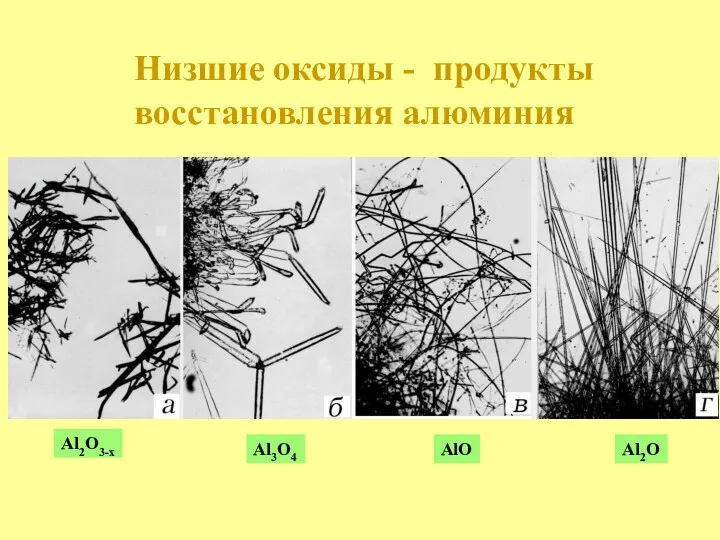
- 19. Al2O3-x Al3O4 AlO Al2O Низшие оксиды - продукты восстановления алюминия
- 20. Перенос оксидов хрома через газовую фазу и образование карбидов на поверхности восстановителя
- 21. Принципиальные положения 1. Суть восстановления металлов заключается в объединении катионов кристаллической решётки оксидов металлической связью путём
- 22. 4. В случае относительно медленного восстановления металлов, например из оксидов, в которых кислород связан с разными,
- 23. 7. Проникновение восстановительного процесса в объём оксида обусловлено не диффузией атомов или ионов, а движением вакансий
- 24. Спасибо за внимание! Рощин Василий Ефимович
- 26. Скачать презентацию


![Кристаллическая решётка шпинели (Mg2m+, Fe2n+)[Fe3x+,Al3y+,Cr3z+]O4: плотнейшая упаковка анионов и множество](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/369663/slide-9.jpg)










 Кислоты. Состав кислот
Кислоты. Состав кислот Реакції йонного обміну. Йонно-молекулярні рівняння
Реакції йонного обміну. Йонно-молекулярні рівняння Амфотерные соединения
Амфотерные соединения Гетероциклические соединения
Гетероциклические соединения Фенолы. Химические свойства и способы получения
Фенолы. Химические свойства и способы получения Chemical Formulas and Nomenclature of compounds
Chemical Formulas and Nomenclature of compounds Товары бытовой химии
Товары бытовой химии Кристаллофизика_часть_1
Кристаллофизика_часть_1 Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма Домашнее задание по теме Химические свойства альдегидов, их получение
Домашнее задание по теме Химические свойства альдегидов, их получение Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов
Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Химические соединения в организме человека
Химические соединения в организме человека Способы и степень дробления
Способы и степень дробления Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Химическая термодинамика
Химическая термодинамика Свойства воды. Оценка качества
Свойства воды. Оценка качества Состав и свойства сжиженного газа. Вопрос №1
Состав и свойства сжиженного газа. Вопрос №1 Химический элемент фосфор
Химический элемент фосфор Углерод и его соединения
Углерод и его соединения Характеристика металу Ферум
Характеристика металу Ферум Separation amp confirmation
Separation amp confirmation Оксиды. Физические свойства
Оксиды. Физические свойства Галогены. Нахождение в природе
Галогены. Нахождение в природе Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Алкины. Гомологический ряд, получение, свойства и применение
Алкины. Гомологический ряд, получение, свойства и применение Биоорганическая химия
Биоорганическая химия