Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов презентация
Содержание
- 2. Принцип минимальной энергии Электроны заполняют орбитали в порядке увеличения их энергии Следовательно, заполняется тот энергетический уровень,
- 3. Напишите электронные конфигурации химических элементов: фосфора и марганца Задание 25 Mn 15 P
- 5. Правило Клечковского (1861 г.) вначале записывается та АО, тот подуровень, тот энергетический уровень, где сумма квантовых
- 6. Задание Напишите электронные конфигурации химических элементов: ванадия и цинка 23 V 30 Zn
- 7. Принцип Паули В атоме не может быть двух электронов, у которых все четыре квантовых числа охарактеризованы
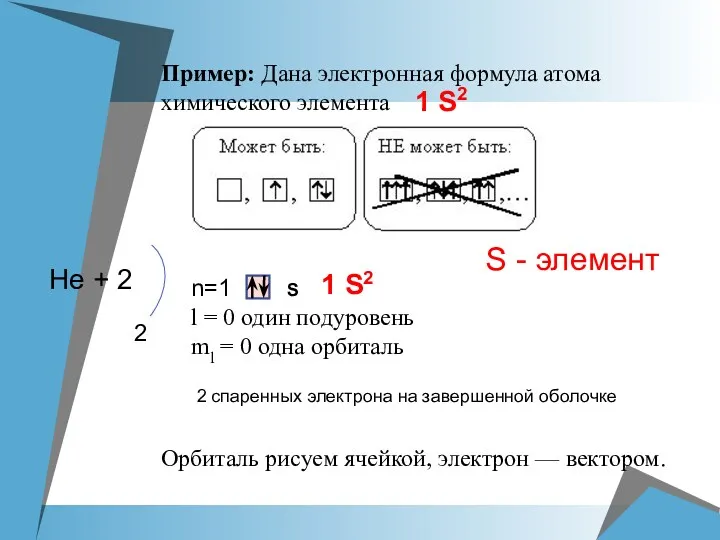
- 8. Нe + 2 2 n=1 l = 0 один подуровень ml = 0 одна орбиталь S
- 9. Правило Хунда (Гунда) При распределении электронов в подуровнях р-, d-, f- следует помнить, что суммарный спин
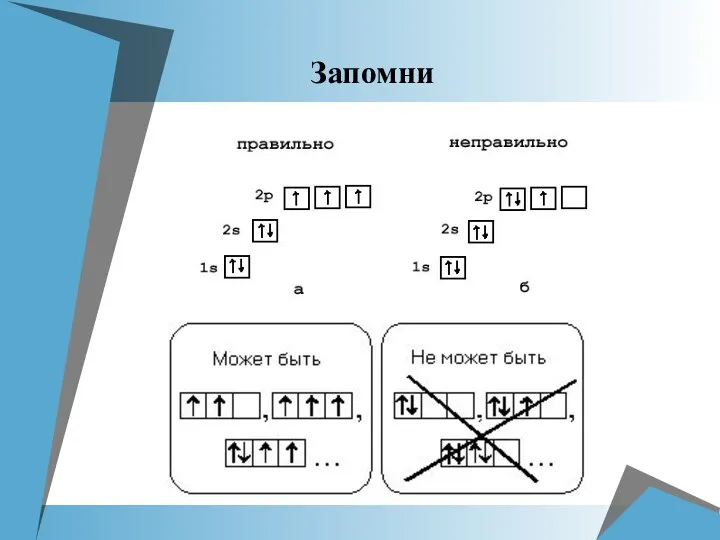
- 10. Запомни
- 11. Проскок электрона — отступления от общей для большинства элементов последовательности заполнения электронных оболочек. Полузаполненные и заполненные
- 13. Выводы Причина сходства элементов заключается в одинаковом строении внешних энергетических уровней их атомов Одинаковое строение внешних
- 14. Домашнее задание Проработать §3-4 Письменно ответить на вопросы 1-5, стр.24
- 15. Рефлексия Я все понял, могу объяснить другому По данной теме у меня остались вопросы Недостаточно понял
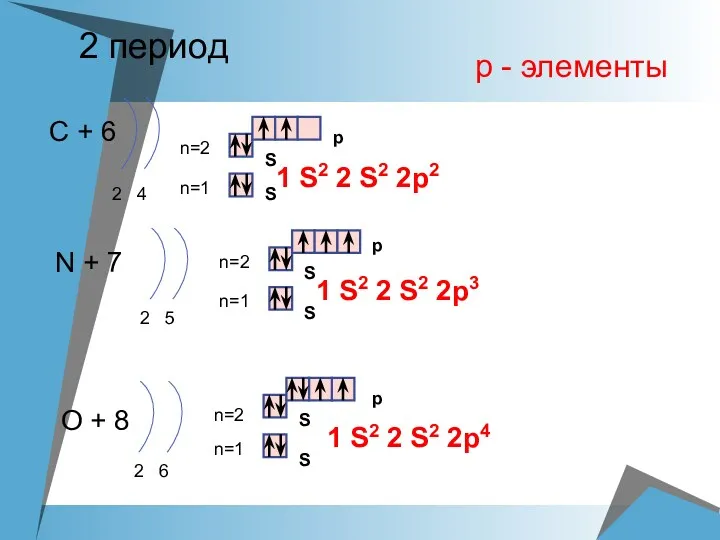
- 16. 2 период С + 6 2 4 n=1 n=2 N + 7 2 5 n=1 n=2
- 18. Скачать презентацию












 Основні закони хімії.Класи та номенклатура неорганічних сполук
Основні закони хімії.Класи та номенклатура неорганічних сполук Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Элементы IV А - группы
Элементы IV А - группы Халькогены
Халькогены Складні білки
Складні білки Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Химические и физические явления в жизни человека
Химические и физические явления в жизни человека Обучение в сотрудничестве на уроках химии
Обучение в сотрудничестве на уроках химии Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Йони. Йонний зв’язок, його утворення
Йони. Йонний зв’язок, його утворення Оценка химической обстановки при авариях на химически опасных объектах. Расчет
Оценка химической обстановки при авариях на химически опасных объектах. Расчет Значение пищи и ее состав
Значение пищи и ее состав Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Соединения железа
Соединения железа Нұсқа талдау
Нұсқа талдау Основы фармацевтической химии
Основы фармацевтической химии Водород. Н2
Водород. Н2 Гидроксид аммония
Гидроксид аммония Кислоты. Состав кислот
Кислоты. Состав кислот Preparation for COP
Preparation for COP ВОДОРОД
ВОДОРОД Получение и применение алканов
Получение и применение алканов Аммиак
Аммиак Объемная доля компонента газовой смеси
Объемная доля компонента газовой смеси Свойства фосфора
Свойства фосфора Химический состав и физические свойства продовольственных товаров
Химический состав и физические свойства продовольственных товаров Фенолдар, аминдер, альдегидтер
Фенолдар, аминдер, альдегидтер Железо. Нахождение в природе. Свойства железа
Железо. Нахождение в природе. Свойства железа