Содержание
- 2. Проектная деятельность Учитель постоянно в поиске методов, приёмов позволяющих заинтересовать ученика, активизировать его познавательную деятельность, сформировать
- 3. И вот опять урок! Чем бы мне заинтересовать ученика сегодня?
- 4. Хочется чтобы было все ново, интересно, современно. Интернет технологии, видеоролики уже не так привлекают внимание
- 5. МЫ ЛЮБИМ КВЕСТЫ Что сейчас модно и актуально ?
- 6. ИДЕЯ
- 7. Игровой квест на уроке химии Учитель химии МОУ «ООШ №39»г.Саратова Бубнова Е.В.
- 8. Квест в реальности — это развлекательная игра для команды из нескольких человек, в специально подготовленном помещении.
- 9. Сюжеты Квестов в реальности могут быть самыми разными, от популярных фильмов и компьютерных игр до совершенно
- 10. По ходу действия от игроков чаще всего потребуется работать в команде, решать логические задачи и применять
- 11. В зависимости от сложности квеста выбираются временные рамки Квест на 1 урок Квест в течении нескольких
- 12. Цель: - вызвать интерес к предмету; -развивать чувство самостоятельности, дисциплинированности, поиска;
- 13. КВЕСТ ХИМИЧЕСКИЕ ЗАПИСИ Петра I
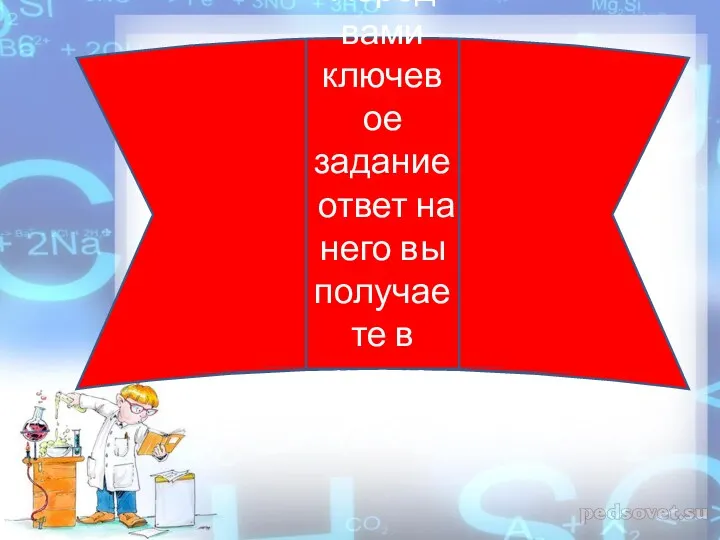
- 14. Перед вами ключевое задание ответ на него вы получаете в конце игры
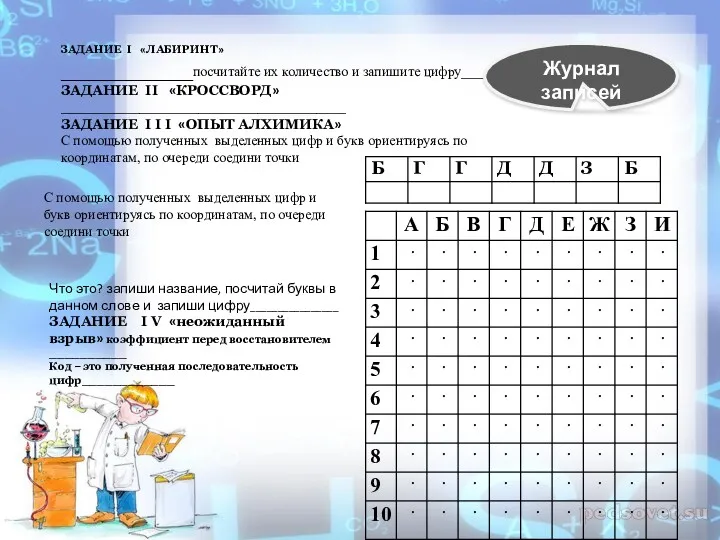
- 16. ЗАДАНИЕ I «ЛАБИРИНТ» ____________посчитайте их количество и запишите цифру_____ ЗАДАНИЕ II «КРОССВОРД» _____________________________ ЗАДАНИЕ I I
- 17. ЗАДАНИЕ I «ЛАБИРИНТ» Вам необходимо найти выход из лабиринта. Следуя по правильному пути нужно собрать формулы
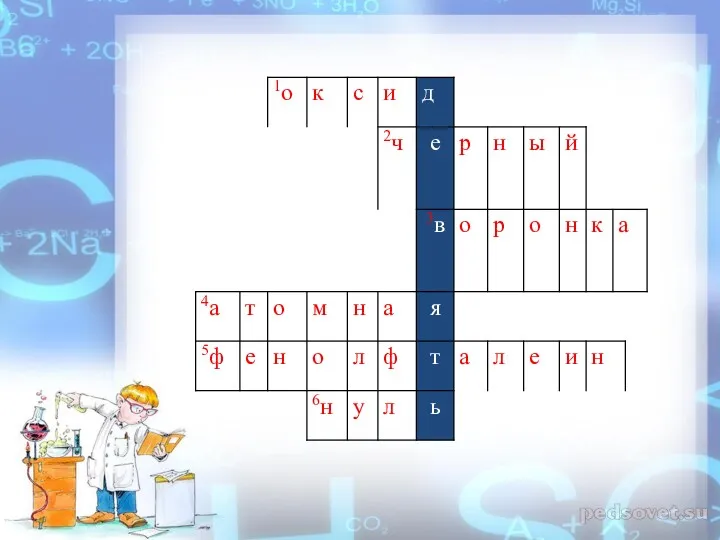
- 18. ЗАДАНИЕ I I «КРОССВОРД» 1)Бинарное соединение химического элемента с кислородом в степени окисления −2? 2)Цвет оксида
- 20. ЗАДАНИЕ I I I «ОПЫТ АЛХИМИКА»
- 21. Установите соответствие между двумя веществами, взятыми в виде водных растворов, и реактивом, с помощью которых можно
- 22. Установите соответствие между двумя веществами, взятыми в виде водных растворов, и реактивом, с помощью которого можно
- 23. ЗАДАНИЕ I I I «ОПЫТ АЛХИМИКА» С помощью полученных выделенных цифр и букв ориентируясь по координатам,
- 24. ЗАДАНИЕ I V «неожиданный взрыв» Студенту было дано задание изучить реакцию взаимодействия солей хлорной кислоты с
- 25. Соли хлорной кислоты « перхлораты» например КClO4 - это совсем другие вещества по составу и по
- 26. КОД ЗАМКА
- 27. Карбонат калия, медь, азот, мочевина, вода
- 28. Литература: «Книга по химии для домашнего чтения» Б.Д.Степин. Л.Ю. Аликберова 2-е издание 1995 год издательство «ХИМИЯ»
- 30. Скачать презентацию
























 Поверхностные явления. Адсорбция. Изотерма Ленгмюра
Поверхностные явления. Адсорбция. Изотерма Ленгмюра Хімічне виробництво сталі
Хімічне виробництво сталі Взаимодействие ускоренных ионов с веществом (часть 1)
Взаимодействие ускоренных ионов с веществом (часть 1) Бұл суреттерді не біріктіреді деп ойлайсыздар?
Бұл суреттерді не біріктіреді деп ойлайсыздар? Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Почему нефть называют черным золотом
Почему нефть называют черным золотом Карбон
Карбон Массовая доля компонента вещества в смеси
Массовая доля компонента вещества в смеси Тірі ағзада жүретін процесстер – физика-химиялық интерпретация
Тірі ағзада жүретін процесстер – физика-химиялық интерпретация Эфирные масла
Эфирные масла Protein and amino acid metabolism
Protein and amino acid metabolism Chemical reactions and heat. (Chapter 1)
Chemical reactions and heat. (Chapter 1) Магний (Mg)
Магний (Mg) Своя игра. Химия. 7 класс
Своя игра. Химия. 7 класс Химические реакции
Химические реакции Школьное мероприятие Д. И. Менделеев в высказываниях
Школьное мероприятие Д. И. Менделеев в высказываниях Механизмы органических реакций
Механизмы органических реакций Р-элементы IV группы
Р-элементы IV группы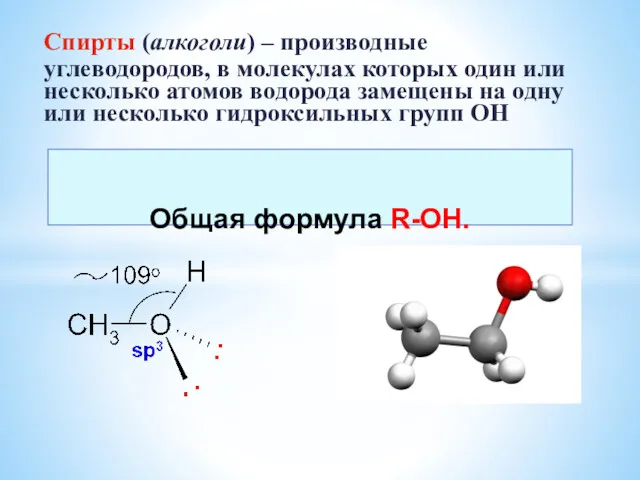 Спирты. Многоатомные спирты
Спирты. Многоатомные спирты Химия в строительстве
Химия в строительстве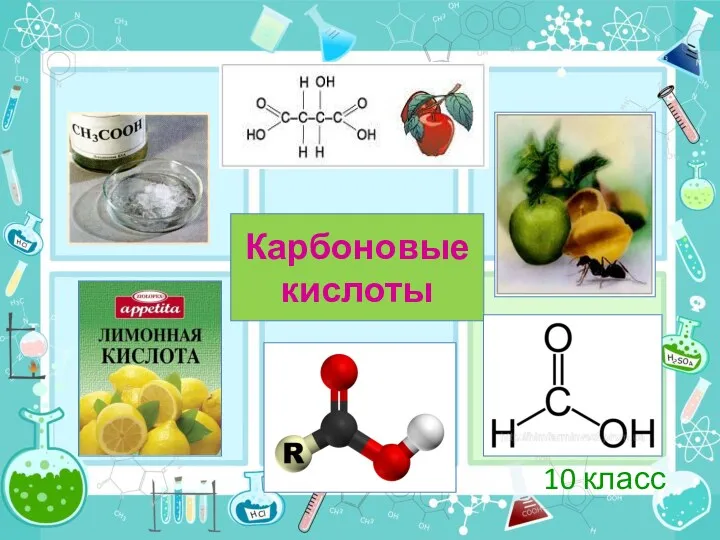 Карбоновые кислоты. (10 класс)
Карбоновые кислоты. (10 класс) 20230306_gidroliz
20230306_gidroliz Романенко
Романенко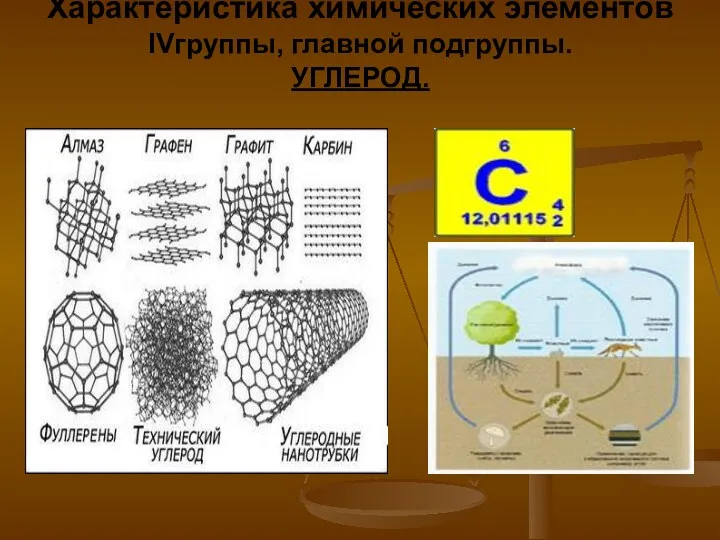 Характеристика химических элементов IV группы, главной подгруппы. Углерод
Характеристика химических элементов IV группы, главной подгруппы. Углерод Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Классификация и свойства кислот
Классификация и свойства кислот Виды мелиорации земель. Химическая реабилитация урбаноземов
Виды мелиорации земель. Химическая реабилитация урбаноземов Железо, его физические и химические свойства
Железо, его физические и химические свойства