Содержание
- 2. ДӘРІС ЖОСПАРЫ Адам термодинамикалық жүйе ретінде. Тірі ағзаның термодинамикалық жүйе ретіндегі ерекшеліктері. Пригожин принципі. Химиялық термодинамиканың
- 3. ТЕРМОДИНАМИКА. НЕІЗГІ ТҮСІНІКТЕРІ. Термодинамика – энергияның бір түрінен екінші түріне ауысуын зерттейтін ғылым, яғни химиялық тұрғыдан
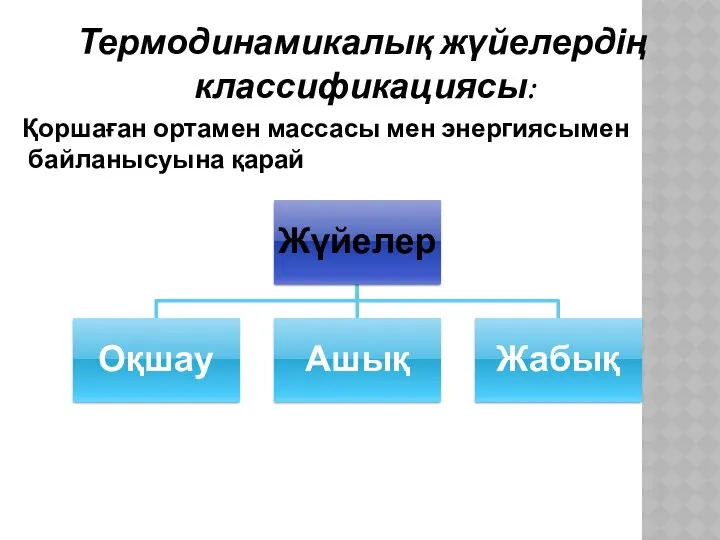
- 4. Термодинамикалық жүйелердің классификациясы: Қоршаған ортамен массасы мен энергиясымен байланысуына қарай
- 5. Интенсивті - термодинамикалық жүйенің өлшеміне тәуелсіз шамалар Температура, қысым, концентрация, жылу сыйымдылық, химиялық потенциал және т.б.
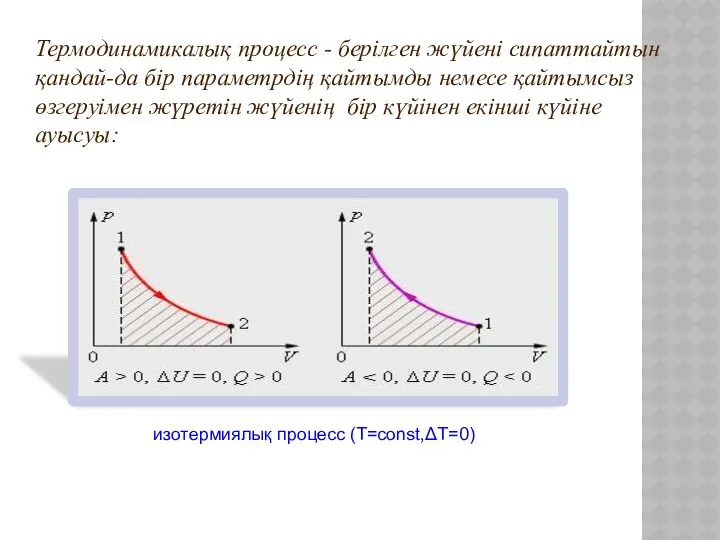
- 6. изохоралық процесс (V=const,ΔV=0) изобаралық процесс (р=const,Δp=0) Термодинамикалық процесс - берілген жүйені сипаттайтын қандай-да бір параметрдің қайтымды
- 7. изотермиялық процесс (Т=const,ΔT=0) Термодинамикалық процесс - берілген жүйені сипаттайтын қандай-да бір параметрдің қайтымды немесе қайтымсыз өзгеруімен
- 8. Ішкі энергия(U) – берілген жүйені құрайтын бөлшектердің қозғалыстары мен өзара әрекеттесулерінің барлық түрлерін қамтитын энергияның толық
- 9. Термодинамиканың бірінші бастамасы (энергияның сақталу және айналу заңы): Термодинамикалық жүйенің бір күйінен екінші күйіне өткенде энергия
- 10. ТЕРМОДИНАМИКАНЫҢ БІРІНШІ БАСТАМАСЫНЫҢ МАТЕМАТИКАЛЫҚ ТЕҢДЕУІ: Q=∆U+A Q - жүйеге берілетін жылу; ∆U-жүйенің ішкі энергиясының өзгерісі; A-термодинамикалық
- 11. Энтальпия - тұрақты қысымдағы жүйенің энергиясы; энтальпия сандық жағынан ішкі энергия U мен потенциалдық энергияның pV
- 12. Энтропия (S)- жүйенің ретсіздіктің сандық өлшемі ретінде термодинамикалық функция болып табылады, ретсіздік артқан сайын жоғарылайды. Энтропия
- 13. Изобаралық-изотермиялық потенциал (Гиббстің бос энергиясы) dG- термодинамикалық жүйенің күй функциясы, қайтымды изотермиялық процесте жүйе атқара алатын
- 14. Изобаралық-изотермиялық жағдайда термодинамикалық процестердің өздігінен жүру критерийлері: Процесс өздігінен жүреді dG 0) Процесс өздігінен жүре алмайды
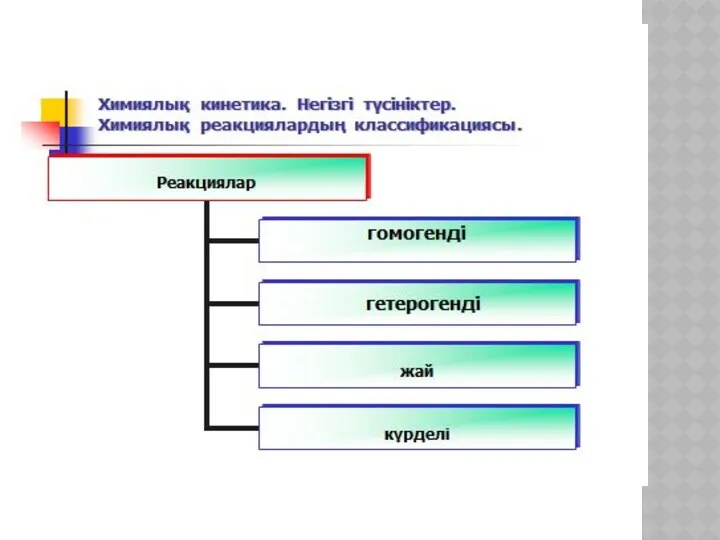
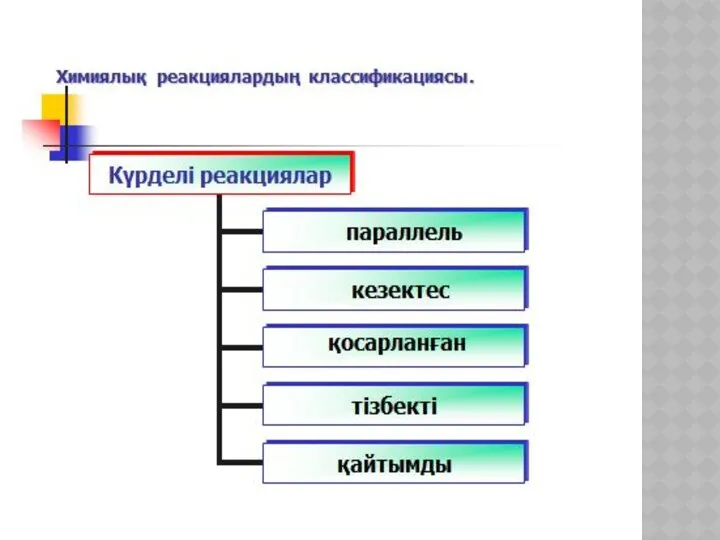
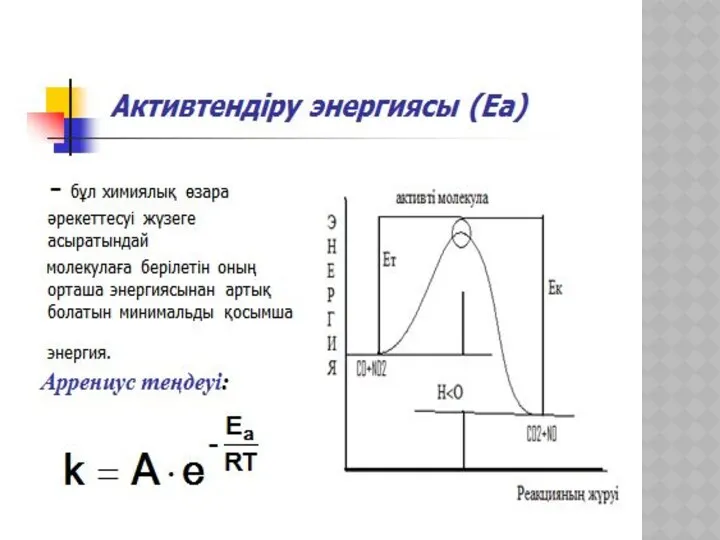
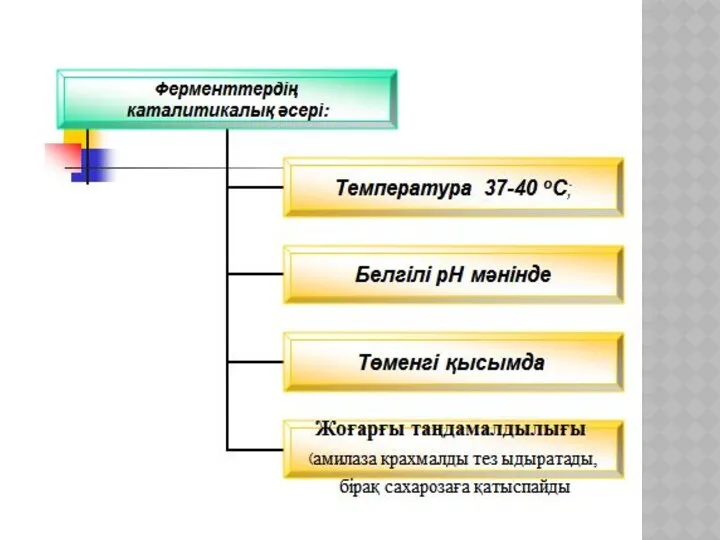
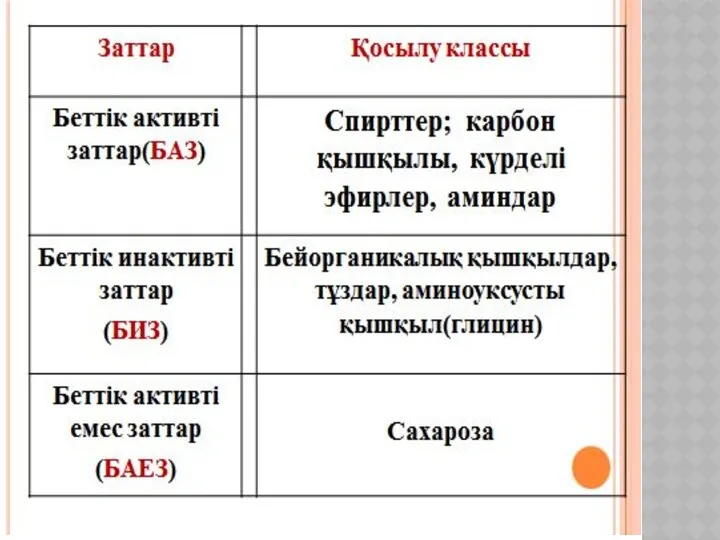
- 19. ХИМИЯЛЫҚ КИНЕТИКА ЖӘНЕ КАТАЛИЗ
- 70. Скачать презентацию

















































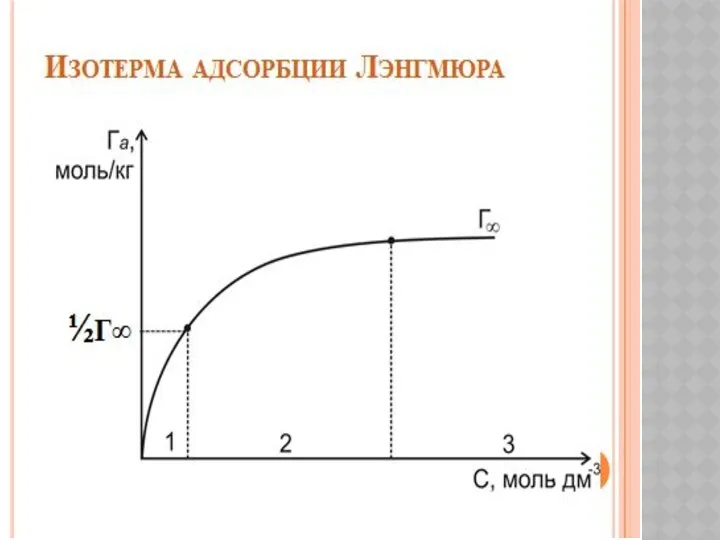

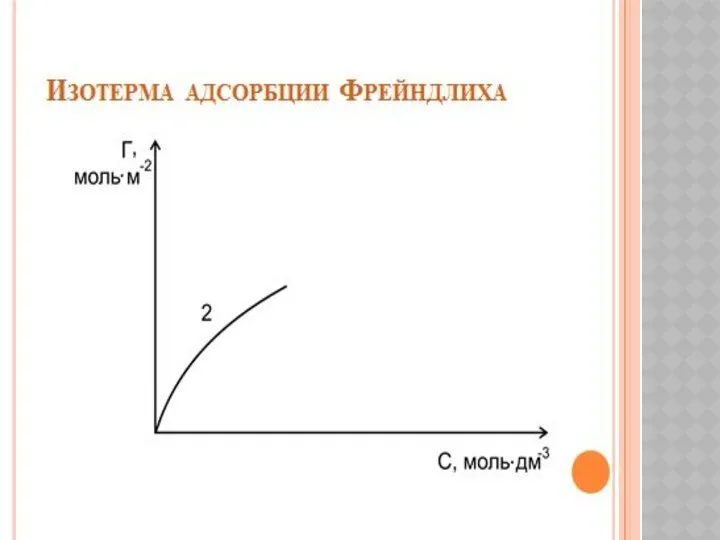

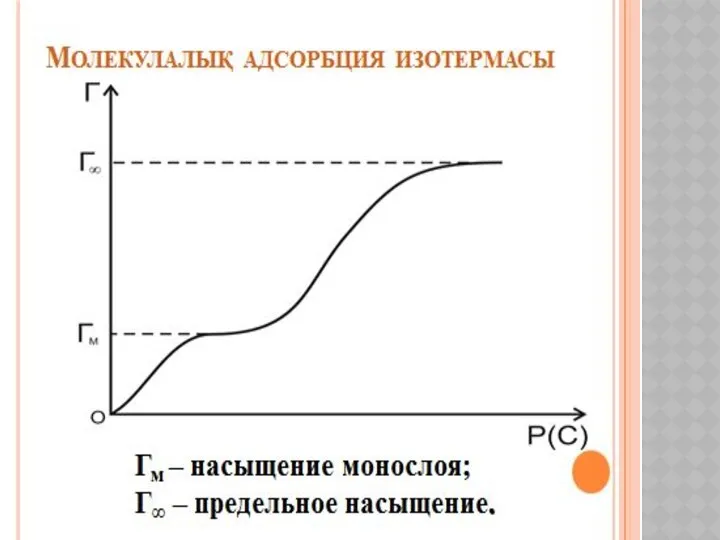

 Металлы и сплавы с высокой удельной прочностью
Металлы и сплавы с высокой удельной прочностью Химическая термодинамика
Химическая термодинамика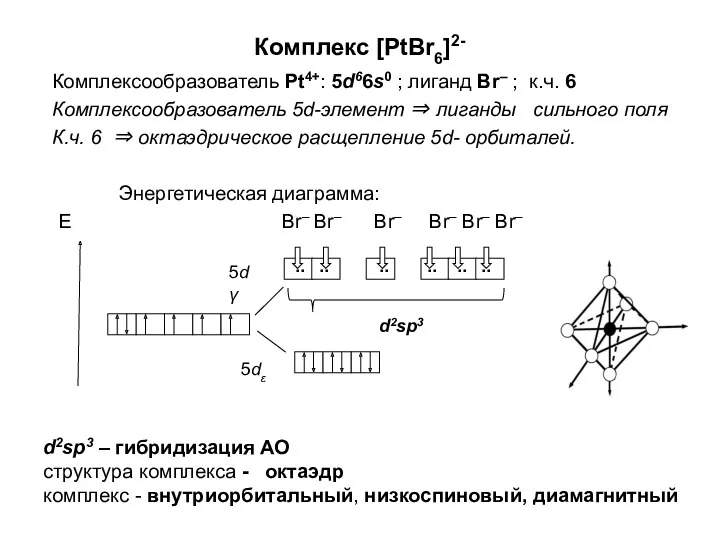 Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5)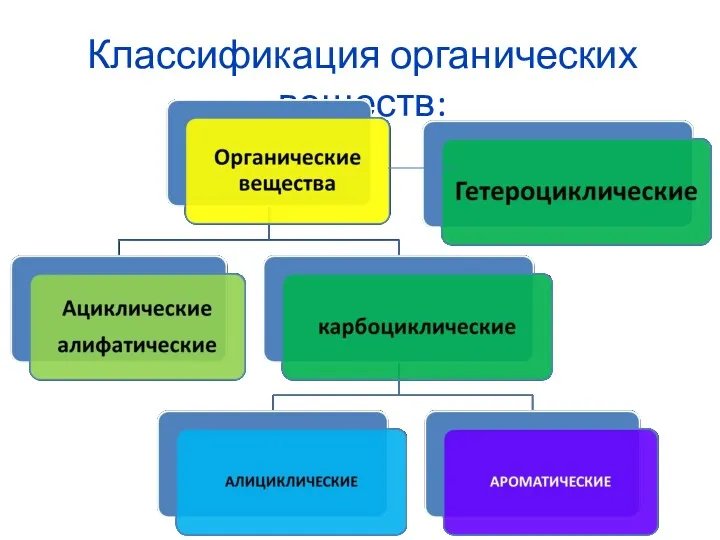 Классификация органических веществ
Классификация органических веществ Сравнительная характеристика галогенов
Сравнительная характеристика галогенов Амин қышқылдар
Амин қышқылдар Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Строение атома
Строение атома Липиды. Классификация липидов
Липиды. Классификация липидов Крахмал. Строение вещества
Крахмал. Строение вещества Значення хімії у житті людини
Значення хімії у житті людини Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Каменный уголь
Каменный уголь Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Бензо́л (C6H6, PhH)
Бензо́л (C6H6, PhH) Поняття про валентність. Ребус
Поняття про валентність. Ребус Текстовые задачи на проценты, смеси и сплавы
Текстовые задачи на проценты, смеси и сплавы Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Природные источники углеводородов
Природные источники углеводородов Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия
Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия Органическая химия
Органическая химия 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Общая характеристика неметаллов
Общая характеристика неметаллов Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений