Содержание
- 2. Халькогены Место в ПС Перечислить Откуда такое название Строение атомов( зарисовать схемы строения 2-3 эл-тов) ,
- 3. Сера Строение атома Возможные степени окисления
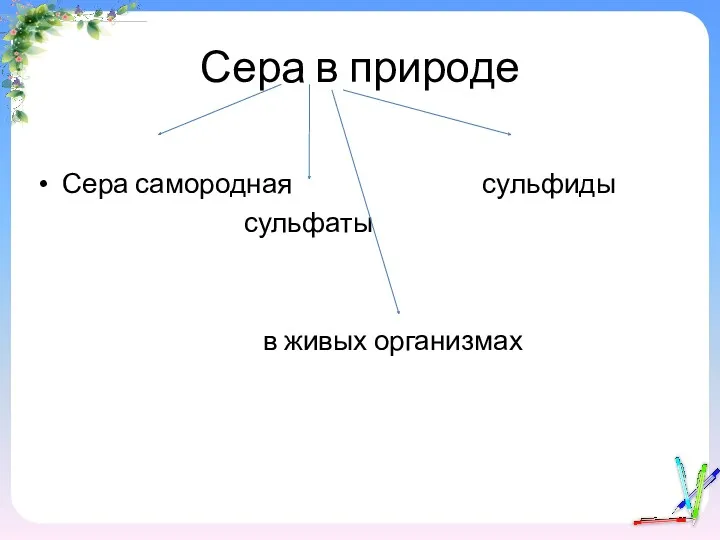
- 4. Сера в природе Сера самородная сульфиды сульфаты в живых организмах
- 5. Нахождение серы в природе Сера является на 16-м месте по распространённости в земной коре. Встречается в
- 6. В виде сульфатов - солей серной кислоты – мирабилит (привести примеры)
- 7. В виде сульфидов (привесмти примеры) Пирит – «огненный камень»
- 8. Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера
- 9. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца
- 10. Физические свойства серы Твёрдое кристаллическое вещество желтого цвета, без запаха Плохо проводит теплоту и не проводит
- 11. Вспомните, что такое Аллотропия (запишите) Составьте таблицу из 3 колонок (см след . слайд)
- 12. Аллотропные модификации серы Ромбическая Моноклинная Пластическая
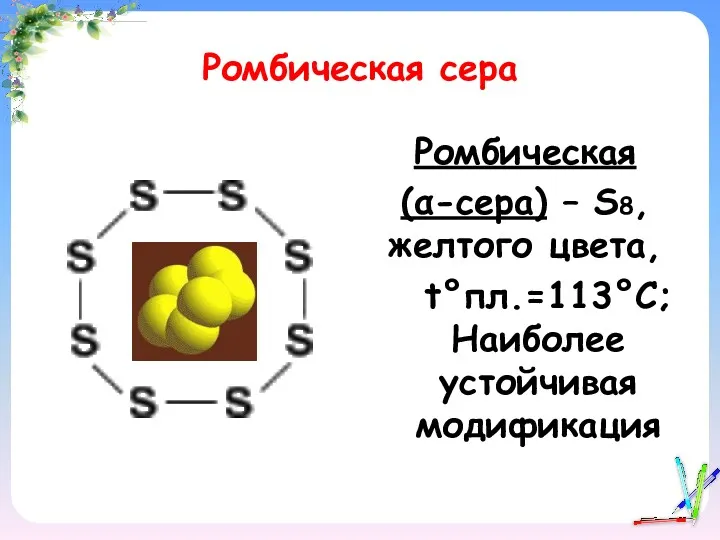
- 13. Ромбическая сера Ромбическая (α-сера) – S8, желтого цвета, t°пл.=113°C; Наиболее устойчивая модификация
- 14. Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые иглы, t°пл. = 119°C; устойчивая при температуре более 96°С;
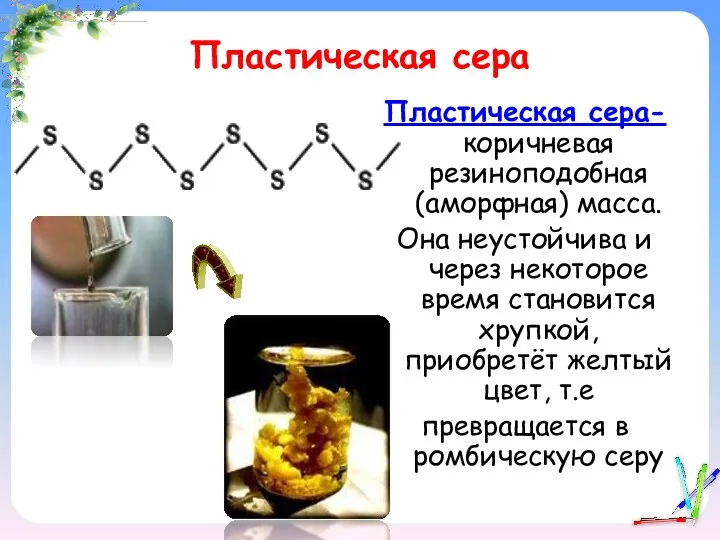
- 15. Пластическая сера Пластическая сера- коричневая резиноподобная (аморфная) масса. Она неустойчива и через некоторое время становится хрупкой,
- 16. Химические свойства серы (разделить на 2 колонки) Сера-восстановитель (см след слайды) Сера-окислитель
- 17. Химические свойства серы (восстановительные) Сера проявляет в реакциях с сильными окислителями: S - 2ē → S+2;
- 18. Химические свойства серы (окислительные) S0 + 2ē → S-2 4) Сера реагирует со щелочными металлами без
- 20. Скачать презентацию














 Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Химия в организме человека
Химия в организме человека Теплота горения
Теплота горения Germaniy gruppachasining elementlarining olinishi va xossalari
Germaniy gruppachasining elementlarining olinishi va xossalari Технологическая установка Л 24-6
Технологическая установка Л 24-6 Резина и её свойства . Полимеры и их использование
Резина и её свойства . Полимеры и их использование Амінокислоти
Амінокислоти Химический состав и физические свойства продовольственных товаров
Химический состав и физические свойства продовольственных товаров Алифатические углеводороды: алканы, алкены, алкины
Алифатические углеводороды: алканы, алкены, алкины Гидролиз солей
Гидролиз солей Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов Лекция 1. Введение в биоорганическую химию
Лекция 1. Введение в биоорганическую химию Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Химический элемент кремний
Химический элемент кремний Альдегиды и кетоны
Альдегиды и кетоны Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение
Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение Гетероциклические соединения. Шестичленные гетероциклы с одним гетероатомом
Гетероциклические соединения. Шестичленные гетероциклы с одним гетероатомом Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Organic chemistry. Alcohols
Organic chemistry. Alcohols Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах Фазовые равновесия в системе ограниченно смешивающихся жидкостей
Фазовые равновесия в системе ограниченно смешивающихся жидкостей Гидролиз солей
Гидролиз солей Химия 8 класс. Введение в химию
Химия 8 класс. Введение в химию Органические вещества
Органические вещества Физические свойства минералов
Физические свойства минералов Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота