Содержание
- 2. В чистом виде кремний был выделен в 1811 году французскими учеными Жозеф Луи Гей-Люссак Луи Жаком
- 3. 1. ПОЛОЖЕНИЕ В ПСХЭ. ОСОБЕННОСТИ СТРОЕНИЯ АТОМА Положение в ПС: период III; группа IV, главная; Относительная
- 4. Второй после кислорода ¼ состава земной коры Наиболее распространен SiO2 кремнезем Главная часть земной коры –
- 5. Белая глина Al2O3*2SiO2*2H2O Слюда K2O*Al2O3*6SiO2 Полевой шпат K2O*Al2O3*6SiO2*H2O Многие природные силикаты – драгоценные камни (аквамарин, изумруд,
- 6. Al2[SiO4](F,OH)2 Be3Al2Si6O18 Be3Al2Si6O18
- 8. 3. ФИЗИЧЕСКИЕ СВОЙСТВА. Кремний – кристаллическое вещество темно-серого цвета с металлическим блеском. кристаллическая решетка кремния напоминает
- 9. 4. ПОЛУЧЕНИЕ. В промышленности кремний получают восстановлением кремнезема SiO2 коксом в электрических печах при 1500-17000С: SiO2
- 10. Si0 - 4е восстановитель + 4е окислитель Si+4 Si-4 Кремний, отдавая все внешние электроны более ЭО
- 11. 5. ХИМИЧЕСКИЕ СВОЙСТВА. Восстановительные 1) Si + O2 =SiO2 2) Si + 2CL2 = SiCL4 3)
- 12. 6. СОЕДИНЕНИЯ КРЕМНИЯ
- 13. 6.1. ОКСИДЫ КРЕМНИЯ И УГЛЕРОДА
- 14. 6.2. КИСЛОТЫ
- 15. 6.3. СОЛИ A3B2[SiO4]3 , где A – кальций, магний, железо(II) ; B – алюминий, хром, железо(III)
- 16. Стекло Цемент Кирпич Фарфор Фаянс Клей Силикон Асбест Гранит Керамика 7. ПРИМЕНЕНИЕ. В БЫТУ.
- 17. 7. ПРИМЕНЕНИЕ. КРЕМНИЙ - ПОЛУПРОВОДНИК
- 18. 7. ПРИМЕНЕНИЕ. В МЕДИЦИНЕ.
- 19. Важнейшее соединение кремния – SiO2 необходим для жизни растений и животных. Благодаря ему тростники, камыши и
- 20. Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезем.
- 21. Кремний придаёт гладкость и прочность костям и кровеносным сосудам человека. В организме человека кремния менее 0,01%
- 23. Скачать презентацию




2 Be3Al2Si6O18 Be3Al2Si6O18](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/103436/slide-5.jpg)








![6.3. СОЛИ A3B2[SiO4]3 , где A – кальций, магний, железо(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/103436/slide-14.jpg)






 Методы очистки нефтяных фракций
Методы очистки нефтяных фракций Жуғыш заттар және жуғыш әсері. 2 Лекция
Жуғыш заттар және жуғыш әсері. 2 Лекция Биохимия
Биохимия Целлюлоза
Целлюлоза Гигиена особенности при использовании средств бытовой химии и полимеров
Гигиена особенности при использовании средств бытовой химии и полимеров Сера — представитель VIA-группы. Аллотропия серы. Свойства и применение
Сера — представитель VIA-группы. Аллотропия серы. Свойства и применение Физические и химические свойства воды
Физические и химические свойства воды Теория электролитической диссоциации
Теория электролитической диссоциации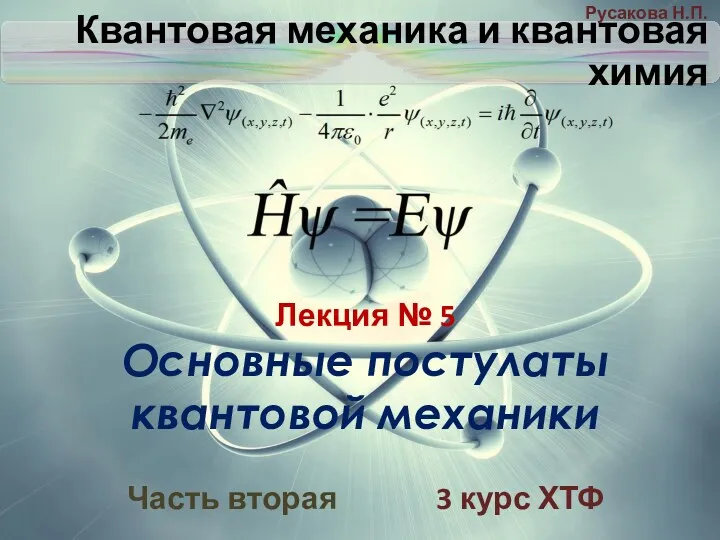 Основные постулаты квантовой механики
Основные постулаты квантовой механики Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Химия в повседневной жизни человека
Химия в повседневной жизни человека Капиллярная конденсация
Капиллярная конденсация Синтез олиголактозаминов – лигандов галектинов
Синтез олиголактозаминов – лигандов галектинов Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Именные реакции в органической химии
Именные реакции в органической химии Тайна мыльного пузыря
Тайна мыльного пузыря Лекция 6. Растворы электролитов
Лекция 6. Растворы электролитов Цинк
Цинк Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Химическое равновесие и условия его смещения
Химическое равновесие и условия его смещения Процесс оксихлорирования
Процесс оксихлорирования Металдардыњ механикалыќ ќасиеттері-алюминий
Металдардыњ механикалыќ ќасиеттері-алюминий Атом. Будова атома
Атом. Будова атома Каталитический риформинг
Каталитический риформинг Карбоновые кислоты
Карбоновые кислоты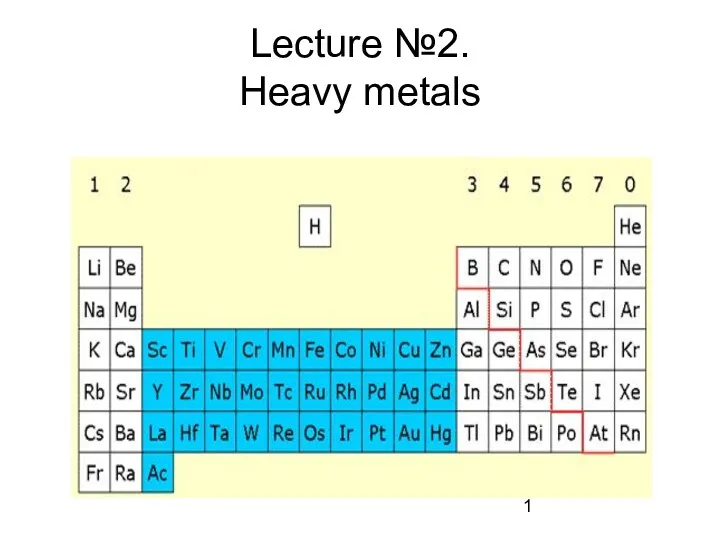 Heavy metals
Heavy metals Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Скорость химических реакций
Скорость химических реакций