Содержание
- 2. их растворы или расплавы ПРОВОДЯТ электрический ток их растворы или расплавы НЕ ПРОВОДЯТ электрический ток Вид
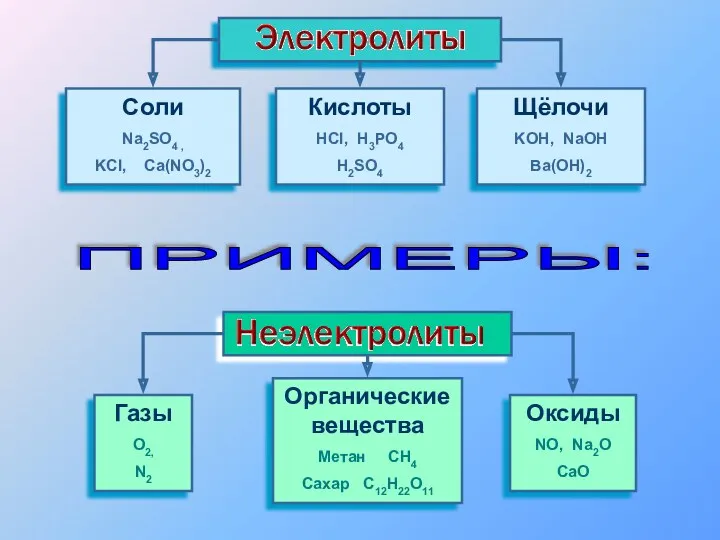
- 3. Cоли Na2SO4 , KCl, Ca(NO3)2 Кислоты HCl, H3PO4 H2SO4 Щёлочи KOH, NaOH Ba(OH)2 Газы O2, N2
- 4. Процесс появления гидратированных ионов в водном растворе называется электролитической диссоциацией (С. Аррениус, 1887 г.) . процесс
- 5. Современная теория электролитической диссоциации (ТЭД)
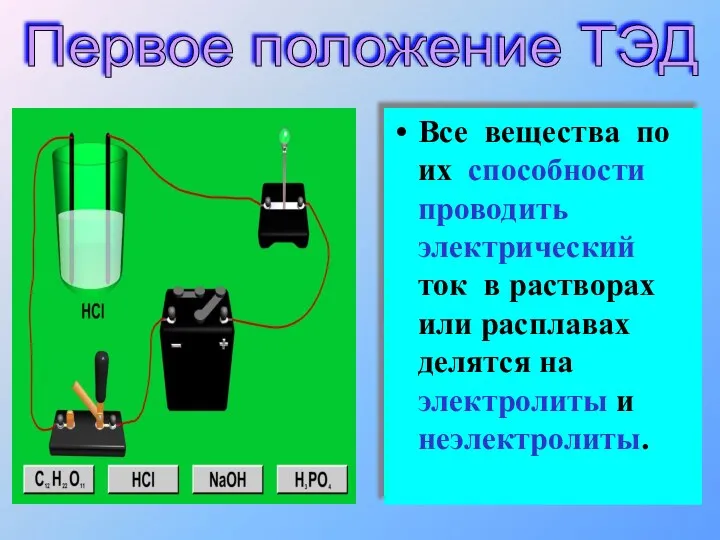
- 6. Все вещества по их способности проводить электрический ток в растворах или расплавах делятся на электролиты и
- 7. В растворах электролиты диссоциируют ( распадаются) на положительные и отрицательные ионы. Процесс распада электролита на ионы
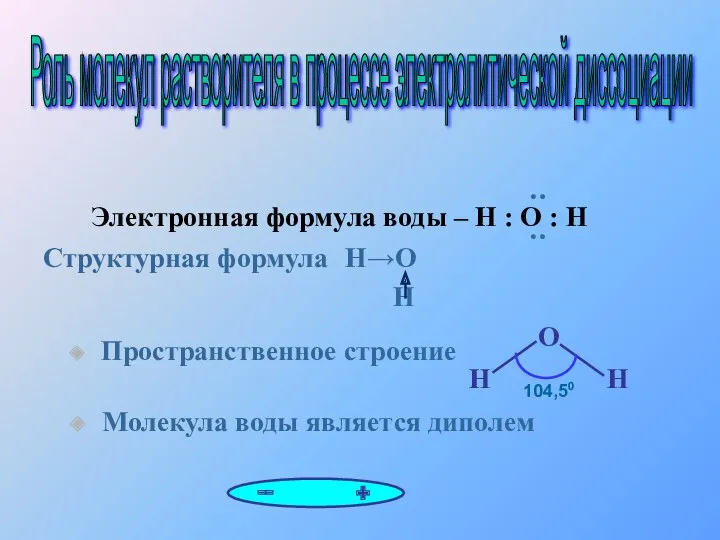
- 8. Молекула воды является диполем Электронная формула воды – Н : О : Н Пространственное строение Структурная
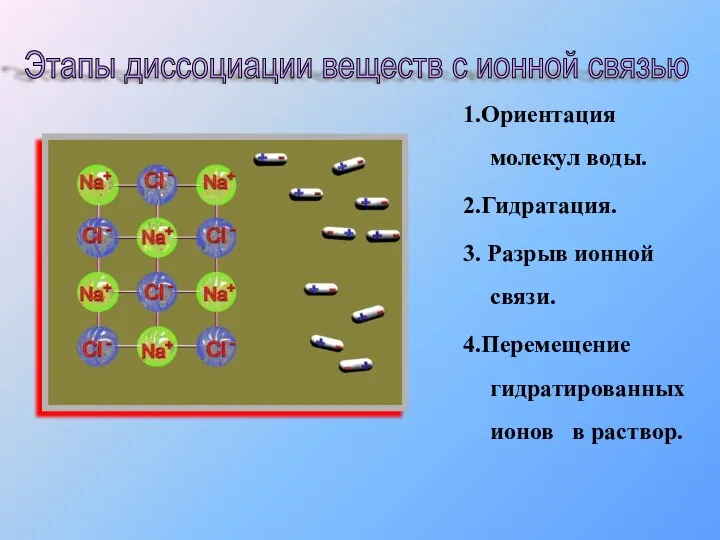
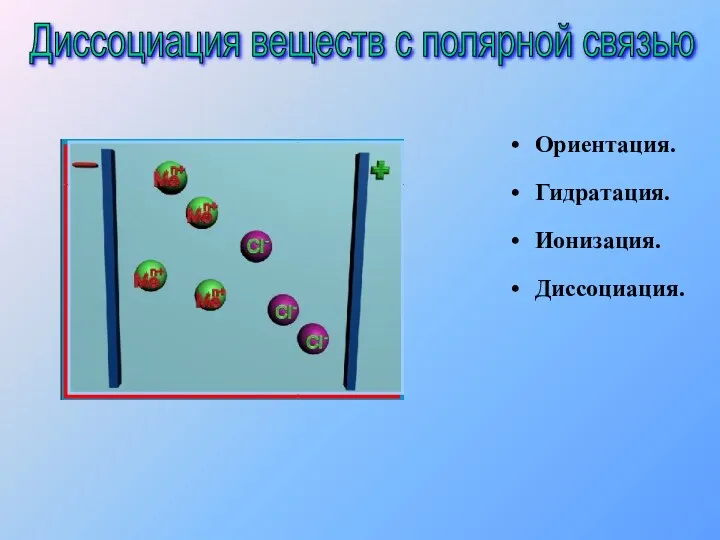
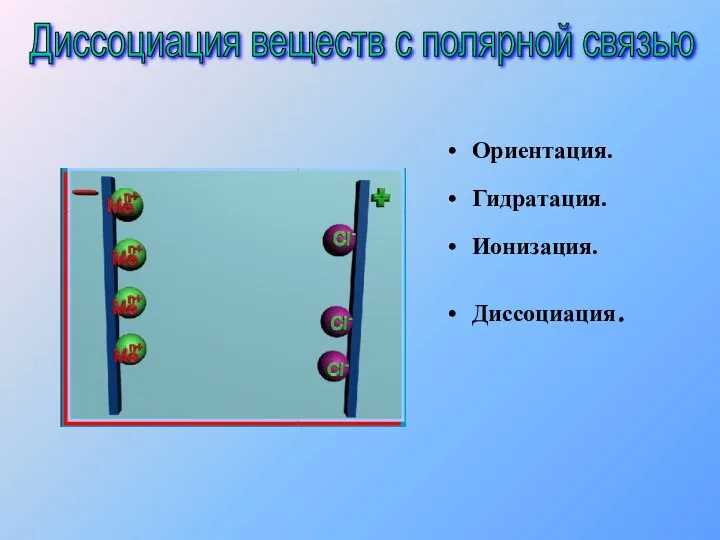
- 9. 1.Ориентация молекул воды. 2.Гидратация. 3. Разрыв ионной связи. 4.Перемещение гидратированных ионов в раствор. Этапы диссоциации веществ
- 10. Ориентация молекул воды. Гидратация. Перемещение гидратиро- ванных ионов в раствор. Диссоциация веществ с ионной связью
- 11. Ориентация. Гидратация. Ионизация. Диссоциация. Диссоциация веществ с полярной связью
- 12. Ориентация. Гидратация. Ионизация. Диссоциация. Диссоциация веществ с полярной связью
- 13. Ориентация. Гидратация. Ионизация. Диссоциация. Диссоциация веществ с полярной связью
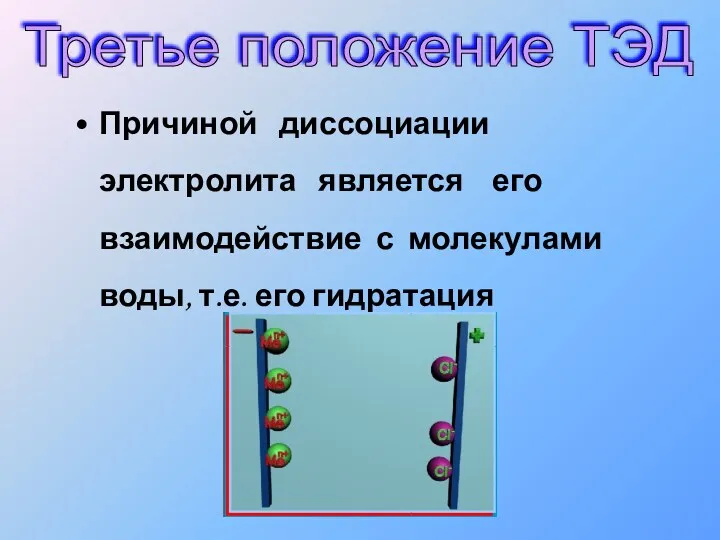
- 14. Причиной диссоциации электролита является его взаимодействие с молекулами воды, т.е. его гидратация Третье положение ТЭД
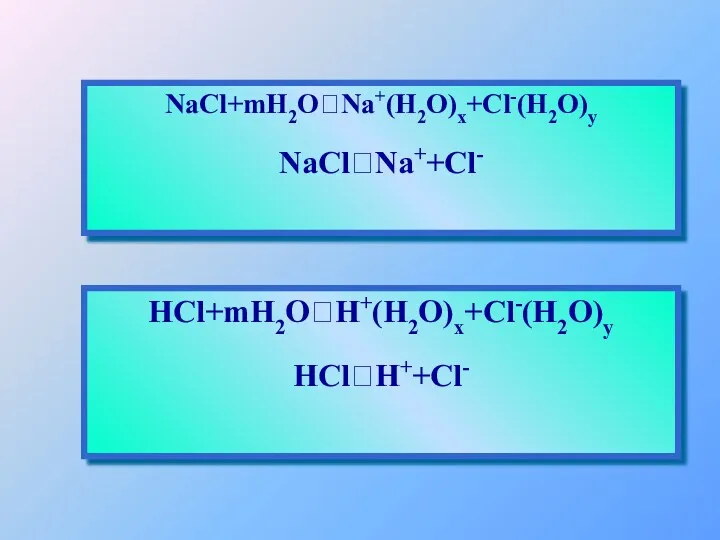
- 15. HCl+mH2O⮀H+(H2O)x+Cl-(H2O)y HCl⮀H++Cl- NaCl+mH2O⮀Na+(H2O)x+Cl-(H2O)y NaCl⮀Na++Cl-
- 16. С точки зрения ТЭД, кислотами называются электролиты, которые в водном растворе диссоциируют на ионы водорода и
- 17. HCl = H+ + Cl- HNO3 = H+ + NO3- HClO4 = H+ + ClO4- Кислоты
- 18. Na2SO4 = 2Na+ + SO42- AlCl3 = Al3+ + 3Cl- Fe2(SO4)3 = 2Fe3+ + 3SO42- С
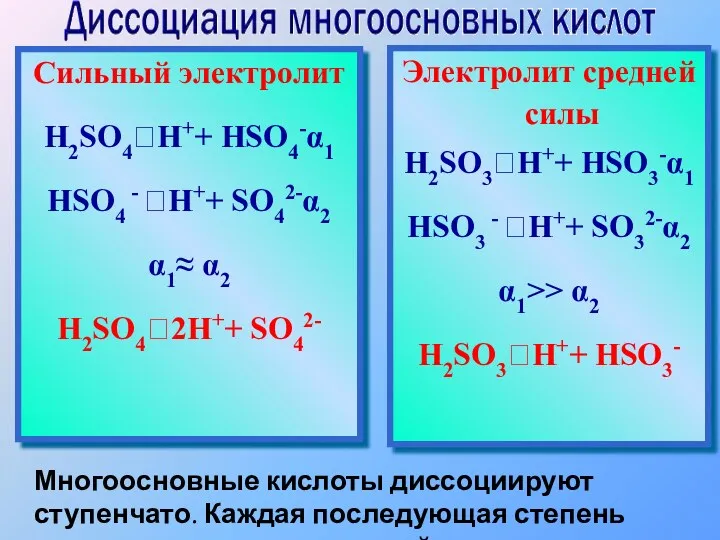
- 19. Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей. Сильный электролит H2SO4⮀H++ HSO4-α1 HSO4 -
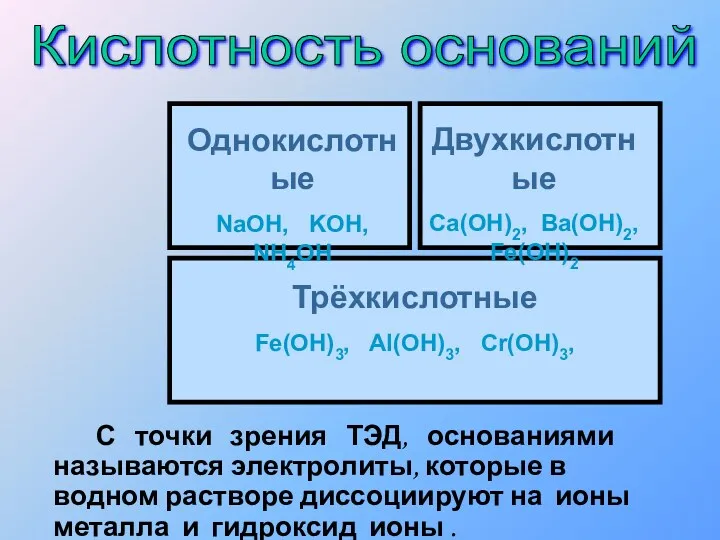
- 20. С точки зрения ТЭД, основаниями называются электролиты, которые в водном растворе диссоциируют на ионы металла и
- 21. NaOH = Na+ + OH- Ba(OH)2 = BaOH+ + OH- → Ba2+ + 2OH- KOH =
- 22. Соли – это электролиты, которые диссоциируют на катионы металла или аммония NH4+ и анионы кислотных остатков.
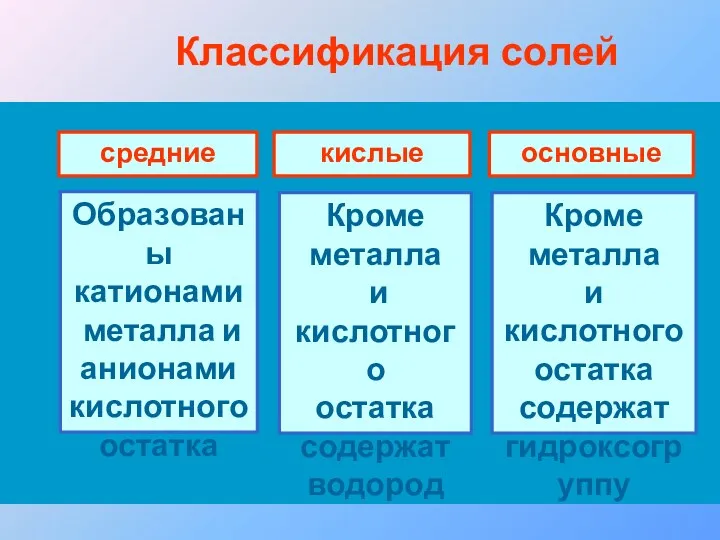
- 23. Классификация солей средние кислые основные Образованы катионами металла и анионами кислотного остатка Кроме металла и кислотного
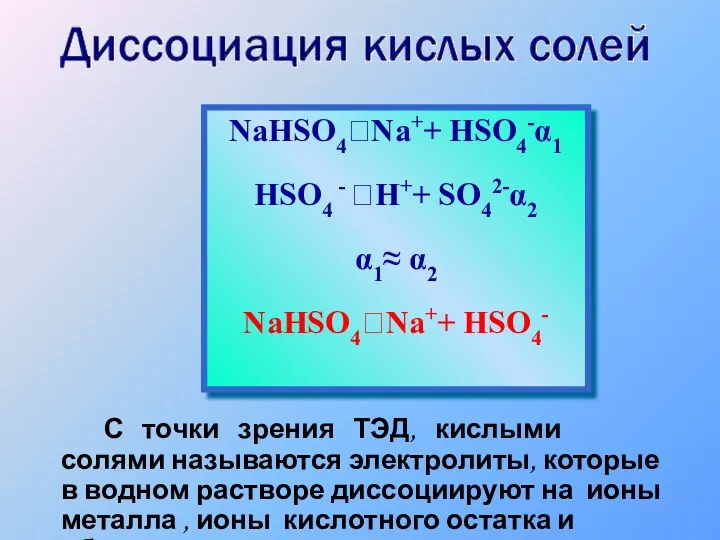
- 24. С точки зрения ТЭД, кислыми солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
- 25. Под действием тока положительные ионы движутся к катоду и называются катионы, а отрицательные – к аноду
- 26. С точки зрения ТЭД, основными солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
- 27. Не все электролиты в одинаковой мере диссоциируют на ионы КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ Пятое положение ТЭД
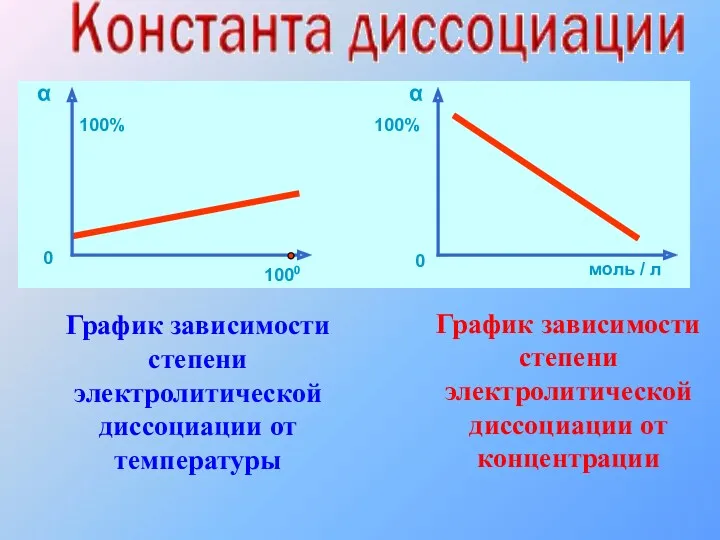
- 28. График зависимости степени электролитической диссоциации от температуры График зависимости степени электролитической диссоциации от концентрации
- 29. Сильные электролиты α > 30% Средние водорастворимые соли NaCl, K2SO4, Ba(NO3)2 итд; Гидроксиды щелочных и щелочноземельных
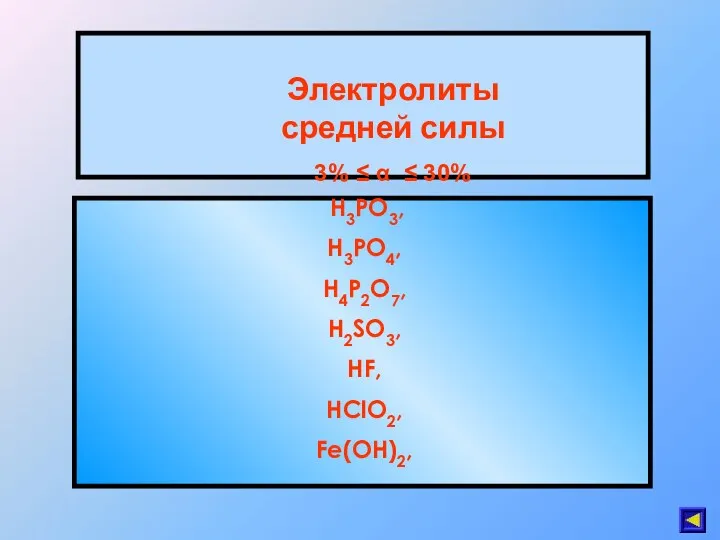
- 30. Электролиты средней силы 3% ≤ α ≤ 30% H3PO3, H3PO4, H4P2O7, H2SO3, HF, HClO2, Fe(OH)2,
- 31. Слабые электролиты α Органические кислоты: HCOOH, CH3COOH, C2H5COOH Минеральные кислоты: HNO2, HClO, H2CO3, H2SiO3, H3BO3, H3PO3,
- 32. Свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации. Шестое положение ТЭД
- 33. Реакции в растворах электролитов протекают до конца если: Образуется или растворяется осадок; Выделяется газ; Образуется малодиссоциирующее
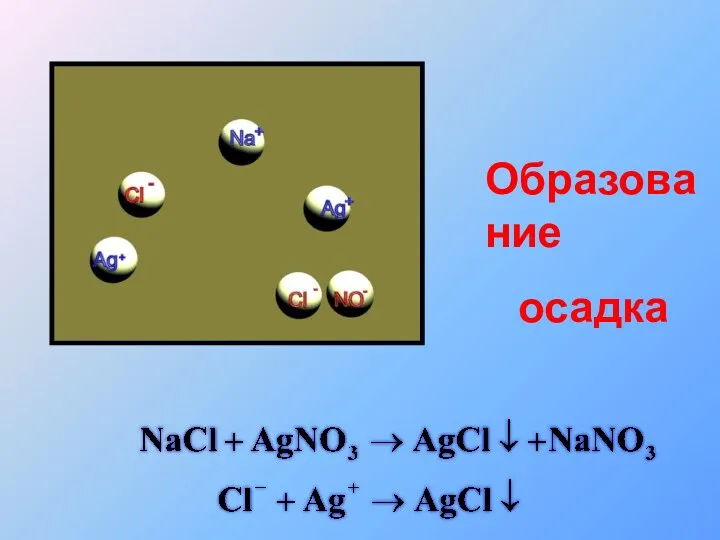
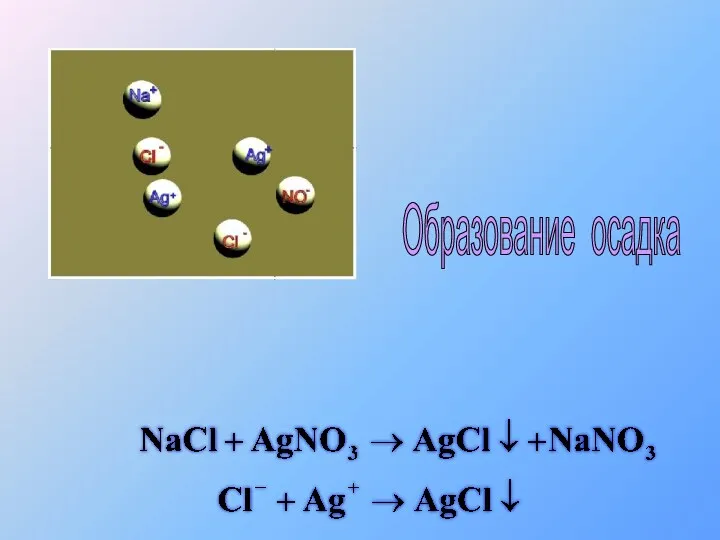
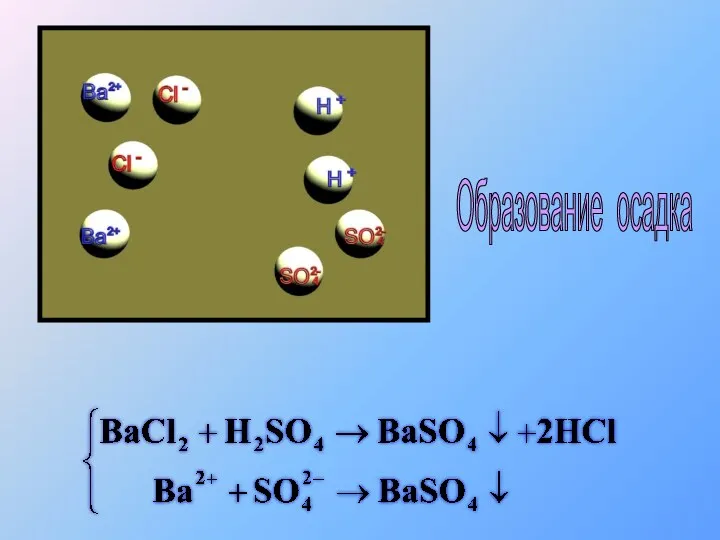
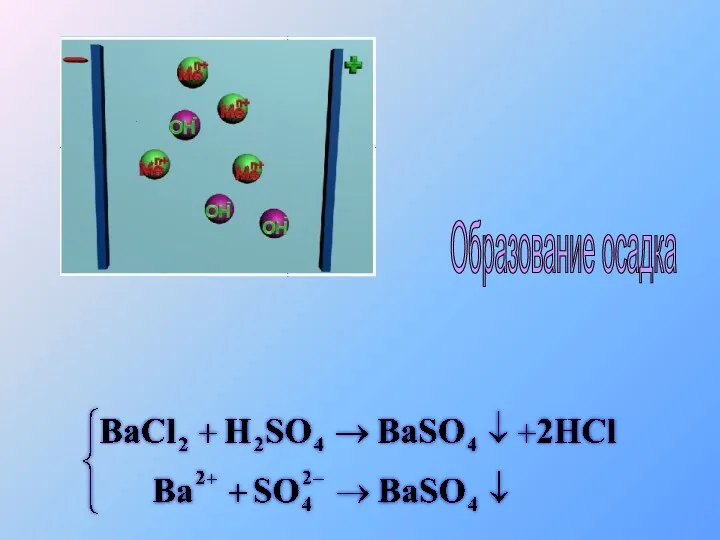
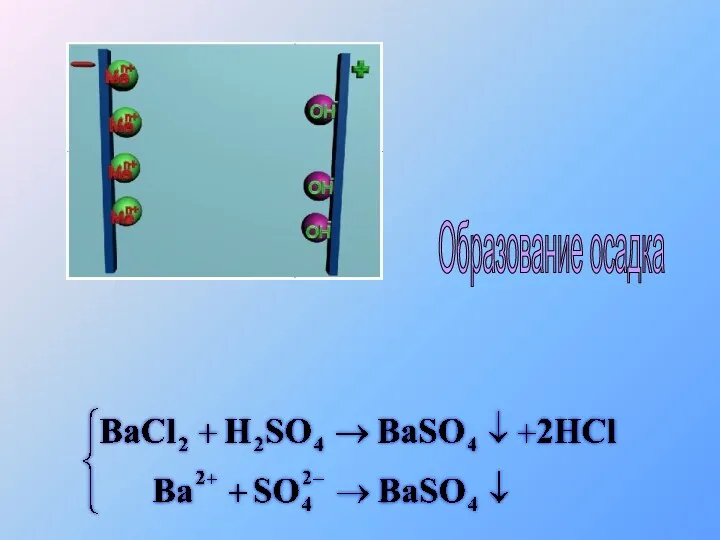
- 34. Образование осадка
- 35. Образование осадка
- 36. Выделение осадка
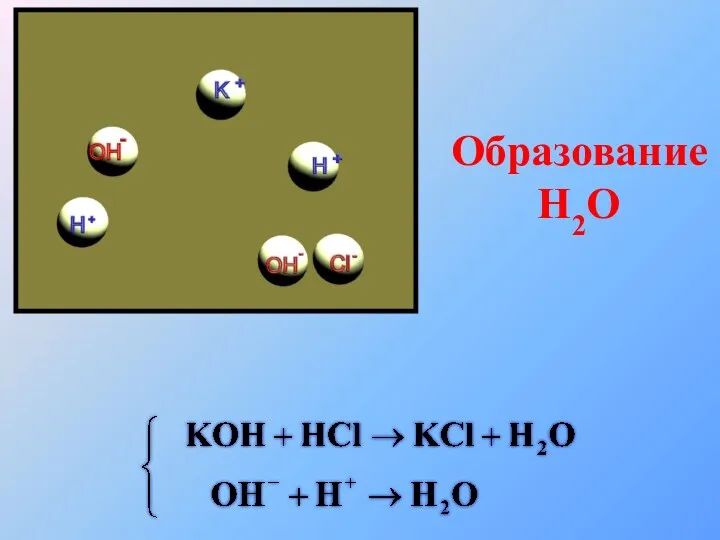
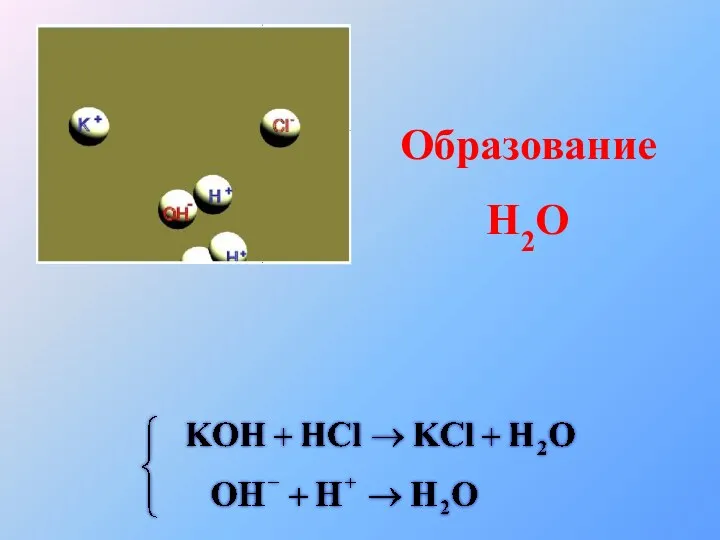
- 37. Образование H2O
- 38. Образование Н2О
- 39. Образование осадка
- 40. Образование осадка
- 41. Образование осадка
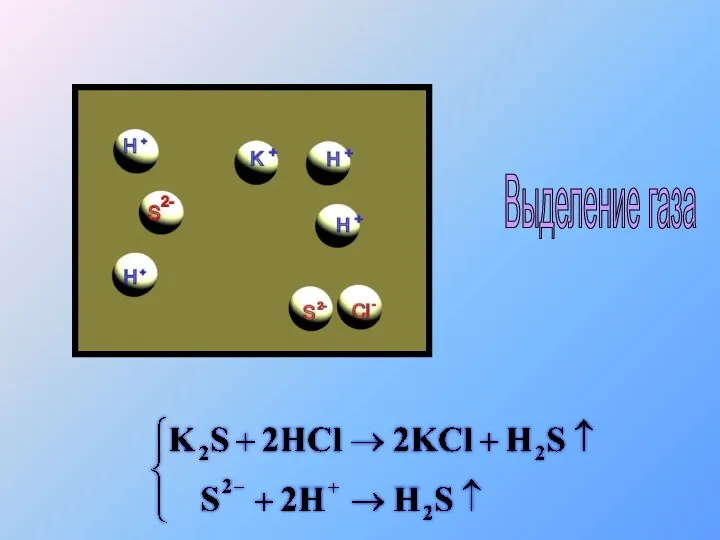
- 42. Выделение газа
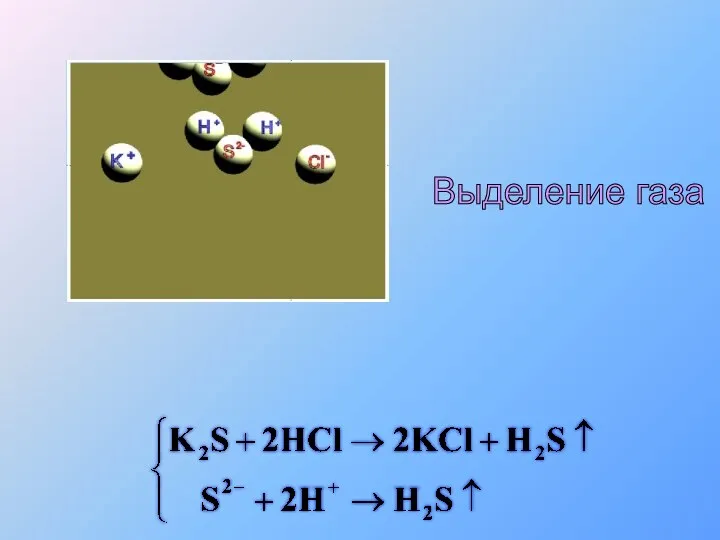
- 43. Выделение газа
- 44. Выделение газа
- 46. Скачать презентацию




















 Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Химическая наука и промышленность в годы ВОВ
Химическая наука и промышленность в годы ВОВ Альбитит-грейзеновые месторождения
Альбитит-грейзеновые месторождения Сульфидтер. Аз еруші сульфидтер
Сульфидтер. Аз еруші сульфидтер Алотропні модифікації фосфору
Алотропні модифікації фосфору Метод кислотно-основного титрования. (Лекции 21-22)
Метод кислотно-основного титрования. (Лекции 21-22) Теория электролитической диссоциации
Теория электролитической диссоциации Азот и его соединения. История открытия
Азот и его соединения. История открытия СОЕДИНЕНИЯ ХРОМА
СОЕДИНЕНИЯ ХРОМА Классификация и свойства оксидов
Классификация и свойства оксидов NPK Fertilizers. Classification of fertilizers
NPK Fertilizers. Classification of fertilizers Коррозия и защита строительных материалов
Коррозия и защита строительных материалов Tipi di reazioni chimiche
Tipi di reazioni chimiche Полусинтетическое масло
Полусинтетическое масло Study of the properties of halogens and the determination of halide ions in aqueous solution
Study of the properties of halogens and the determination of halide ions in aqueous solution Кремний и его соединения
Кремний и его соединения Курсовая работа. Оптимизация рецептуры вареных колбасных изделий по пищевым добавкам
Курсовая работа. Оптимизация рецептуры вареных колбасных изделий по пищевым добавкам Подготовка к итоговой контрольной работе. (9 класс)
Подготовка к итоговой контрольной работе. (9 класс) Белки. Содержание белков в различных тканях
Белки. Содержание белков в различных тканях Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота
Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Узагальнення й систематизація знань з теми Початкові хімічні поняття (1 частина)
Узагальнення й систематизація знань з теми Початкові хімічні поняття (1 частина) Тіршілік гетерофункционалды қосылыстар
Тіршілік гетерофункционалды қосылыстар Токсикологическая химия. Токсичность химических соединений
Токсикологическая химия. Токсичность химических соединений Массообменные процессы
Массообменные процессы Вещества
Вещества Основания в свете ТЭД, классификация, свойства
Основания в свете ТЭД, классификация, свойства Изделия из металлов
Изделия из металлов