Содержание
- 2. Примеры химических реакций Необратимые х.р. Na2SO4 +BaCl2 ? BaSO4 ↓+ 2NaCl Zn(OH)2 +2HCl ? ZnCl2 +
- 3. Химическое равновесие Обратимая химическая реакция H2 + I2 ↔ 2HI По закону действующих масс Vпр.=k₁ [H2]∙[I2]
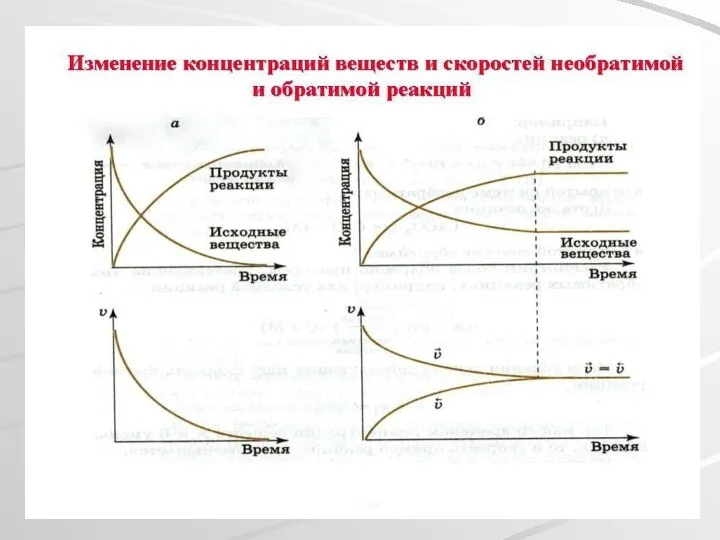
- 5. Переход системы из одного состояния равновесия в другое называется смещением химического равновесия. Правило смещения химического равновесия
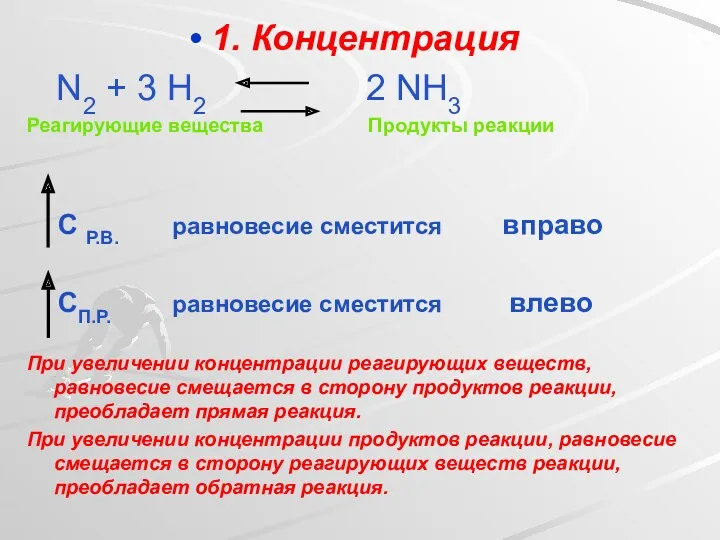
- 6. 1. Концентрация N2 + 3 H2 2 NH3 Реагирующие вещества Продукты реакции С Р.В. равновесие сместится
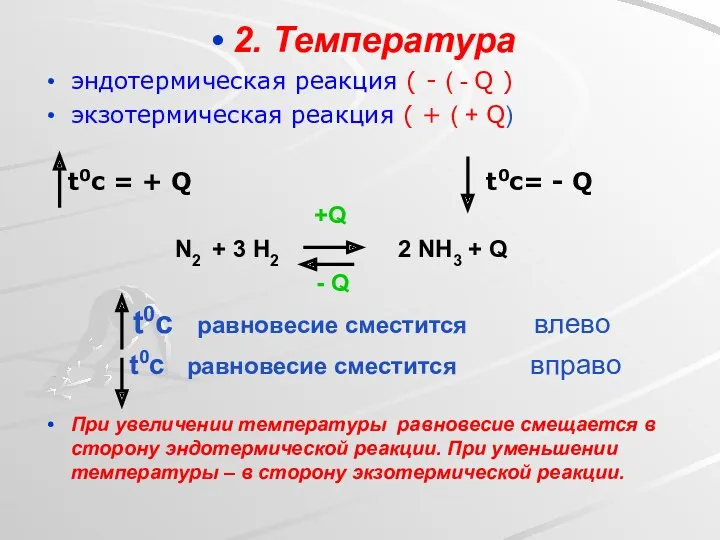
- 7. 2. Температура эндотермическая реакция ( - ( - Q ) экзотермическая реакция ( + ( +
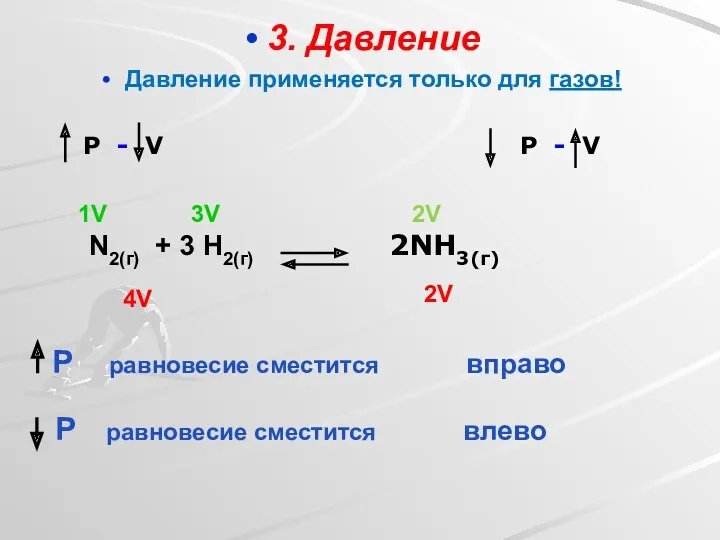
- 8. 3. Давление Давление применяется только для газов! P - V P - V 4V 2V N2(г)
- 9. При увеличения давления равновесие смещается в сторону той реакции, при которой объем образовавшихся газообразных продуктов уменьшается.
- 11. Скачать презентацию




 Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса Серебро. Нахождение в природе
Серебро. Нахождение в природе Получение каталитического слоя на основе углеродных нанотрубок с наночастицами платины для водородно–воздушных топливных элементов
Получение каталитического слоя на основе углеродных нанотрубок с наночастицами платины для водородно–воздушных топливных элементов Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Основные интермедиаты в органических реакциях. Часть 1
Основные интермедиаты в органических реакциях. Часть 1 Токсикологическая химия. Токсичность химических соединений
Токсикологическая химия. Токсичность химических соединений Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Качественные реакции на органические вещества
Качественные реакции на органические вещества Взаимодействия кислорода с металлом
Взаимодействия кислорода с металлом Мінерали та гірські породи
Мінерали та гірські породи Нитросоединения
Нитросоединения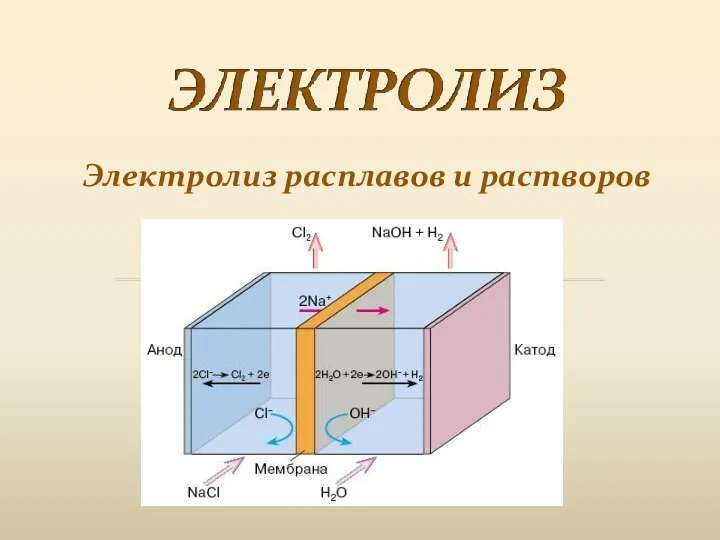 Электролиз расплавов и растворов
Электролиз расплавов и растворов Простые вещества металлы
Простые вещества металлы Свойства топлив. Марки бензинов и их характеристики
Свойства топлив. Марки бензинов и их характеристики Введение в геологию и минералогию
Введение в геологию и минералогию Кварц
Кварц Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Красители и пигменты
Красители и пигменты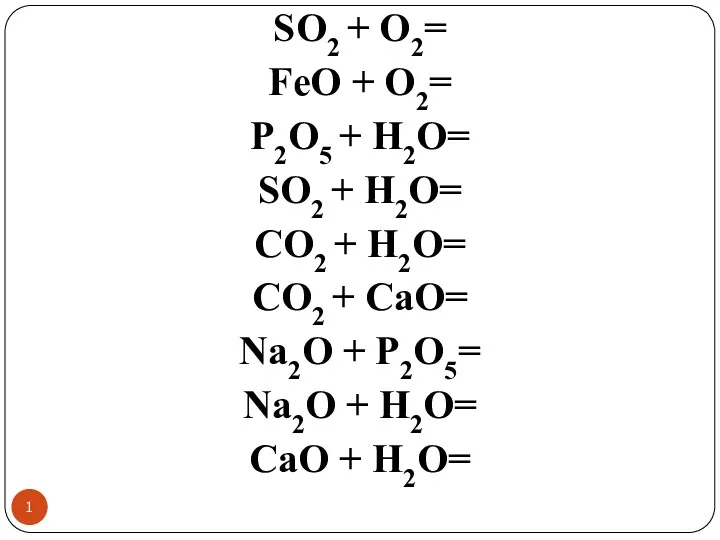 Химиялық реакциялар. Амфотерлі негіздер
Химиялық реакциялар. Амфотерлі негіздер Подготовка учащихся к практическим турам олимпиад по химии
Подготовка учащихся к практическим турам олимпиад по химии Сложные эфиры. Жиры
Сложные эфиры. Жиры Химические свойства неорганических соединений. Лабораторная работа
Химические свойства неорганических соединений. Лабораторная работа Алкины. Самостоятельная работа
Алкины. Самостоятельная работа Электролиз водных растворов
Электролиз водных растворов Амины. Физические и химические свойства
Амины. Физические и химические свойства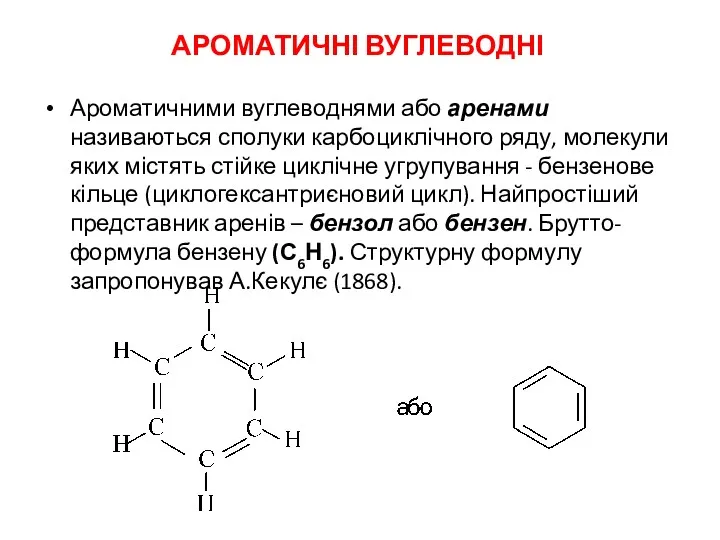 Ароматичні вуглеводні
Ароматичні вуглеводні Значение органической химии в жизни человека
Значение органической химии в жизни человека