Слайд 2
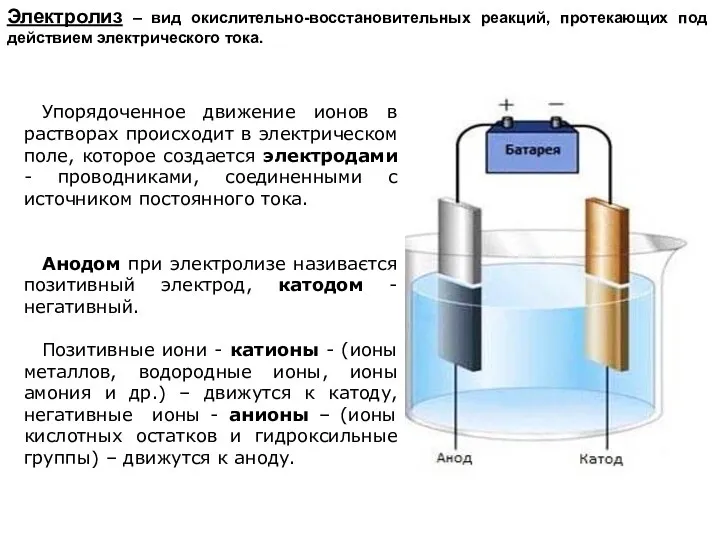
Электролиз – вид окислительно-восстановительных реакций, протекающих под действием электрического тока.
Упорядоченное движение
ионов в растворах происходит в электрическом поле, которое создается электродами - проводниками, соединенными с источником постоянного тока.
Анодом при электролизе називаєтся позитивный электрод, катодом - негативный.
Позитивные иони - катионы - (ионы металлов, водородные ионы, ионы амония и др.) – движутся к катоду, негативные ионы - анионы – (ионы кислотных остатков и гидроксильные группы) – движутся к аноду.
Слайд 3

Электролиз расплавов
Пример 1. Электролиз расплава KВr.
KВr → K+ + Вr−
Слайд 4

Пример 2. Электролиз расплава Аl2O3.
Аl2O3 → Аl3+ + АlO33-
Слайд 5

Электролиз растворов
Катодные (восстановительные) процессы.
На катоде происходит восстановление катионов металлов и водорода
или молекул воды.
Для растворов кислот: K(-) Н+, Н2O 2Н+ + 2ē → Н20↑.
Для растворов солей или щелочей: K(-) Меn+, Н2O.
Характер восстановительного процесса зависит от значения стандартного электродного потенциала металлов:
Слайд 6

Анодные (окислительные) процеси.
При електролизе растворов используют растворимые и нерастворимые аноды.
Нерастворимые аноды изготовляют из углерода и платины, а растворимые - из цинка, меди, никеля и других металлов.
На нерастворимом аноде окисление анионов или молекул воды.
Слайд 7

Пример 1. Електролиз раствора CuSO4.
CuSO4 → Cu2+ + SO42-
Слайд 8

Пример 2. Электролиз раствора KСl.
KСl → K+ + Сl−
Слайд 9

Пример 3. Электролиз раствора Na2SO4.
Na2SO4 → 2Na+ + SO42-








 Изучение состава чая
Изучение состава чая Электролиз: опыты к заданиям ЕГЭ
Электролиз: опыты к заданиям ЕГЭ Электрохимия. Понятие о двойном электрическом слое (ДЭС)
Электрохимия. Понятие о двойном электрическом слое (ДЭС) Геохимические методы исследований
Геохимические методы исследований Чистые вещества и смеси. Растворы
Чистые вещества и смеси. Растворы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Электролиз раствора щёлочи с использованием железного анода
Электролиз раствора щёлочи с использованием железного анода Значення хімії у розв’ язанні енергетичної проблеми
Значення хімії у розв’ язанні енергетичної проблеми Crystal structure and surface phase composition of palladium oxides thin films for gas sensors
Crystal structure and surface phase composition of palladium oxides thin films for gas sensors Амінокислоти. Класифікація та номенклатура
Амінокислоти. Класифікація та номенклатура Нефть как дисперсная система
Нефть как дисперсная система Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1
Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1 Химический элемент цинк
Химический элемент цинк Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Облучение. Радиационная окраска
Облучение. Радиационная окраска Протолитические равновесия и процессы. Лекция 3
Протолитические равновесия и процессы. Лекция 3 Азотсодержащие соединения. Амины. Аминокислоты
Азотсодержащие соединения. Амины. Аминокислоты Степень окисления в органической химии
Степень окисления в органической химии Алкены. Пропилен C₃H₆
Алкены. Пропилен C₃H₆ Влияние спирта на здоровье человека
Влияние спирта на здоровье человека Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде
Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде Парфюмерно-косметическая продукция
Парфюмерно-косметическая продукция Окисление и восстановление
Окисление и восстановление Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Получение уксусной кислоты и опыты с ней
Получение уксусной кислоты и опыты с ней Значення хімічних процесів у природі
Значення хімічних процесів у природі Строение атома и периодический закон Д.И. Менделеева
Строение атома и периодический закон Д.И. Менделеева