Содержание
- 2. Условие задачи Ферраты за счет своих сильных окислительных свойств легко разлагают органические соединения и обладают антисептическим
- 3. Цель Определить максимальную концентрацию феррат-ионов в растворе, полученную методом электролиза водного раствора щелочи с использованием железного
- 4. Электролиз раствора щёлочи с использованием железного анода
- 5. Теоретическая часть «Заткнись и считай» © Дэвид Мермин
- 6. Термодинамический аспект
- 7. Перечень необходимых равновесий
- 8. Искомое равновесие
- 9. Что с равновесием?
- 10. Практическая часть Основная задача: доказать, что феррат-ион термодинамически не устойчив в растворе
- 11. Методика определения феррат-иона в растворе: 1. Методом электролиза водного раствора щёлочи с использованием железного анода получить
- 12. 2. Отобрать из приготовленного раствора аликвоту; 3. Оставить её деградировать до исчезновения окраски раствора;
- 13. 4. После исчезновения окраски добавить к аликвоте раствор бромида щелочного металла; 5. Постепенно закислять среду;
- 14. Химия процессов
- 15. Кинетический аспект
- 16. Какова же максимальная концентрация?
- 17. Вредные процессы 1. Восстановления феррата; 2. Параллельный анодный процесс поставляет в систему воду, что влияет на
- 18. Выводы 1. Термодинамический вывод: Равновесная концентрация = 0 моль/л. 2. Кинетический вывод: Максимальная концентрация = 4
- 19. Список литературы [1] Ю.Ю. Лурье Справочник по аналитической химии.// Издание 4-е переработанное и дополненное. – М.:
- 20. Спасибо за внимание
- 22. Кинетический аспект Решение в кинетическом аспекте: Экспериментальное построение кинетических кривых каждой из реакций; Подбор необходимых условий
- 23. Механизм образования феррата при электролизе [5]
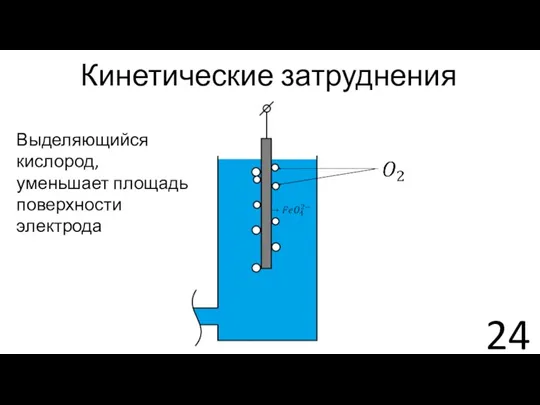
- 24. Кинетические затруднения Выделяющийся кислород, уменьшает площадь поверхности электрода
- 25. Electrosynthesis of Ferrate (VI) ion Using High Purity Iron Electrodes: Optimization of Influencing Parameters on the
- 26. Империя наносит ответный удар
- 27. Продолжаем вычислять
- 30. Скачать презентацию

















![Список литературы [1] Ю.Ю. Лурье Справочник по аналитической химии.// Издание](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/277570/slide-18.jpg)



![Механизм образования феррата при электролизе [5]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/277570/slide-22.jpg)




 Количество вещества. Лекция №2
Количество вещества. Лекция №2 Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов Углерод. Аллотропные модификации
Углерод. Аллотропные модификации Теории происхождения нефти
Теории происхождения нефти Фосфор
Фосфор Полимерные материалы
Полимерные материалы Физико-химические основы дезодорации растительных масел
Физико-химические основы дезодорации растительных масел Кислоты. Определение рН кислоты, щелочи, воды
Кислоты. Определение рН кислоты, щелочи, воды Частицы вещества: молекула, атом, ион
Частицы вещества: молекула, атом, ион Электроотрицательность химических элементов
Электроотрицательность химических элементов Общая электронная теория восстановления и окисления металлов
Общая электронная теория восстановления и окисления металлов Химиялық реакцияның жылдамдығы
Химиялық реакцияның жылдамдығы Минералы группы кварца
Минералы группы кварца Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) Токсикология и анализ спиртов
Токсикология и анализ спиртов Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас
Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас Вода
Вода Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Функціональні матеріали для високоенергетичної електроніки. (Лекція 1)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 1) Анализ качества лекарственных веществ, определяемых методом комплексонометрии
Анализ качества лекарственных веществ, определяемых методом комплексонометрии Классификация топлива. Показатели качества топлива (Лекция 1)
Классификация топлива. Показатели качества топлива (Лекция 1) Менделеевские уроки. День науки
Менделеевские уроки. День науки Химический состав пресных вод рыбохозяйственного назначения
Химический состав пресных вод рыбохозяйственного назначения Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Понятия о металлических сплавах. Лекция 4
Понятия о металлических сплавах. Лекция 4 Побутові хімікати
Побутові хімікати Сушка в химической промышленности. Свойства влажного воздуха
Сушка в химической промышленности. Свойства влажного воздуха Открытие новых химических элементов с атомными номерами 113, 115, 117 и 118
Открытие новых химических элементов с атомными номерами 113, 115, 117 и 118