Содержание
- 2. Теория электролитической диссоциации Аррениуса пригодна лишь для водных растворов, в неводных растворителях она несостоятельна. Например, NH4Cl,
- 3. Протолитическая теория кислот и оснований (Теория Бренстеда-Лоури) Кислота – молекула или ион, способные отдавать Н+ (протон).
- 4. Протонная теория объясняет кислотные и оснoвные свойства веществ происходящими между ними процессами протолиза - обмена протонами.
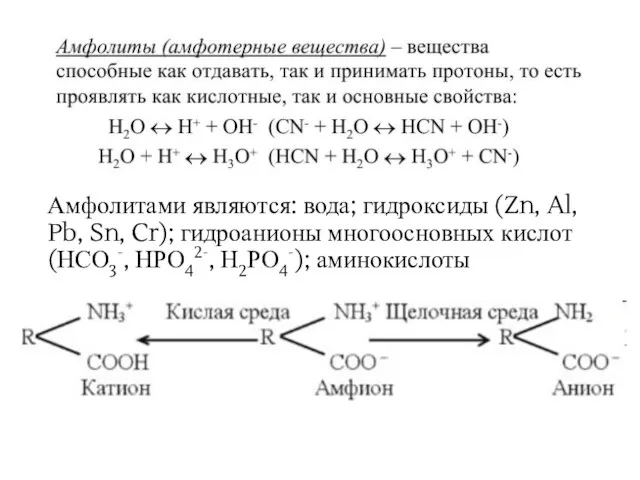
- 5. Амфолитами являются: вода; гидроксиды (Zn, Al, Pb, Sn, Cr); гидроанионы многоосновных кислот (НСО3-, НРО42-, Н2РО4-); аминокислоты
- 6. Жидкие протонсодержащие растворители вступают в обратимую реакцию автопротолиза. Например, для воды: 2Н2О = Н3О+ + ОН-
- 7. Водородный показатель рН – это отрицательный десятичный логарифм активности водородных ионов: рН = - lg cн+.
- 8. Растворенные в воде вещества выполняющие по отношению к ней функции кислоты или основания, называют протолитами в
- 9. Если протолит A- (молекула или ион) - основание, то обратимая реакция протолиза имеет вид: A- +
- 10. Для каждой сопряженной пары кислота/основание значения Kа и Kb связаны соотношением: Ka х Kb = Kw
- 11. Расчет рН кислот и оснований Кислоты сильные слабые рН = - lgСк-та рН = - lg(α
- 13. Буферными называют растворы, способные сохранять значение рН при разбавлении или добавлении небольших количеств кислоты или щелочи.
- 14. Механизм поддержания рН Рассмотрим ацетатный буферный раствор: СН3СООН ↔ СН3СОО- + Н+; СН3СООNa → СН3СОО- +
- 15. рН буферных растворов рассчитывается по формулам Гендерсона – Гассельбаха: Для кислого буфера: Для основного буфера:
- 16. Буферная емкость Величину, характеризующую способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочи,
- 17. Буферная ёмкость зависит от: природы добавляемых веществ и компонентов буферного раствора. исходной концентрации компонентов буферной системы.
- 18. Максимальная буферная емкость, т.е. наибольшая способность этой системы противостоять изменению рН, соответствует значению рН = рК.
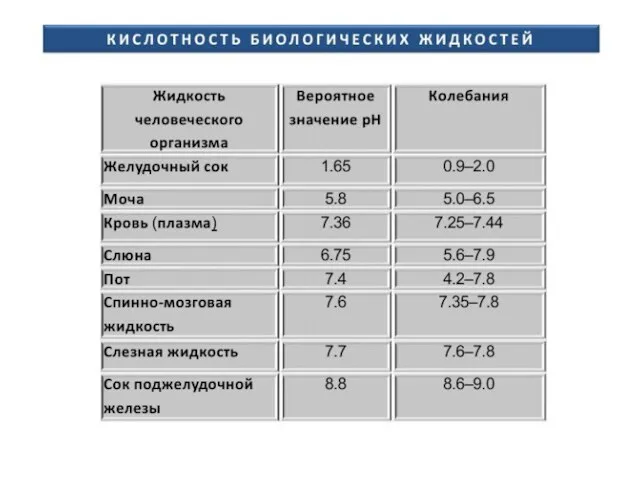
- 19. Буферные системы крови Нормальное значение рН плазмы крови 7,40 ± 0,05. Механизм действия разбирается на практическом
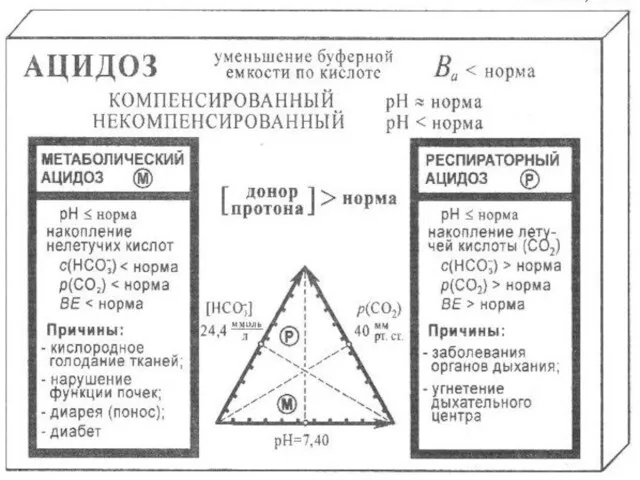
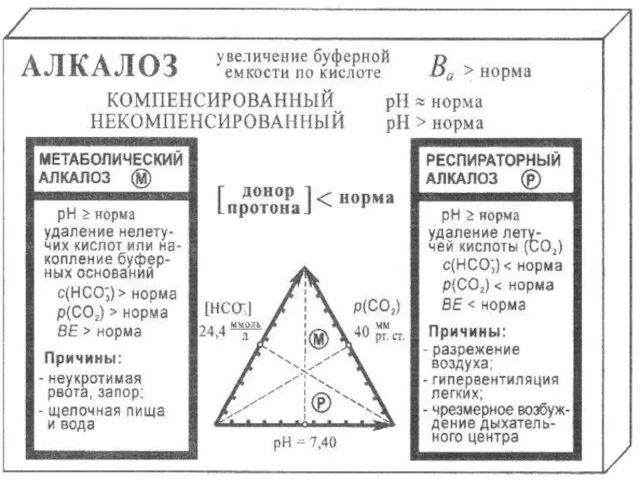
- 20. Кислотно-основное состояние организма (КОС) Для оценки состояния буферных систем и выяснения причин сдвигов КОС предложены следующие
- 24. Скачать презентацию

















 Вещества и тела. Состояния веществ. Смеси
Вещества и тела. Состояния веществ. Смеси Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Теория электролитической диссоциации
Теория электролитической диссоциации Строение атома и периодический закон
Строение атома и периодический закон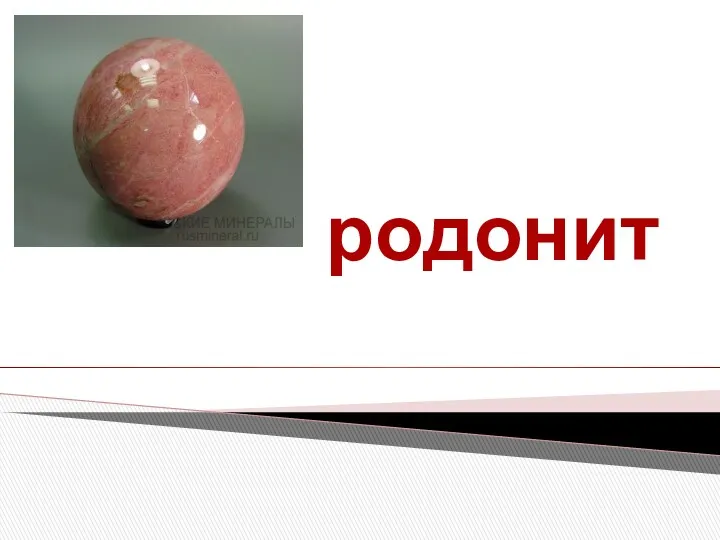 Минерал родонит. Месторождения
Минерал родонит. Месторождения Состав, свойства, виды и способы получения дегтей
Состав, свойства, виды и способы получения дегтей Химия p-элементов
Химия p-элементов Цинк и его соединения
Цинк и его соединения Полисахаридтер – жоғары молекулалық көмірсулар
Полисахаридтер – жоғары молекулалық көмірсулар Физические и химические явления. Условия течения и признаки химических реакций
Физические и химические явления. Условия течения и признаки химических реакций Химия. 9 класс
Химия. 9 класс Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Алкандар. (қаныққан көмірсутектер. Парафиндер.)
Алкандар. (қаныққан көмірсутектер. Парафиндер.) Гель-хроматография. Бумажная хроматография
Гель-хроматография. Бумажная хроматография Минералы и их свойства
Минералы и их свойства Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кремнийдің құрамы, құрылысы және қасиеттері
Кремнийдің құрамы, құрылысы және қасиеттері Реакции электрофильного замещения в ароматическом ряду Se
Реакции электрофильного замещения в ароматическом ряду Se Химические реакции
Химические реакции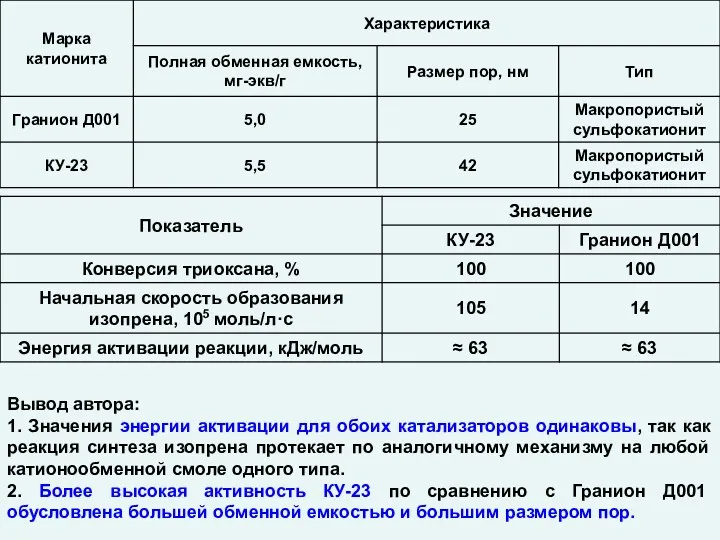 Катализ. Гетерогенные катализаторы
Катализ. Гетерогенные катализаторы Галогены в природе. Хлор, бром, иод
Галогены в природе. Хлор, бром, иод Материаловедение. Придание металлам и сплавам заданных свойств
Материаловедение. Придание металлам и сплавам заданных свойств Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3
Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3 Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів
Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів Композиты и композиционные материалы
Композиты и композиционные материалы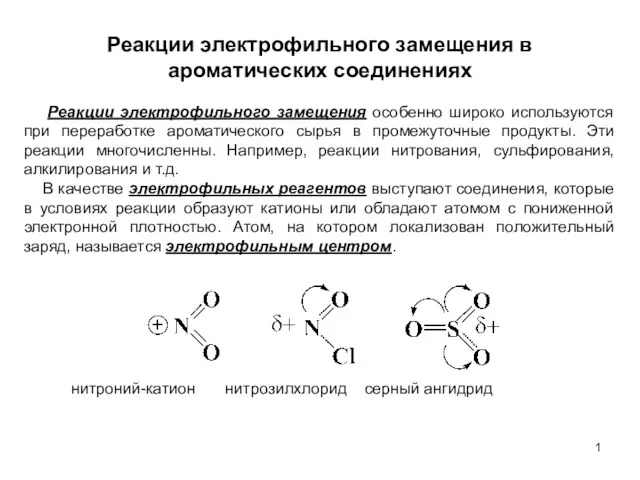 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Предмет физической и коллоидной химии. Термодинамика
Предмет физической и коллоидной химии. Термодинамика