Содержание
- 2. Глава 1. Токсичность химических соединений 1.1. Основные понятия токсикологии 2 Токсикант Порог токсического действия (истинный порог
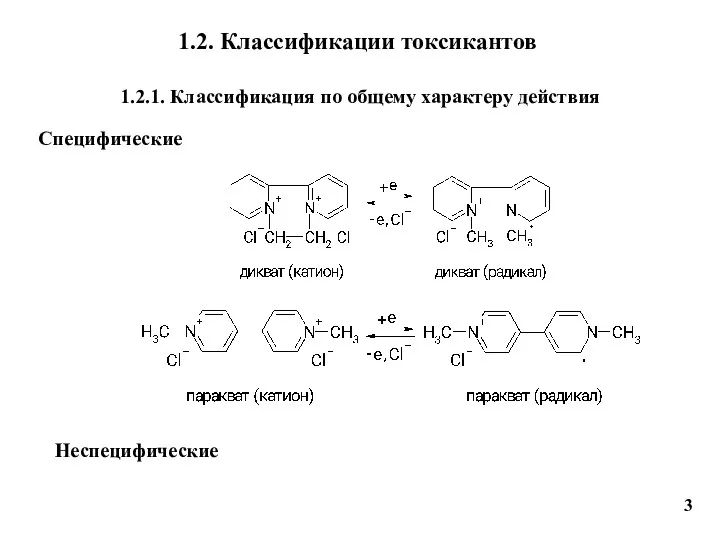
- 3. 1.2. Классификации токсикантов 1.2.1. Классификация по общему характеру действия Специфические 3 Неспецифические
- 4. 1.2.2. Классификация токсикантов по характеру действия на млекопитающих яды локального действия ферментные яды протоплазматические яды гемолитические
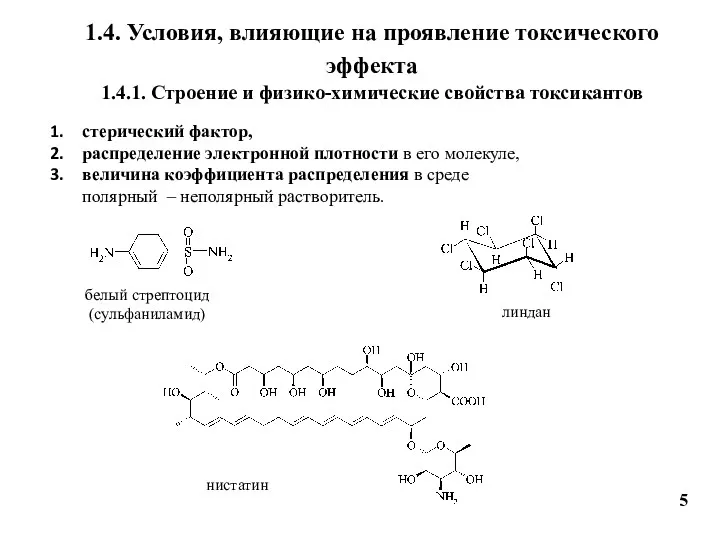
- 5. 1.4. Условия, влияющие на проявление токсического эффекта 1.4.1. Строение и физико-химические свойства токсикантов 5 стерический фактор,
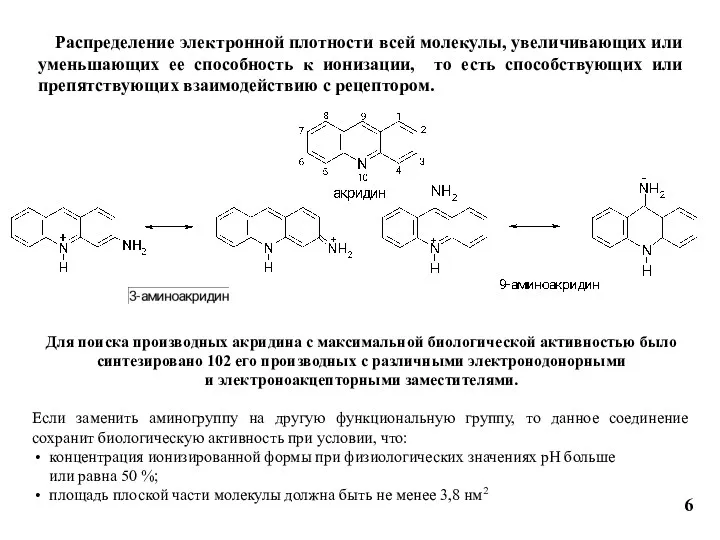
- 6. 6 Распределение электронной плотности всей молекулы, увеличивающих или уменьшающих ее способность к ионизации, то есть способствующих
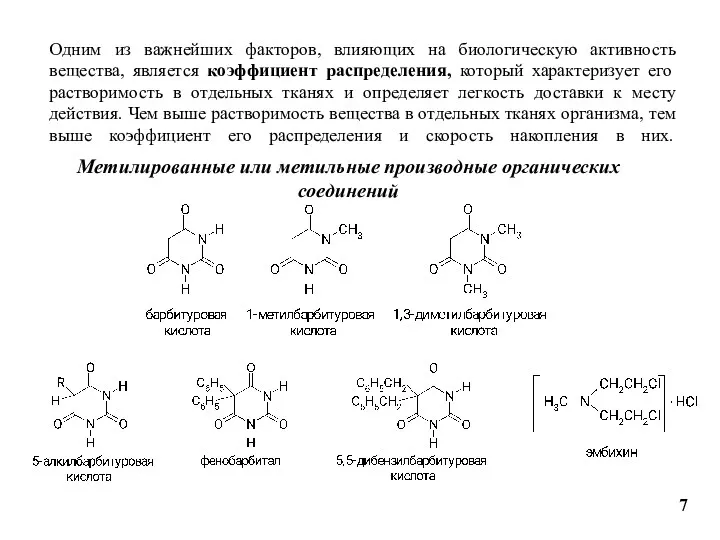
- 7. Одним из важнейших факторов, влияющих на биологическую активность вещества, является коэффициент распределения, который характеризует его растворимость
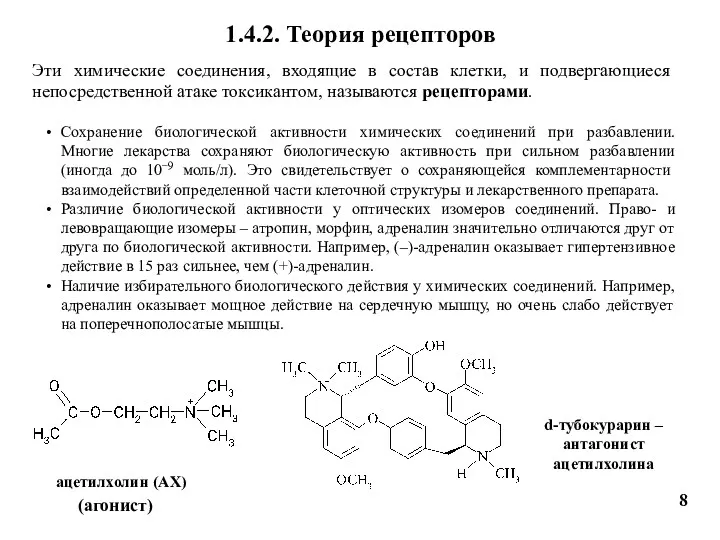
- 8. 8 1.4.2. Теория рецепторов Эти химические соединения, входящие в состав клетки, и подвергающиеся непосредственной атаке токсикантом,
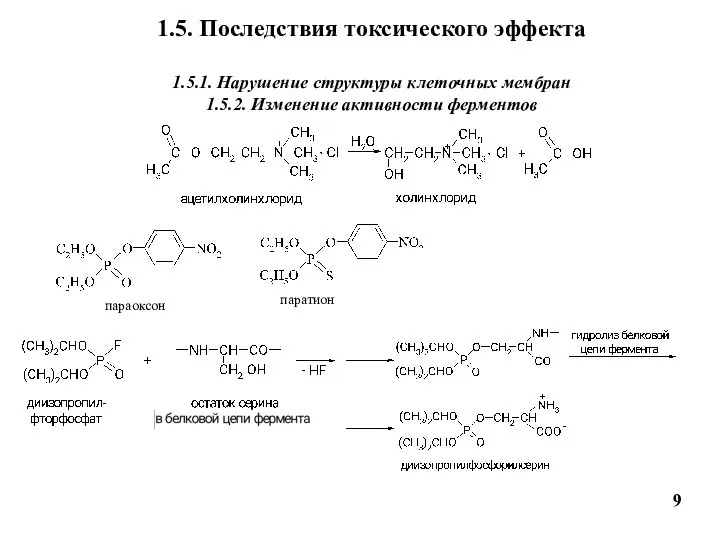
- 9. 1.5. Последствия токсического эффекта 1.5.1. Нарушение структуры клеточных мембран 1.5.2. Изменение активности ферментов 9 параоксон паратион
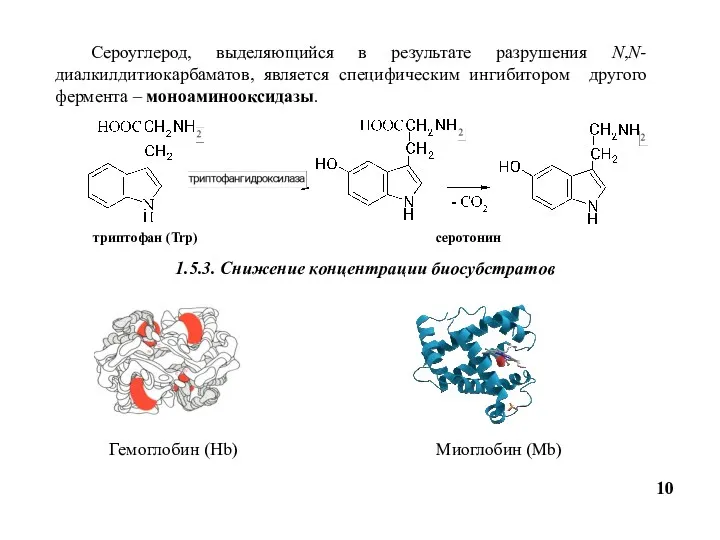
- 10. 10 Сероуглерод, выделяющийся в результате разрушения N,N-диалкилдитиокарбаматов, является специфическим ингибитором другого фермента – моноаминооксидазы. триптофан (Trp)
- 11. 1.6.2. Метаболические превращения органических соединений 11 Метаболические превращения, можно классифицировать следующим образом: окисление микросомальными ферментами (гидроксилирование,
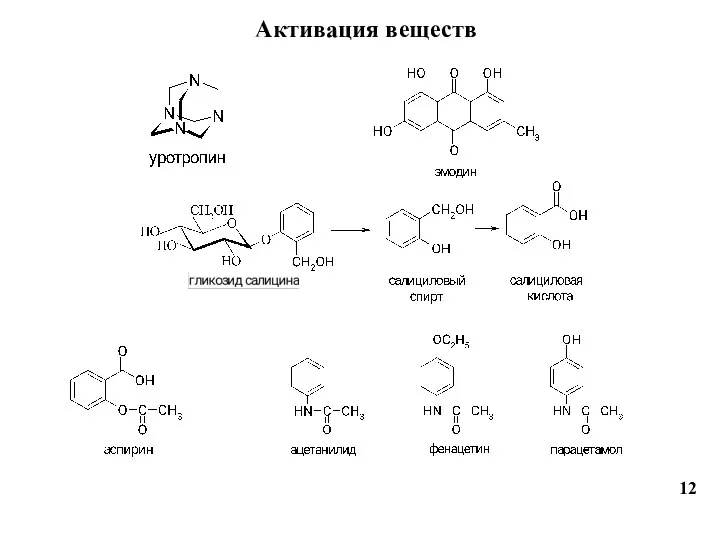
- 12. Активация веществ 12
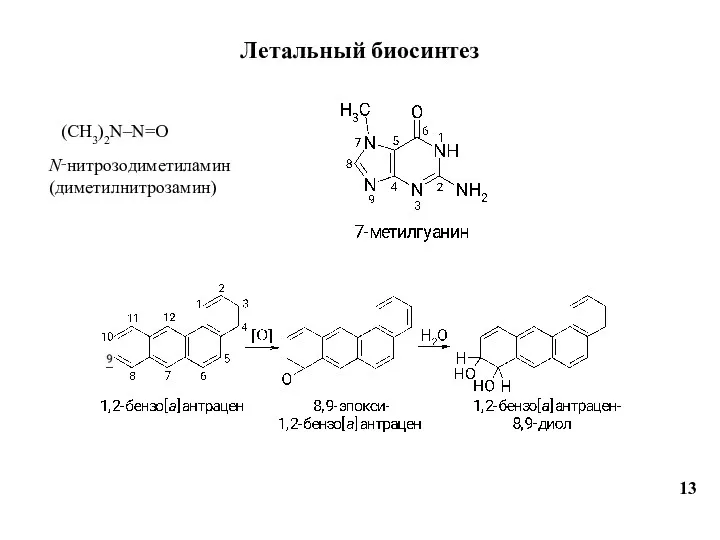
- 13. Летальный биосинтез 13 (CH3)2N–N=O N‑нитрозодиметиламин (диметилнитрозамин)
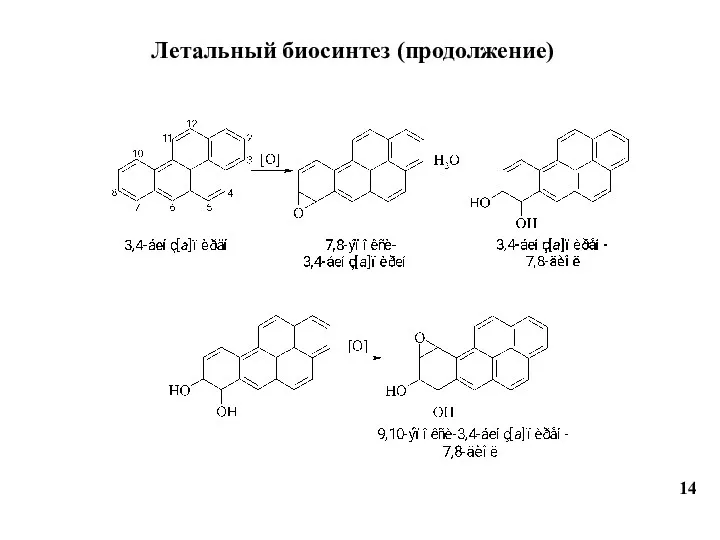
- 14. 14 Летальный биосинтез (продолжение)
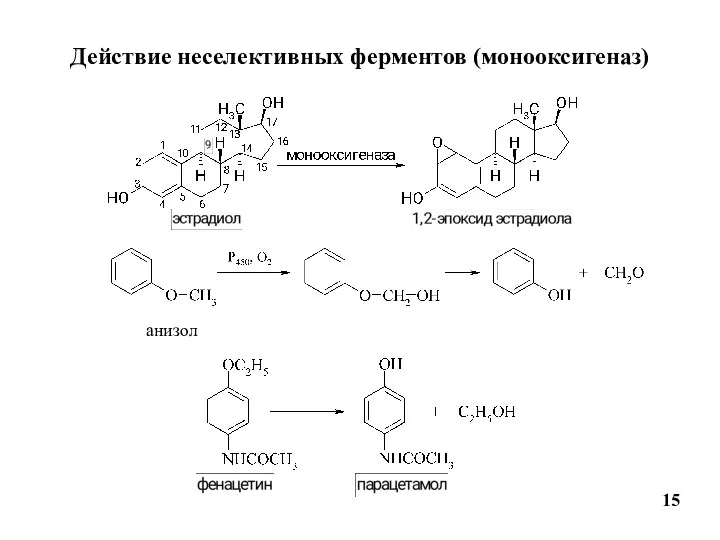
- 15. Действие неселективных ферментов (монооксигеназ) 15 анизол
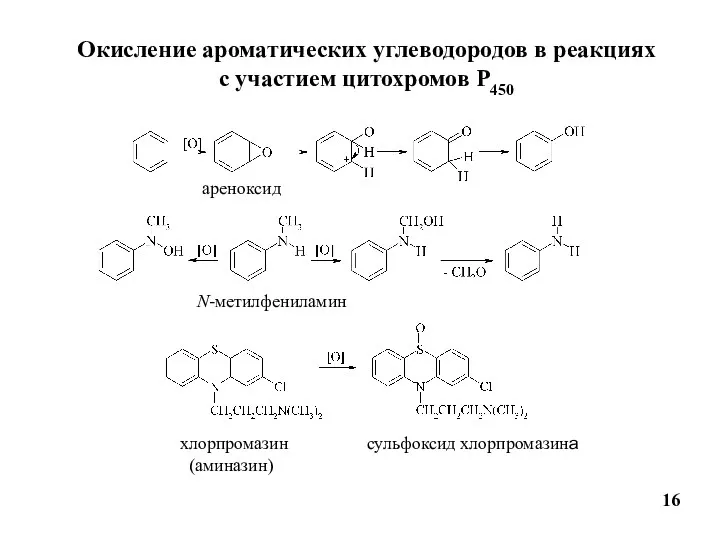
- 16. Окисление ароматических углеводородов в реакциях с участием цитохромов Р450 16 ареноксид N-метилфениламин хлорпромазин (аминазин) сульфоксид хлорпромазина
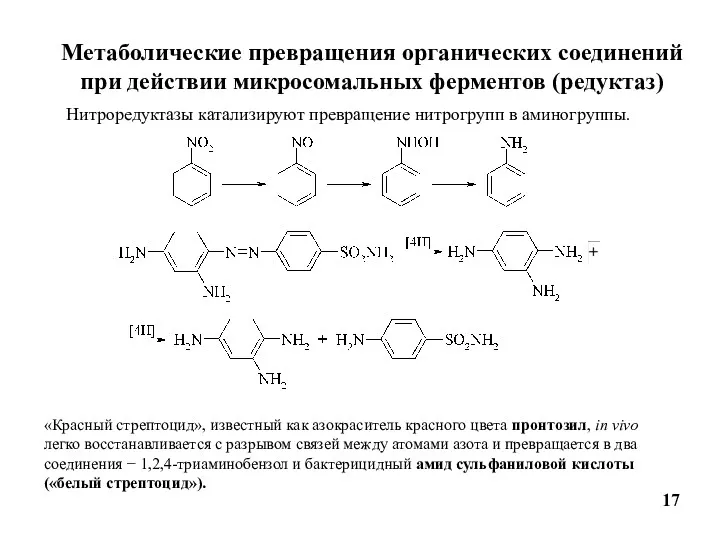
- 17. Метаболические превращения органических соединений при действии микросомальных ферментов (редуктаз) 17 Нитроредуктазы катализируют превращение нитрогрупп в аминогруппы.
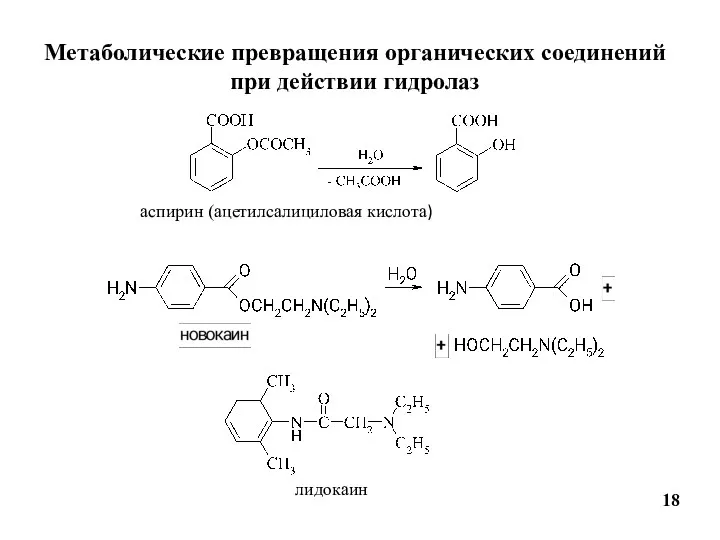
- 18. Метаболические превращения органических соединений при действии гидролаз 18 аспирин (ацетилсалициловая кислота) лидокаин
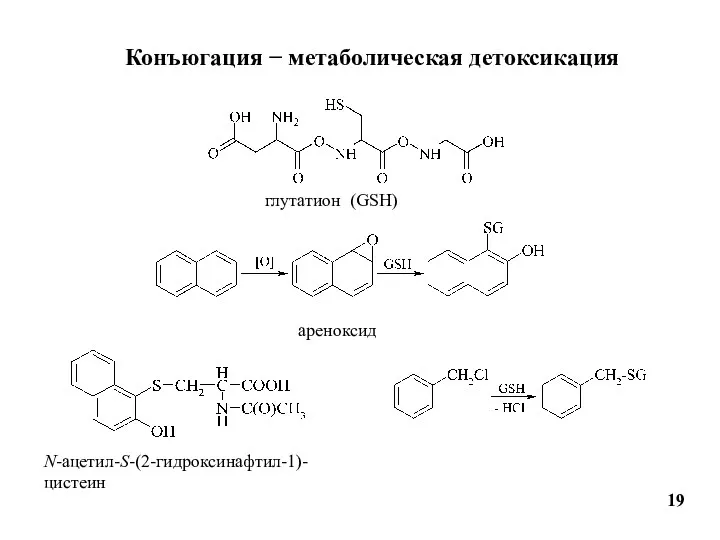
- 19. Конъюгация − метаболическая детоксикация 19 глутатион (GSH) ареноксид N-ацетил-S-(2-гидроксинафтил-1)-цистеин
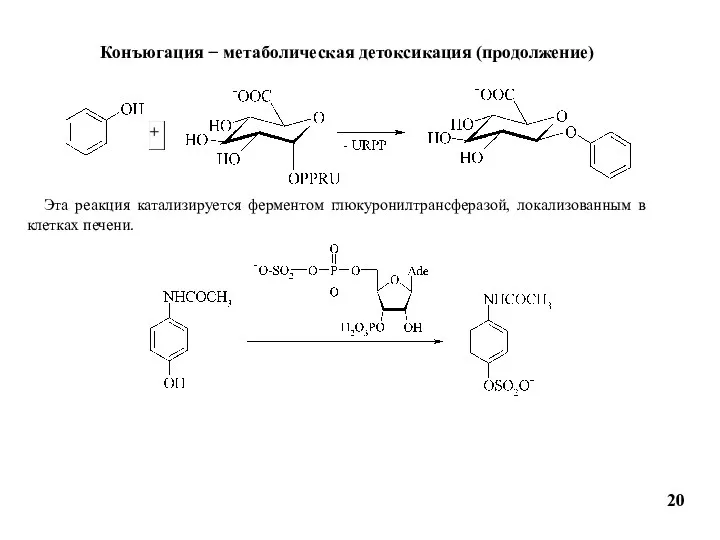
- 20. 20 Конъюгация − метаболическая детоксикация (продолжение) Эта реакция катализируется ферментом глюкуронилтрансферазой, локализованным в клетках печени.
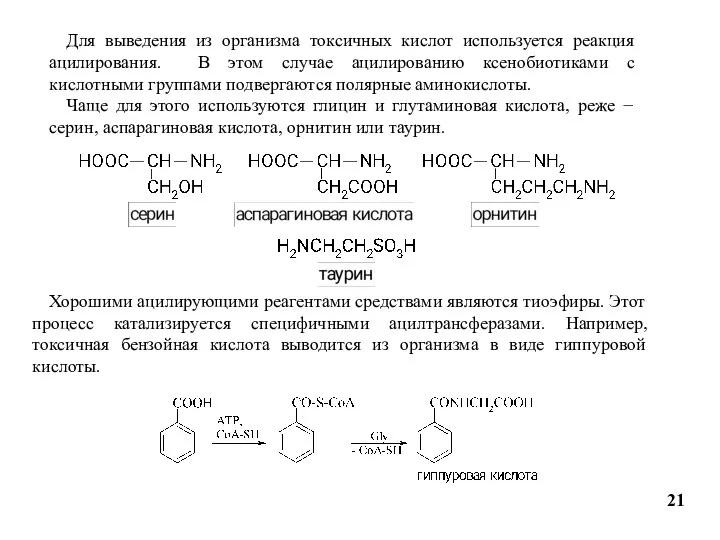
- 21. Для выведения из организма токсичных кислот используется реакция ацилирования. В этом случае ацилированию ксенобиотиками с кислотными
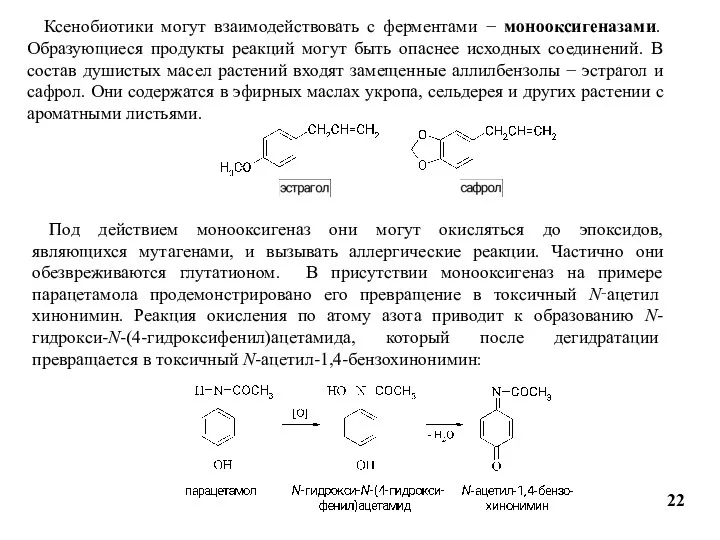
- 22. 22 Ксенобиотики могут взаимодействовать с ферментами − монооксигеназами. Образующиеся продукты реакций могут быть опаснее исходных соединений.
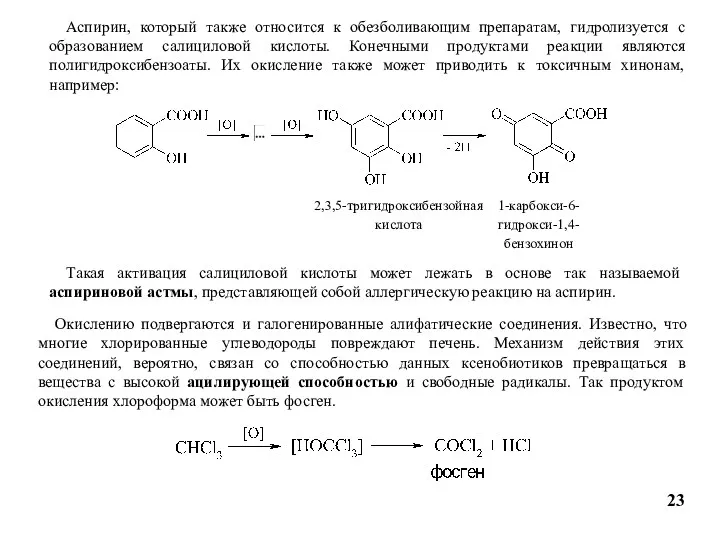
- 23. 23 Аспирин, который также относится к обезболивающим препаратам, гидролизуется с образованием салициловой кислоты. Конечными продуктами реакции
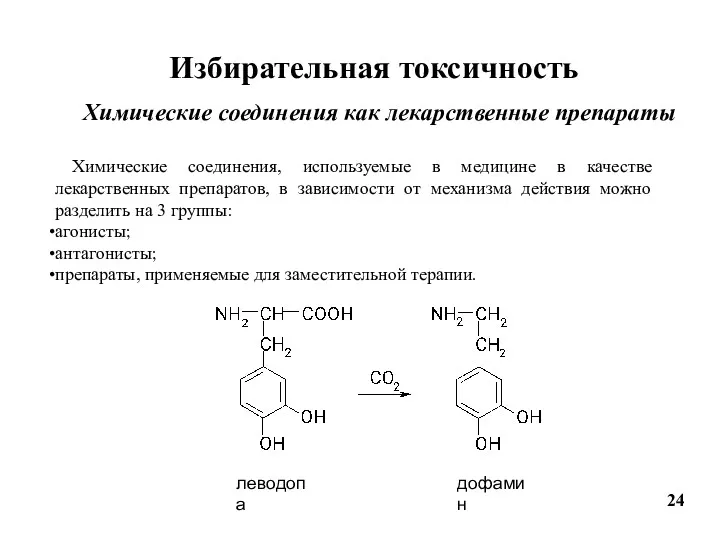
- 24. Избирательная токсичность Химические соединения как лекарственные препараты Химические соединения, используемые в медицине в качестве лекарственных препаратов,
- 25. Химические соединения, используемые в сельском хозяйстве В 1930 г. в Австралии с помощью жука Castoblastis был
- 26. Уменьшить поголовье кроликов в Австралии удалось лишь, заразив их вирусом миксоматоза. Однако этот путь связан с
- 27. Действие радиации на живые организмы Радиационное загрязнение окружающей среды 26 Наиболее опасные радионуклиды При одинаковом уровне
- 28. 26 Иод-131 (131I) непрерывно образуется и распадается в процессе работы реактора. С растениями, травой он легко
- 29. Теория мишеней и радикалов 27 Cильно выраженное повреждение клетки вызвано поглощением большого количества энергии ядерных частиц
- 30. «Теория свободных радикалов» 28 Сформулирована в 1940-х годах. Она объясняла радиобиологический парадокс действием высокореакционных продуктов распада
- 31. Свободные радикалы и другие продукты радиолиза могут вступать в следующие химические реакции с биологически важными молекулами
- 32. 30 Действие ионизирующей радиации на живые организмы может приводить к нарушениям биологической организации на всех ее
- 33. Репарация радиационных повреждений. Обратимые и необратимые эффекты радиации 31 Изменения, вызванные действием радиации на биохимическом или
- 34. Мутационные изменения при действии ксенобиотиков на живые организмы 32 Радиационные повреждения клеток могут быть связаны с
- 35. 33 Долгое время считали, что главный риск от радиации − наследственные эффекты. Но наблюдения, проведенные в
- 36. Радиочувствительность и радиорезистентность 34 Для обозначения степени возможного поражения или невосприимчивости к воздействию ионизирующей радиации применяют
- 37. 35 Высокой радиорезистентностью, то есть малой чувствительностью отличаются редко делящиеся и высокодифференцированные (строго специализированные) клетки нервной,
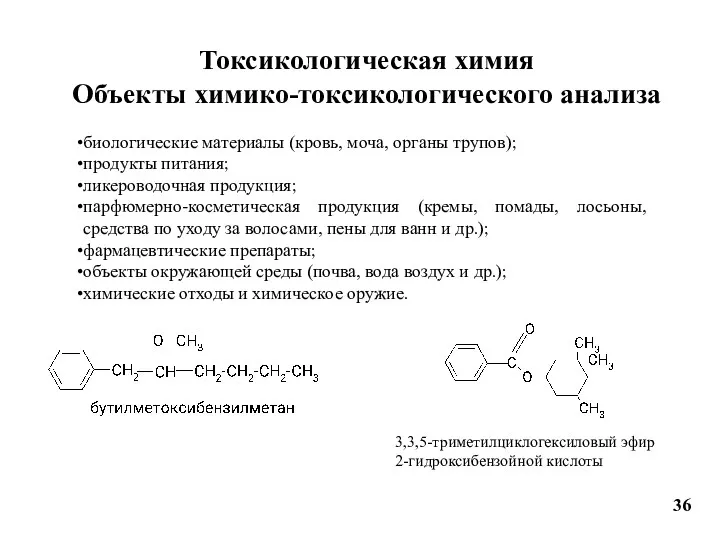
- 38. Токсикологическая химия Объекты химико-токсикологического анализа 36 биологические материалы (кровь, моча, органы трупов); продукты питания; ликероводочная продукция;
- 39. Типы классификаций токсикантов Классификация по токсикологическим признакам 37 По основному действию на организм: раздражающие-слезоточивые – лакриматоры
- 41. Скачать презентацию

















 Метод кислотно-основного титрования. (Лекции 21-22)
Метод кислотно-основного титрования. (Лекции 21-22) Формы минералов и их агрегатов
Формы минералов и их агрегатов Соединения железа
Соединения железа Свойства воды
Свойства воды Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Сірке қышқылын алу технологиясы
Сірке қышқылын алу технологиясы Пропилен-алкены(пропен)
Пропилен-алкены(пропен) Минеральные вяжущие вещества, материалы и изделия на их основе
Минеральные вяжущие вещества, материалы и изделия на их основе Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа
Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Фармакология. Окисление
Фармакология. Окисление Азотсодержащие гетероциклические соединения. Пиррол
Азотсодержащие гетероциклические соединения. Пиррол Электоролиз заңы
Электоролиз заңы Пайдалы қазба
Пайдалы қазба Особенности строения, реакционной способности и методы синтеза аренов
Особенности строения, реакционной способности и методы синтеза аренов Химиялық жарыс кеші
Химиялық жарыс кеші Химия. Викторина
Химия. Викторина Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Свинец и цинк в природе
Свинец и цинк в природе Периодический закон Менделеева
Периодический закон Менделеева Классификация моторных масел
Классификация моторных масел Химические формулы
Химические формулы Основные характеристики различных сортов меда
Основные характеристики различных сортов меда Галогени. Знаходження в природі
Галогени. Знаходження в природі Хімічні властивості оксидів
Хімічні властивості оксидів Горение топлива
Горение топлива Электролитическая диссоциация
Электролитическая диссоциация Теорія горіння та вибуху
Теорія горіння та вибуху