Содержание
- 2. План Сущность кислотно-основного титрования. Индикаторы кислотно-основного титрования. Кривые титрования. 3. Ошибки кислотно-основного титрования 4. Применение методов
- 3. 1. Сущность кислотно-основного титрования. В основе метода лежит реакция взаимодействия между кислотой и основанием, то есть
- 4. Индикаторы кислотно-основного титрования. Для обнаружения точки эквивалентности в титриметрическом анализе применяют индикаторы (от лат. Indicare- показывать,
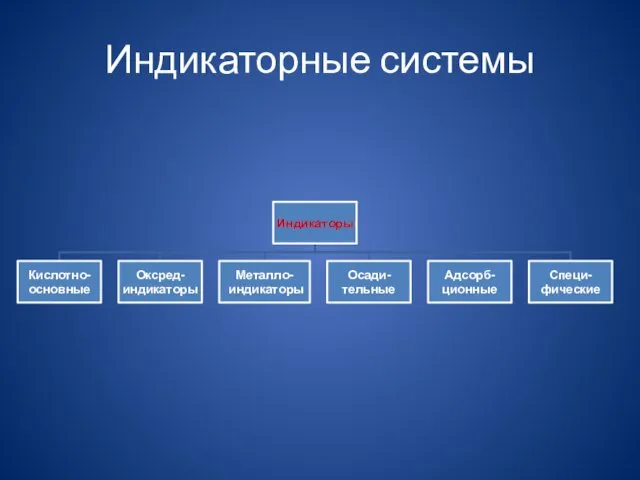
- 5. Классификация индикаторов По способу установления КТТ (ТЭ) различают безиндикаторные и индикаторные титриметрические методы. В безиндикаторных методах
- 6. Однако в большинстве случаев окончание реакции титрования не сопровождается внешним эффектом. Для регистрации ТЭ (КТТ) в
- 7. Титриметрические методы, использующие индикаторы, называют индикаторными. В индикаторных методах ТЭ может не совпадать с КТТ, так
- 8. По обратимости возникновения или исчезновения внешнего эффекта реакции различают обратимые и необратимые индикаторы. Обратимые индикаторы -
- 9. Индикаторные системы
- 10. Кислотно-основные индикаторы Для объяснения природы изменения окраски индикаторов при изменении рН раствора предложены различные теории, наиболее
- 11. Индикаторы, обладающие свойством присоединять протоны, называется основными обозначаются IndOH, где Ind+- катион индикатора. Они диссоциируют по
- 12. При этом равновесие диссоциации индикаторов смесится вправо и накопление анионов Ind- вызовет окрашивание раствора в малиновый
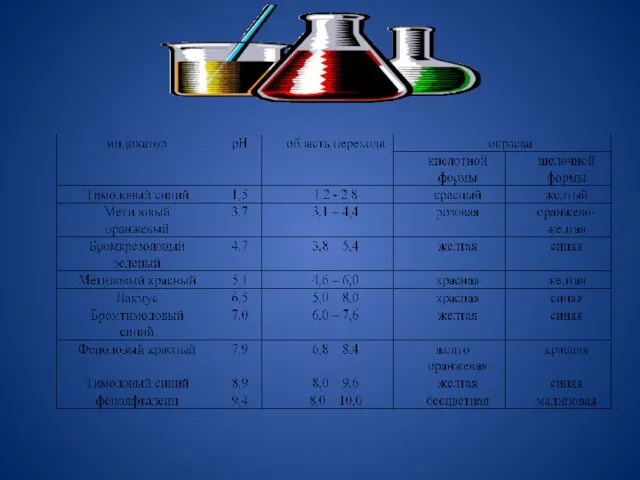
- 13. Каждый индикатор, используемый в реакции нейтрализации, характеризуется определенным интервалом перехода окраски. Под интервалом перехода окраски индикатора,
- 14. Недостатки ионной теории индикаторов а) Она констатирует различие окрасок кислой и основной форм, но не объясняет
- 15. Хромофорная теория кuслотно-основных uндикаторов. Наличие окраски кислотно-основных индикаторов, являющихся органическими соединениями, обусловлено присутствием в молекулах индикаторов
- 16. Предполагается, что индикаторы в растворе могут присутствовать в разных таутомерных формах, находящихся в равновесии. В кислой
- 17. Согласно хромофорной теории, предполагается, что в водном растворе фенолфталеина устанавливается равновесие: бесцветная форма 1 красно-фиолетовая форма
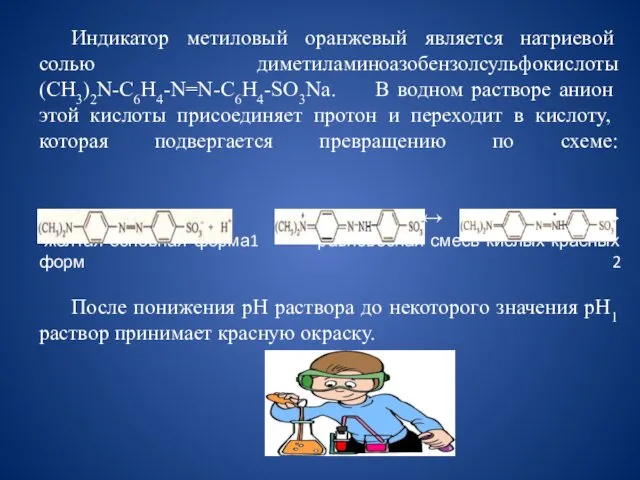
- 18. Индикатор метиловый оранжевый является натриевой солью диметиламиноазобензолсульфокислоты (СН3)2N-С6Н4-N=N-С6Н4-SО3Nа. В водном растворе анион этой кислоты присоединяет протон
- 19. При уменьшении концентрации ионов водорода равновесие, напротив, смещается влево - в сторону основной желтой формы 1
- 20. Вывод: в растворах кислотно-основных индикаторов одновременно происходят как равновесные процессы, обусловленные диссоциацией молекул, так и равновесные
- 21. Для каждого кислотно-основного индикатора существует такой интервал изменения рН раствора, в котором происходит изменение окраски индикатора.
- 23. Величину рН, при которой заканчивается титрование с данным индикатором, называют показателем титрования и обозначают символом рТ.
- 25. Универсальные индикаторы (Кольтгофа и др.). Смеси из нескольких простых индикаторов, позволяющих определять величину рН в широком
- 26. В зависимости от величины рН индикатор принимает различные окраски:
- 27. Требования к кислотно-основным индикаторам Быть чувствительными, чтобы расход индикатора был как можно меньше. Равновесие между обеими
- 30. 2. Кривые титрования. Кривые титрования в методе нейтрализации представляют собой графическое изображение изменения рН раствора в
- 31. При построении кривых титрования выделяют следующие основные области расчета рН: А) расчет рН до начала титрования;
- 32. Скачок титрования – это резкое изменение рН вблизи точки эквивалентности. Начало скачка соответствует недостатку в 0,1
- 33. 1). Кривая титрования сильной кислоты сильным основанием (и наоборот) До точки эквивалентности в растворе будет присутствовать
- 34. Кривая титрования сильной кислоты сильным основанием (и наоборот) Рис.1 HCl + NaOH = NaCl + H2O.
- 35. Величина скачка титрования зависит от концентрации реагирующих веществ. Чем меньше концентрация реагентов, тем меньше скачок титрования.
- 36. 2). Кривая титрования слабой кислоты сильным основанием CН3СООН + NaOH = CН3СООNa + H2O В точке
- 37. а). Точка эквивалентности при титровании слабой кислоты сильной щелочью не совпадает с точкой нейтрализации, а находится
- 38. 3). Кривая титрования слабого основания сильной кислотой NH4OH + HСl = NH4Cl + H2O. В ионном
- 39. 1. Точка эквивалентности при титровании слабого основания сильной кислотой не совпадает с точкой нейтрализации, а находится
- 40. 4). Кривая титрования слабого основания слабой кислотой Например, CH3COOH(водн.)+NH4OH(водн.)=CH3COONH4(водн.)+H2O(ж.) Титрование этого типа характеризуется отсутствием резкого изменения
- 41. 3. Ошибки кислотно-основного титрования А. Ошибки, обусловленные неточностью измерения объема растворов. Для проведения титрования отбирают аликвотную
- 42. Величину ε можно уменьшить, если увеличить объем V отбираемого раствора. Так, если V = 50 мл,
- 43. Если раствор отбирают с помощью градуированной пипетки, то измерение проводят обычно (хотя и не всегда) один
- 44. Б. Индикаторные ошибки кислотно-основного титрования. К систематическим ошибкам кислотно-основного титрования относятся индикаторные ошибки. Они обусловлены несовпадением
- 45. Индикаторные ошибки кислотно-основного титрования подразделяют на водородную (протонную), гидроксидную; кислотную и основную. Водородная (протонная) ошибка ХН3О+
- 46. Гидроксидная ошибка ХОН-. Эта ошибка возникает при наличии избытка гидроксид-ионов ОН- в КТТ вследствие либо недотитровывания
- 47. Кислотная ошибка Ха.. Эта ошибка вызвана присутствием некоторого количества недотитрованной слабой кислоты в КТТ: Ха =
- 48. В КТТ количество недотитрованной слабой кислоты равно n' = [HA]V; тогда общее количество исходной кислоты n
- 49. Основная ошибка Хb. Под основной ошибкой понимают выраженную в процентах долю недотитрованного слабого основания в КТТ:
- 50. Разделим числитель и знаменатель полученной дроби на [ВН+]: Хb = ([B]/[BH+])·100% / [([B]/[BH+]) +1]. Подставим в
- 51. 4. Применение методов кислотно-основного титрования 1). Определение щелочи и карбонатов при их совместном присутствии проводят прямым
- 52. 2). Аммиак в солях аммония определяют двумя способами. Первый способ - обратное кислотно-основное титрование. К водному
- 54. Скачать презентацию











































![В КТТ количество недотитрованной слабой кислоты равно n' = [HA]V;](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/109387/slide-47.jpg)

![Разделим числитель и знаменатель полученной дроби на [ВН+]: Хb =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/109387/slide-49.jpg)


 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Технические средства наноэлектроники. Эпитаксиальные методы получения наноструктур
Технические средства наноэлектроники. Эпитаксиальные методы получения наноструктур Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка Положение металлов в периодической системе химических элементов. Особенности строения их атомов
Положение металлов в периодической системе химических элементов. Особенности строения их атомов Щелочноземельные металлы. Химические свойства
Щелочноземельные металлы. Химические свойства Классификация конструкционных материалов. Особенности атомно-кристаллического строения металлов. Лекции №1
Классификация конструкционных материалов. Особенности атомно-кристаллического строения металлов. Лекции №1 Роль хімії в пізнанні природи
Роль хімії в пізнанні природи Study of the properties of halogens and the determination of halide ions in aqueous solution
Study of the properties of halogens and the determination of halide ions in aqueous solution Органикалық химияға кіріспе. Органикалық заттардың ерекшеліктері
Органикалық химияға кіріспе. Органикалық заттардың ерекшеліктері 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Супрамолекулярний контроль для дослідження реакційної здатності та каталізу
Супрамолекулярний контроль для дослідження реакційної здатності та каталізу Бета-окисление жирных кислот
Бета-окисление жирных кислот Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Кристалдану үдерісі және қолдланылатын аппараттар
Кристалдану үдерісі және қолдланылатын аппараттар Ауыр түсті металдар
Ауыр түсті металдар Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага
Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ
Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Цитохромы P-450, b-5
Цитохромы P-450, b-5 Метаморфогенные месторождения
Метаморфогенные месторождения Гидролиз солей
Гидролиз солей Природный и синтетический каучуки. Резина
Природный и синтетический каучуки. Резина Производство серной кислоты
Производство серной кислоты Распознавание химических соединений
Распознавание химических соединений