Содержание
- 2. Арены (Ароматические соединения) Они представляют собой – циклические органические соединения, которые имеют в своём составе ароматическую
- 3. Арены Ароматические соединения, или арены, — большая группа соединений карбоциклического ряда, молекулы которых содержат устойчивую циклическую
- 4. История открытия Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году
- 5. Второе рождение Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году
- 6. Новое получение В 1833 году немецкий физико-химик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли
- 7. Фридрих Кекуле Фридрих Август Кекуле фон Штрадониц (нем. Friedrich August Kekulé von Stradonitz, 7 сентября 1829,
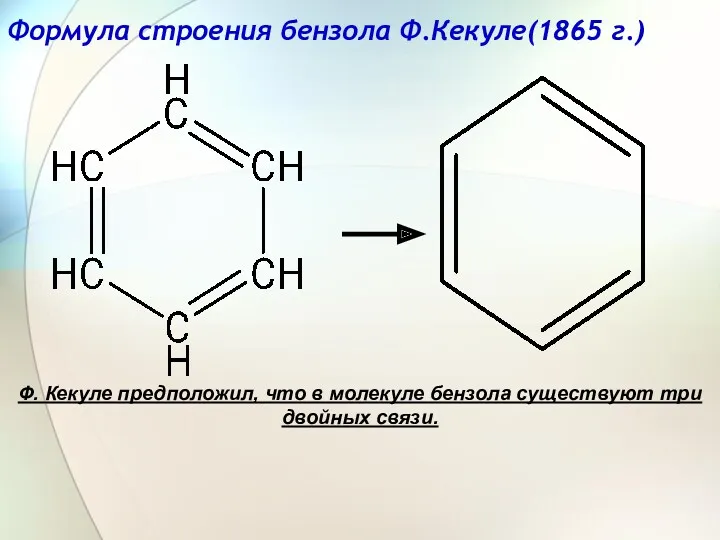
- 8. Формула строения бензола Ф.Кекуле(1865 г.) Ф. Кекуле предположил, что в молекуле бензола существуют три двойных связи.
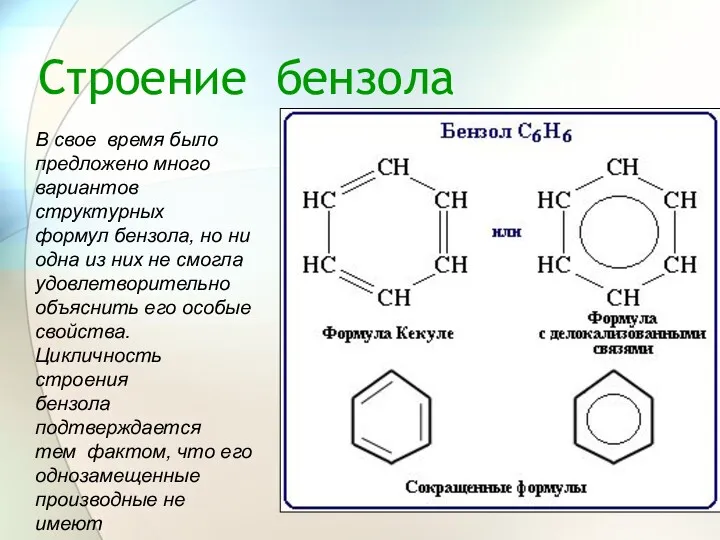
- 9. Строение бензола В свое время было предложено много вариантов структурных формул бензола, но ни одна из
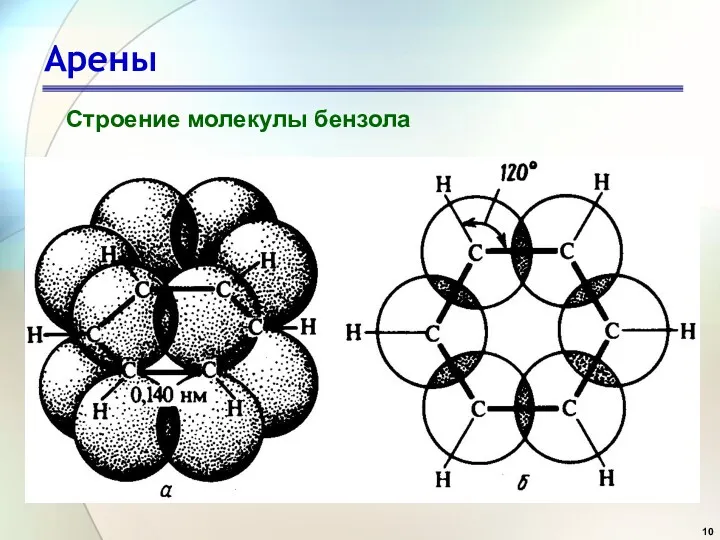
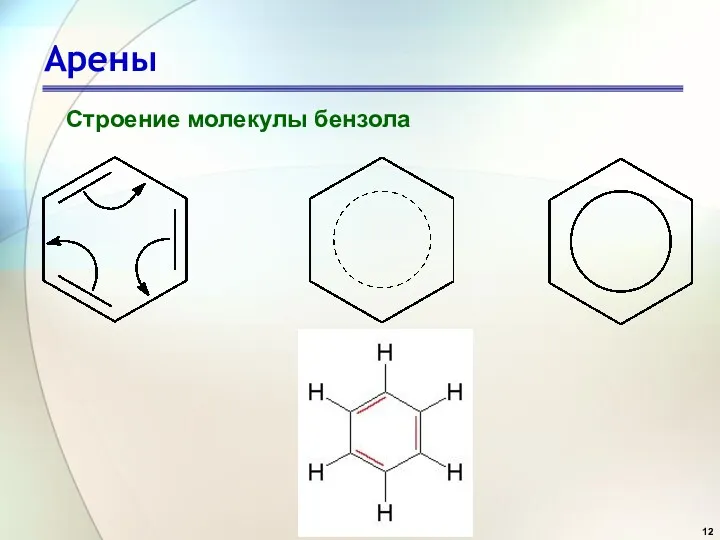
- 10. Арены Строение молекулы бензола
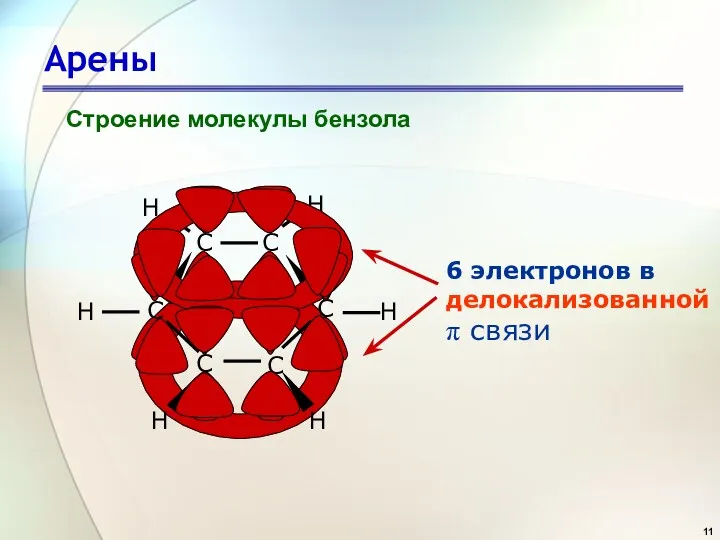
- 11. Арены Строение молекулы бензола 6 электронов в делокализованной π связи
- 12. Арены Строение молекулы бензола
- 13. Арены Строение молекулы бензола
- 14. Арены «Ароматичность» – совокупность особых свойств бензола Правило Хюккеля (1931): плоские циклические соединения, имеющие сопряженную систему
- 15. Арены «Ароматичность» – совокупность особых свойств бензола Эрих Хюккель 1896-1980
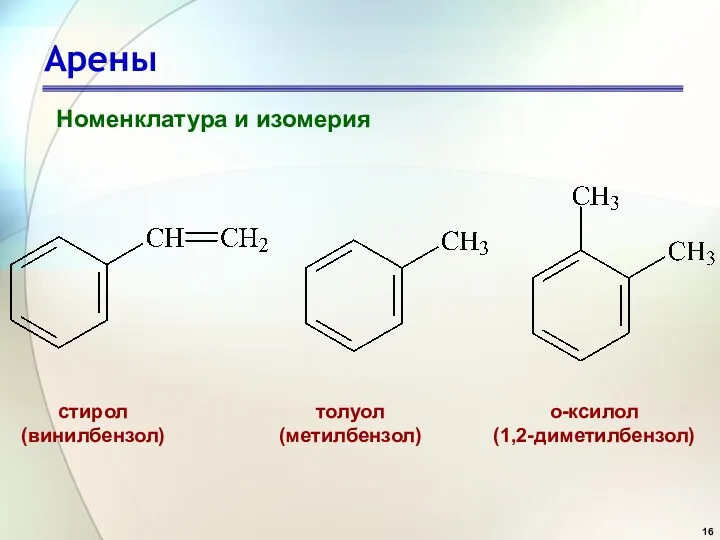
- 16. Арены Номенклатура и изомерия стирол (винилбензол) толуол (метилбензол) о-ксилол (1,2-диметилбензол)
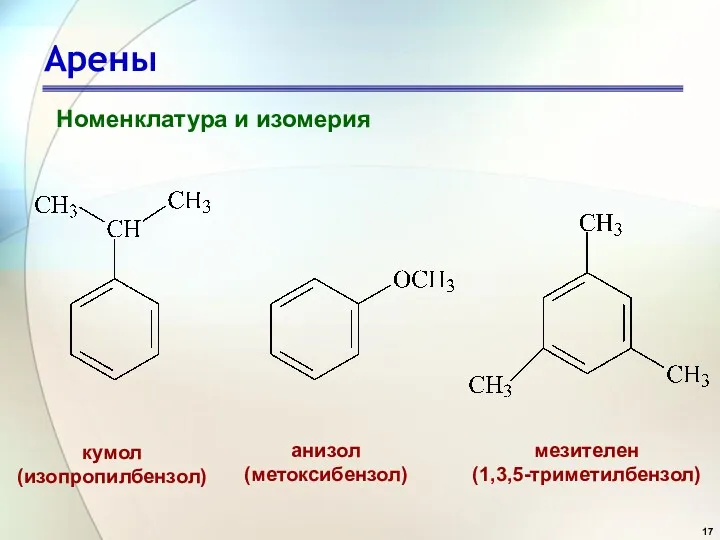
- 17. Арены Номенклатура и изомерия кумол (изопропилбензол) анизол (метоксибензол) мезителен (1,3,5-триметилбензол)
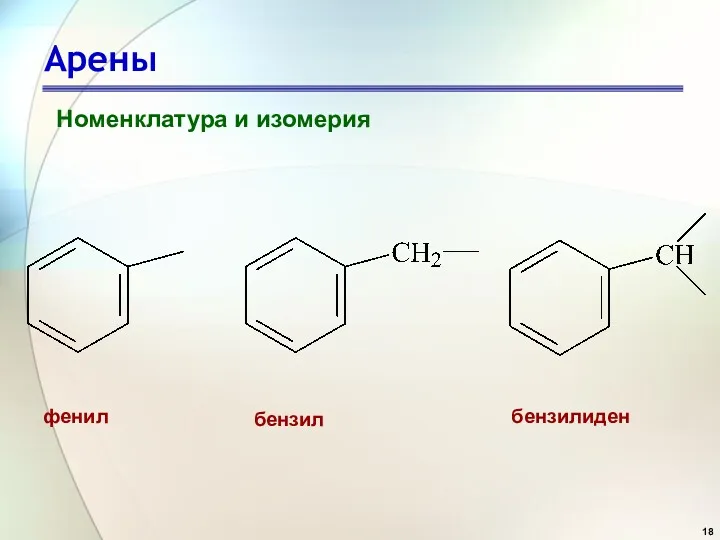
- 18. Арены Номенклатура и изомерия фенил бензил бензилиден
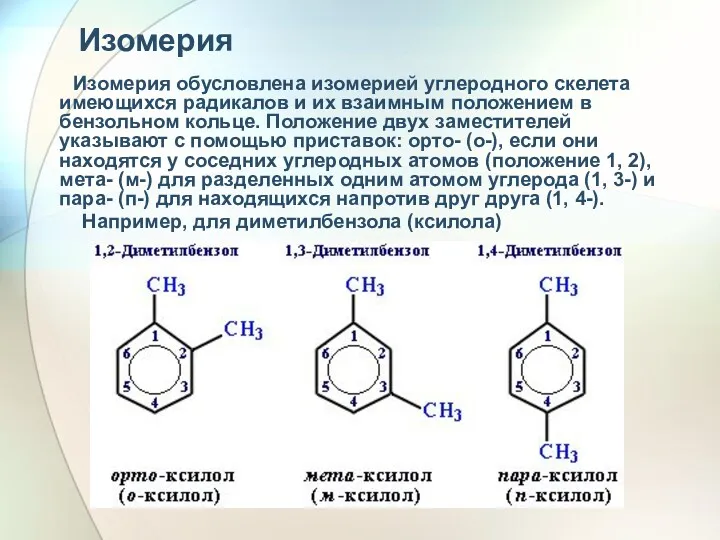
- 19. Изомерия Изомерия обусловлена изомерией углеродного скелета имеющихся радикалов и их взаимным положением в бензольном кольце. Положение
- 20. Физические свойства. Первые члены гомологического ряда бензола (например, толуол, этилбензол и др.) — бесцветные жидкости со
- 21. Физические свойства бензола Бесцветная жидкость со своеобразным резким запахом. Температура плавления 5,5 °C, температура кипения 80,1
- 22. Химические свойства аренов Бензольное ядро обладает высокой прочностью, чем и объясняется склонность ароматических углеводородов к реакциям
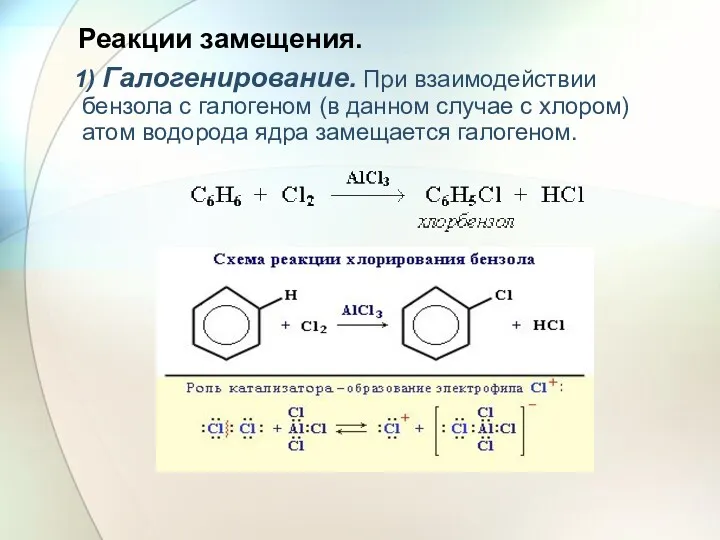
- 23. Реакции замещения. 1) Галогенирование. При взаимодействии бензола с галогеном (в данном случае с хлором) атом водорода
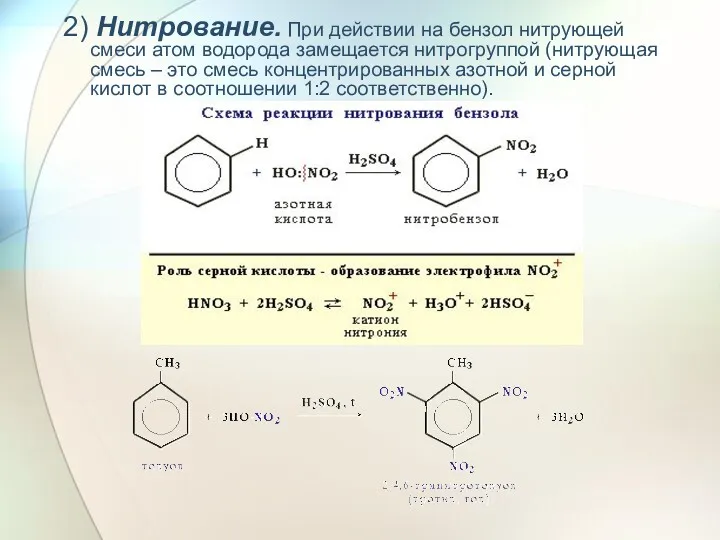
- 24. 2) Нитрование. При действии на бензол нитрующей смеси атом водорода замещается нитрогруппой (нитрующая смесь – это
- 25. 3) Сульфирование осуществляется концентрированной серной кислотой или олеумом. В процессе реакции водородный атом замещается сульфогруппой. C6H6
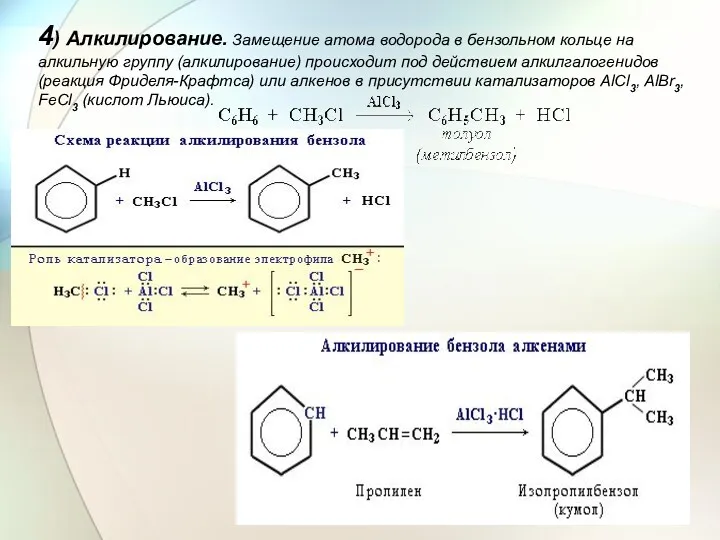
- 26. 4) Алкилирование. Замещение атома водорода в бензольном кольце на алкильную группу (алкилирование) происходит под действием алкилгалогенидов
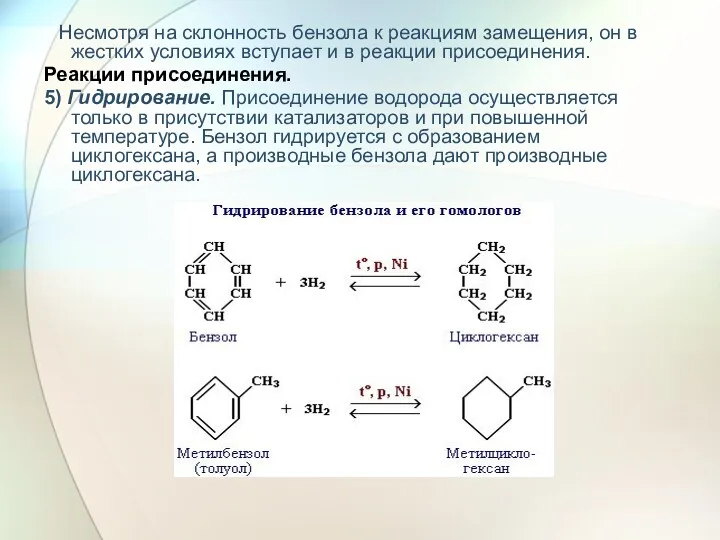
- 27. Несмотря на склонность бензола к реакциям замещения, он в жестких условиях вступает и в реакции присоединения.
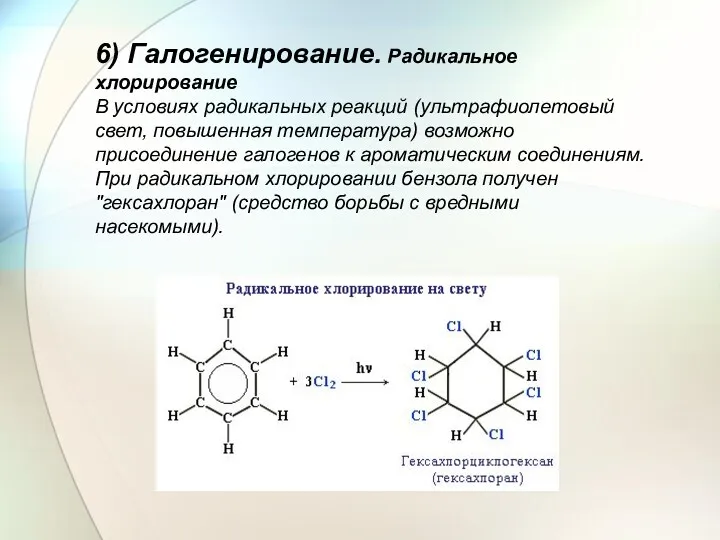
- 28. 6) Галогенирование. Радикальное хлорирование В условиях радикальных реакций (ультрафиолетовый свет, повышенная температура) возможно присоединение галогенов к
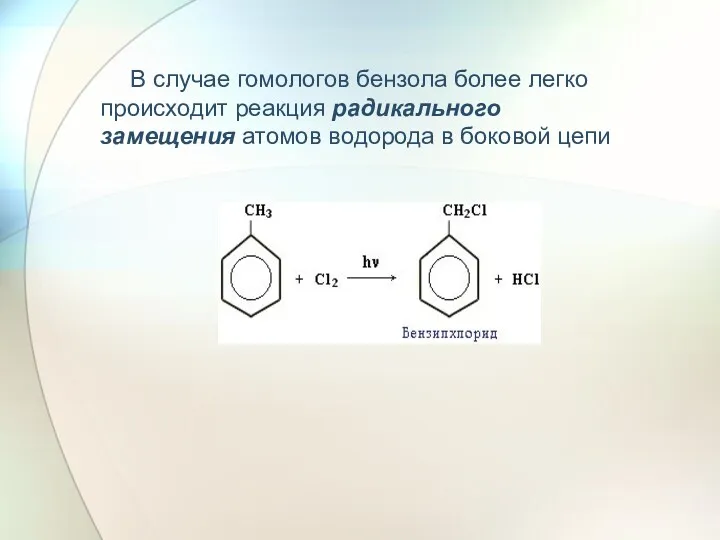
- 29. В случае гомологов бензола более легко происходит реакция радикального замещения атомов водорода в боковой цепи
- 30. Запомните Если в молекуле бензола один из атомов водорода замещен на углеводородный радикал, то в дальнейшем
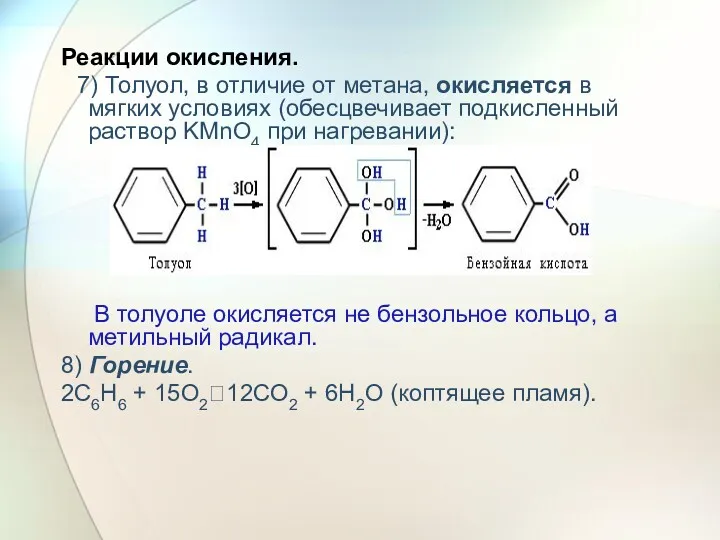
- 31. Реакции окисления. 7) Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4
- 32. 1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной циклизацией (способ Б.А.Казанского и А.Ф.Платэ). Реакция осуществляется
- 33. 3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский). 3C2H2 ––600°C→ C6H6
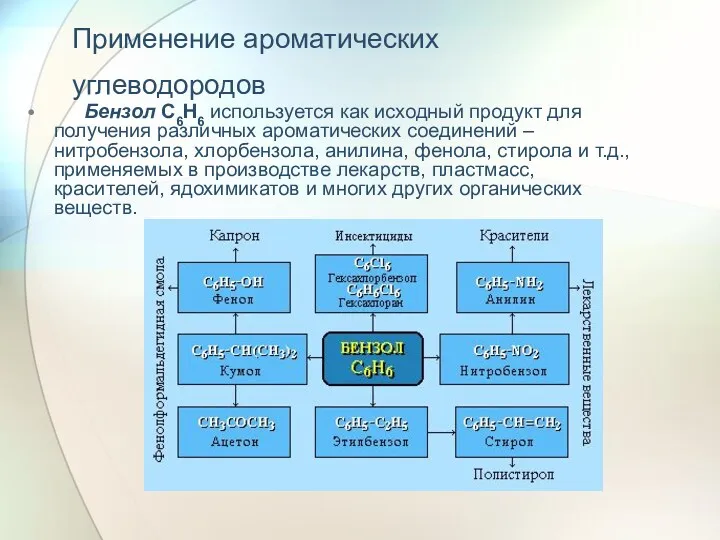
- 34. Применение ароматических углеводородов Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений – нитробензола,
- 36. Скачать презентацию
















 Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Соединения серы
Соединения серы Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1)
Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1) Практична робота 3 Самедова Софія (1)
Практична робота 3 Самедова Софія (1) Летучие яды
Летучие яды Природный каучук
Природный каучук Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Полімери. Природні полімери
Полімери. Природні полімери Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Полиамидные волокна
Полиамидные волокна Синтетические органические вещества
Синтетические органические вещества Теория электролитической диссоциации
Теория электролитической диссоциации Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Классы неорганических соединений
Классы неорганических соединений Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Предмет органической химии
Предмет органической химии Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г
Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г Алкены. Химические свойства алкенов
Алкены. Химические свойства алкенов Хімічні властивості кислот
Хімічні властивості кислот Состав, свойства, виды и способы получения дегтей
Состав, свойства, виды и способы получения дегтей Анализ и синтез химических веществ
Анализ и синтез химических веществ Химическая технология ситаллов и композитов. Прессование
Химическая технология ситаллов и композитов. Прессование Общая характеристика физико-химических методов анализа лекарственных веществ
Общая характеристика физико-химических методов анализа лекарственных веществ Коллигативные свойства растворов неэлектролитов
Коллигативные свойства растворов неэлектролитов Алкены. Пропилен C₃H₆
Алкены. Пропилен C₃H₆ Металлы и их свойства. Способы получения
Металлы и их свойства. Способы получения Химическая термодинамика
Химическая термодинамика