Содержание
- 2. 1 22.09.2016 Урок 9 класса. Степень диссоциации.
- 3. 8 Характерные черты ионов 28.09.2016 К+ ОН – Ba2+ CH3COO- Свойства ионов отличаются от свойств атомов.
- 4. 9 Характерные свойства ионов 28.09.2016 Н+ важный показатель кислотности (вспоминаем определение кислот с прошлого урока). Поэтому
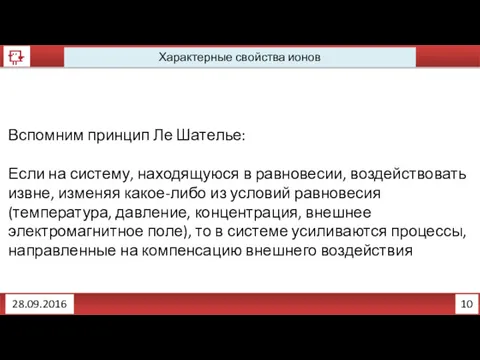
- 5. 10 Характерные свойства ионов 28.09.2016 Вспомним принцип Ле Шателье: Если на систему, находящуюся в равновесии, воздействовать
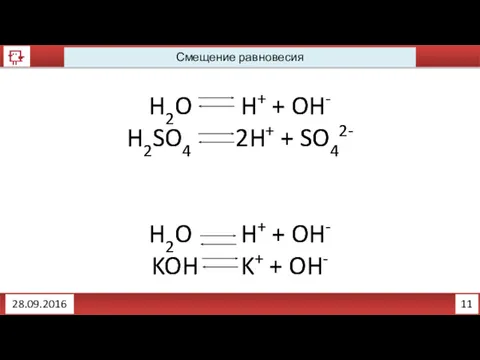
- 6. 11 Смещение равновесия 28.09.2016 H2O H+ + OH- H2SO4 2H+ + SO42- H2O H+ + OH-
- 7. 12 pH 28.09.2016 Когда [H+] > [OH−] говорят, что раствор является кислотным, а при [OH−] >
- 8. 13 Определение кислотности раствора 28.09.2016
- 9. 14 Определение галогенид-ионов 28.09.2016 Галогенид-ионы определяются при взаимодействиями с солями серебра: AgNO3 + KCl = KNO3
- 10. 15 Определение сульфидов 28.09.2016 Качественная реакция на соли меди: Cu2+ +2OH— → Cu(OH)2↓ Качественные реакции на
- 11. 16 Определение бария и сульфитов 28.09.2016 Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли
- 12. 17 Образование алюминатов и цинкатов 28.09.2016 Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓
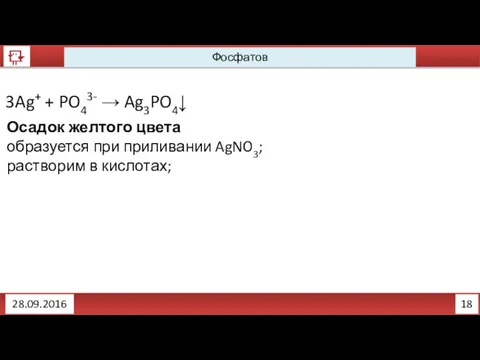
- 13. 18 Фосфатов 28.09.2016 3Ag+ + PO43- → Ag3PO4↓ Осадок желтого цвета образуется при приливании AgNO3; растворим
- 15. Скачать презентацию



![12 pH 28.09.2016 Когда [H+] > [OH−] говорят, что раствор](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/132743/slide-6.jpg)





 Стекловолокно. Что такое стекловолокно?
Стекловолокно. Что такое стекловолокно? Поверхностно-активные вещества и их роль
Поверхностно-активные вещества и их роль Углерод и кремний
Углерод и кремний Железо и его соединения
Железо и его соединения Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Определения оксидов, кислот, оснований, амфотерные и несолеобразующие оксиды
Определения оксидов, кислот, оснований, амфотерные и несолеобразующие оксиды Аналитические химические реакции. Классификация аналитических химических реакций
Аналитические химические реакции. Классификация аналитических химических реакций План характеристики елемента за його положенням у періодичній системі та будовою атома
План характеристики елемента за його положенням у періодичній системі та будовою атома Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8)
Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8)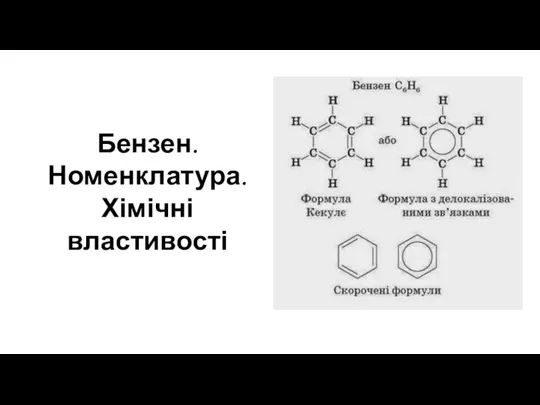 Бензен. Номенклатура. Хімічні властивості
Бензен. Номенклатура. Хімічні властивості Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів
Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів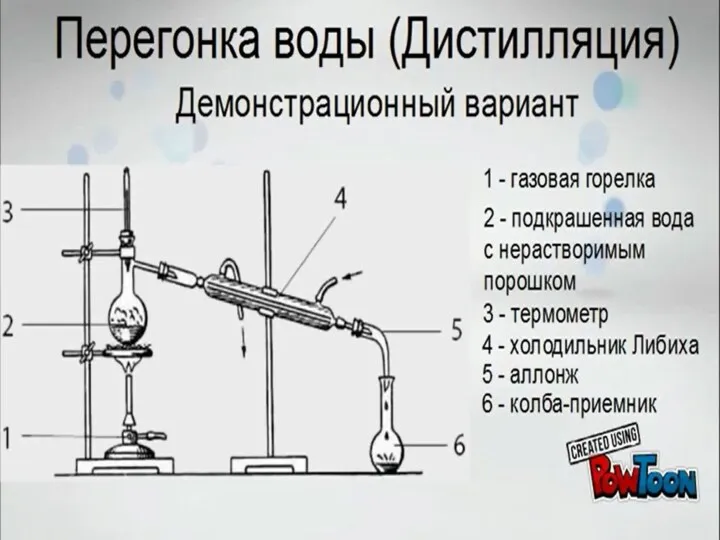 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Простые эфиры
Простые эфиры Беттiк құбылыстар, олардың ағзадағы маңызы. Адсорбция
Беттiк құбылыстар, олардың ағзадағы маңызы. Адсорбция Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ Растворы. Электролитическая диссоциация
Растворы. Электролитическая диссоциация Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства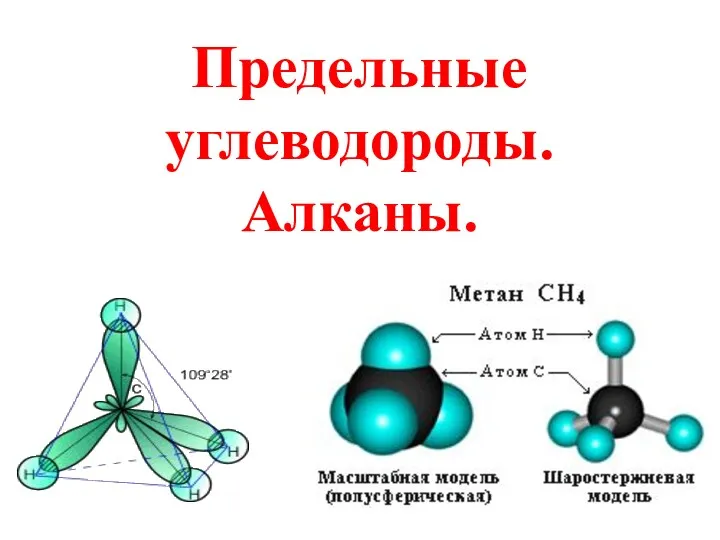 Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер
Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер Аммиак
Аммиак Железо. Физические свойства
Железо. Физические свойства Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Альдегиды и кетоны
Альдегиды и кетоны Скорость химических реакций. Молекулярные гонки
Скорость химических реакций. Молекулярные гонки Аммиак. Состав вещества
Аммиак. Состав вещества Origin of petroleum dilemma
Origin of petroleum dilemma Основные понятия и законы химии
Основные понятия и законы химии