Содержание
- 2. Раздел химии, изучающий скорости и механизмы протекания химических реакций называется химической кинетикой.
- 3. Понятие о скорости химической реакции Скорость реакции определяется изменением концентрации одного из реагирующих веществ или одного
- 4. Понятие о скорости химической реакции Реакции Гомогенные Реакции протекают в однородной среде N2 (газ) + 3H2
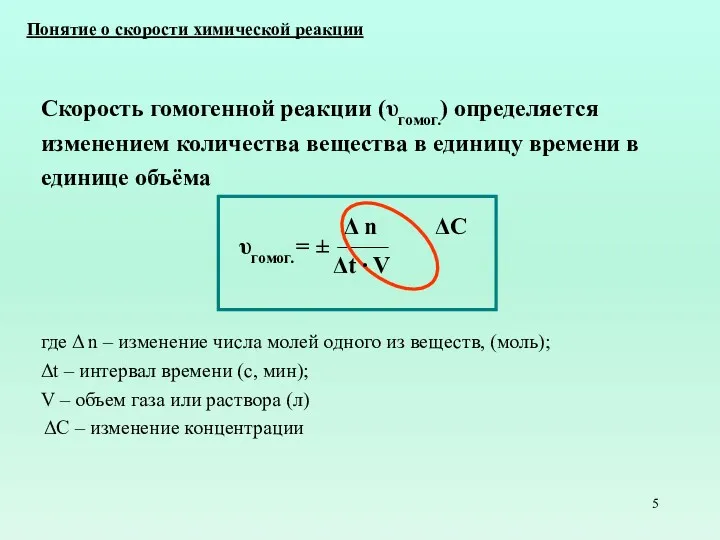
- 5. Скорость гомогенной реакции (υгомог.) определяется изменением количества вещества в единицу времени в единице объёма υгомог. =
- 6. Скорость гетерогенной реакции (υгетер.) определяется изменением количества вещества в единицу времени на единице поверхности соприкосновения веществ
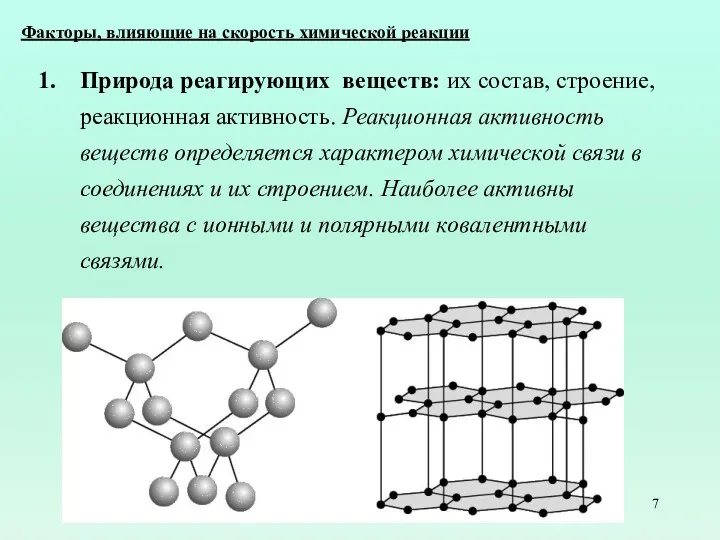
- 7. Факторы, влияющие на скорость химической реакции Природа реагирующих веществ: их состав, строение, реакционная активность. Реакционная активность
- 8. Концентрация: С повышением концентрации реагирующих веществ увеличивается скорость реакции. Факторы, влияющие на скорость химической реакции Закон
- 9. Для реакции mA + nB = C по закону действующих масс: υ = k ∙ СAm
- 10. Задача 1. Реакция идет по уравнению А +2В → С. Во сколько раз и как изменится
- 11. Факторы, влияющие на скорость химической реакции Для газообразных веществ υ . зависит от давления (что аналогично
- 12. 3. Поверхность соприкосновения реагирующих веществ (для гетерогенных реакций) Факторы, влияющие на скорость химической реакции →
- 13. Факторы, влияющие на скорость химической реакции 3. Температура: при повышении температуры на каждые 100 С, скорость
- 14. Дано: υt1 = 1 моль/л ∙ ч γ =3 t1 = 00С t2 = 300С Найти:
- 15. 4. Катализаторы – вещества, ускоряющие химические реакции. А + В → С – протекает медленно А
- 16. «Если ещё на сегодняшний день какая-либо реакция неосуществима это значит, не найден катализатор» А.Н.Несмеянов – выдающийся
- 17. Тест 1. При комнатной температуре с наибольшей скоростью происходит химическая реакция между водой и а) барием;
- 18. Проверь себя! 1. При комнатной температуре с наибольшей скоростью происходит химическая реакция между водой и а)
- 20. Скачать презентацию














 Гидролиз. Применение гидролиза. (11 класс)
Гидролиз. Применение гидролиза. (11 класс) Сероводород. Сульфиды
Сероводород. Сульфиды Растворы. Реакции ионного обмена. Гидролиз солей
Растворы. Реакции ионного обмена. Гидролиз солей Предельные одноатомные спирты
Предельные одноатомные спирты Пластмассы
Пластмассы Вирощення кристталів
Вирощення кристталів Химическая связь
Химическая связь Свойства минералов
Свойства минералов Метал конструкциялық материалдар
Метал конструкциялық материалдар Классы неорганических веществ
Классы неорганических веществ Теория строения органических соединений
Теория строения органических соединений Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази
Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар
Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Фенолы
Фенолы Стирка по научному
Стирка по научному Кислоты. Определение и классификация
Кислоты. Определение и классификация Магматические горные породы
Магматические горные породы Соединения железа
Соединения железа Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Эфирные масла
Эфирные масла Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Классы неорганических соединений
Классы неорганических соединений Предельные углеводороды и их производные
Предельные углеводороды и их производные Кислоты. Классификация кислот, их химические свойства
Кислоты. Классификация кислот, их химические свойства Технологическое проектирование процессов переработки пэн
Технологическое проектирование процессов переработки пэн Электролитическая диссоциация
Электролитическая диссоциация