Содержание
- 2. Что читать? Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Ахметов Н. С. Общая
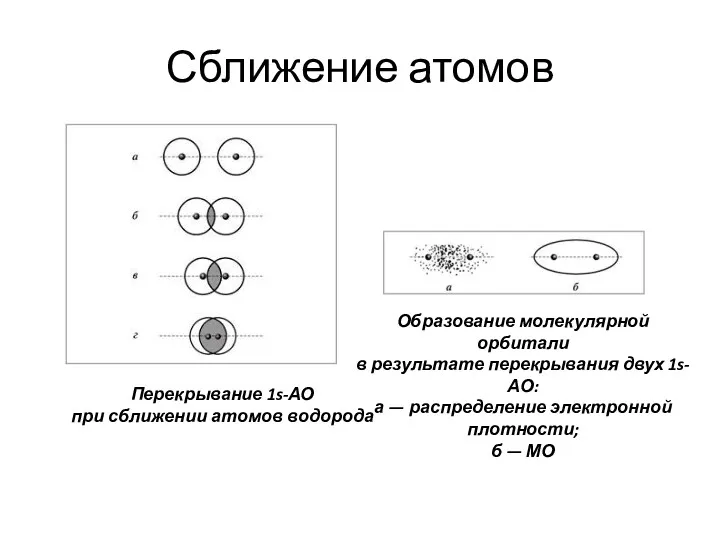
- 3. Сближение атомов Перекрывание 1s-АО при сближении атомов водорода Образование молекулярной орбитали в результате перекрывания двух 1s-АО:
- 4. Кулоновские силы При сближении двух атомов водорода электрон атома A притягивается к ядру атома B, а
- 5. Силы в природе Гравитационное взаимодействие Слабое ядерное взаимодействие Электромагнитное взаимодействие Сильное ядерное взаимодействие При сближении ядер
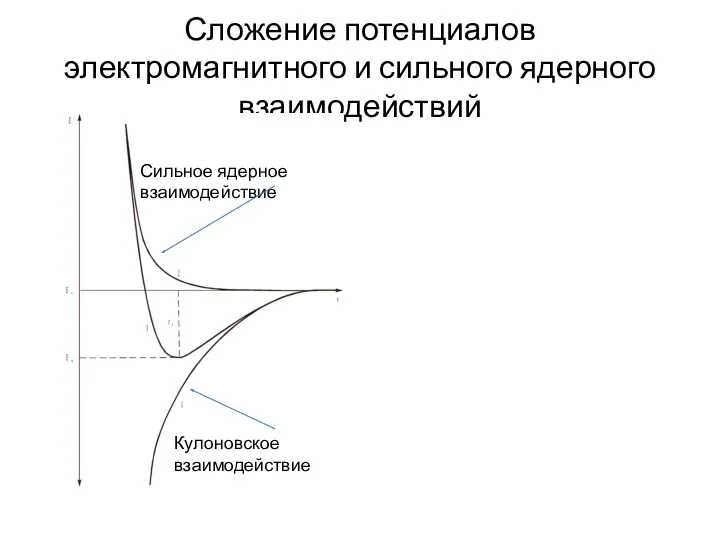
- 6. Сложение потенциалов электромагнитного и сильного ядерного взаимодействий Кулоновское взаимодействие Сильное ядерное взаимодействие
- 7. Уравнение Шредингера энергия связи молекулы водорода для состояний с параллельными и антипараллельными спинами; б - распределение
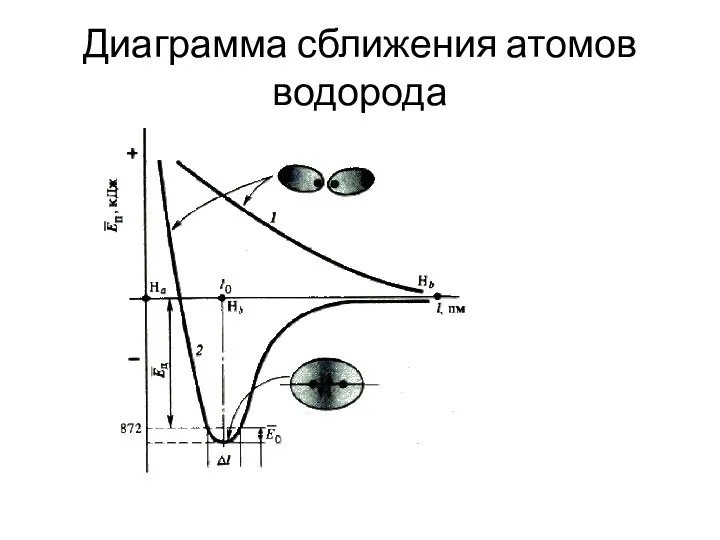
- 8. Диаграмма сближения атомов водорода
- 9. Химическая связь Химическая связь это энергетически выгодное взаимодействие атомов, приводящие к образованию устойчивых групп атомов (молекул).
- 10. Молекула Моле́кула (новолат. molecula, уменьшительное от лат. moles — масса) — электрически нейтральная частица, образованная из
- 11. Таблица типов связи
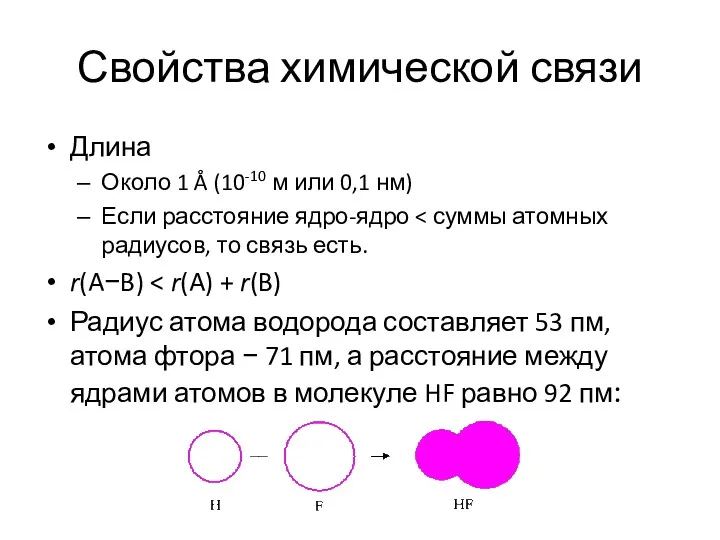
- 12. Свойства химической связи Длина Около 1 Å (10-10 м или 0,1 нм) Если расстояние ядро-ядро r(A−B)
- 13. Прочность энергия гомолитического разрыва. гомо - AB → А + В гетеро - AB → А+
- 14. Ковалентные связи Ковалентные химические связи обычно образуются при обобществлении принадлежащих первоначально разным атомам неспаренных электронов с
- 15. Ковалентные связи Донорно-акцепторный механизм образования ковалентной связи когда один из пары образующих связь атомов предоставляет пару
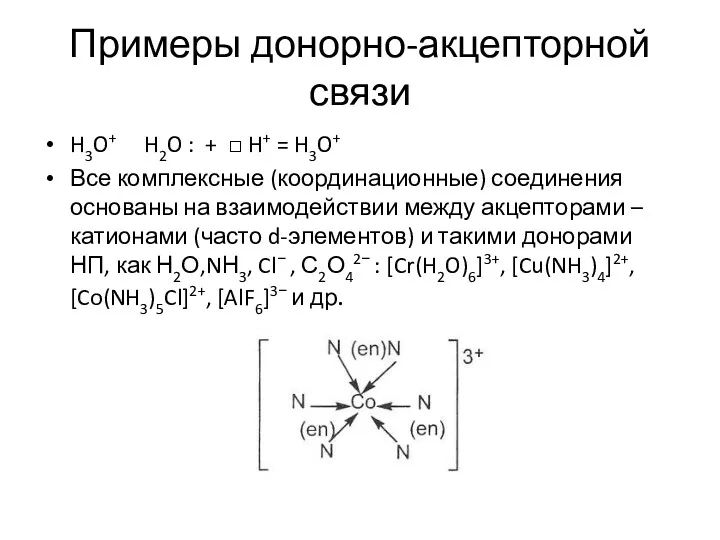
- 16. Примеры донорно-акцепторной связи H3O+ H2O : + □ H+ = H3O+ Все комплексные (координационные) соединения основаны
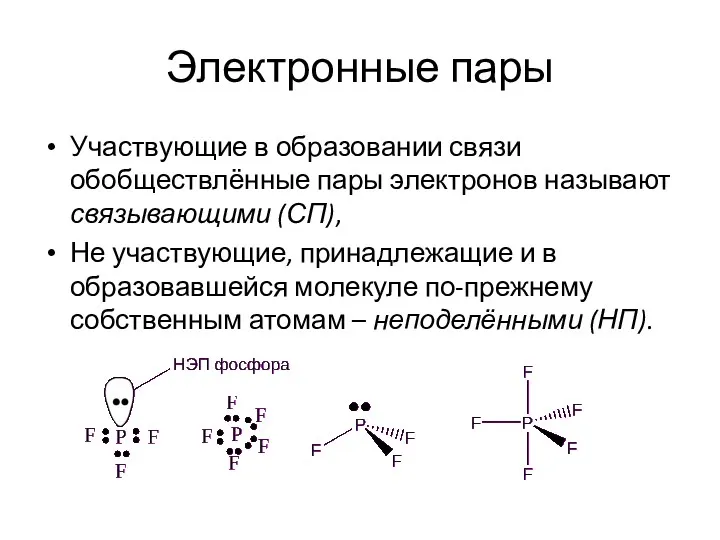
- 17. Электронные пары Участвующие в образовании связи обобществлённые пары электронов называют связывающими (СП), Не участвующие, принадлежащие и
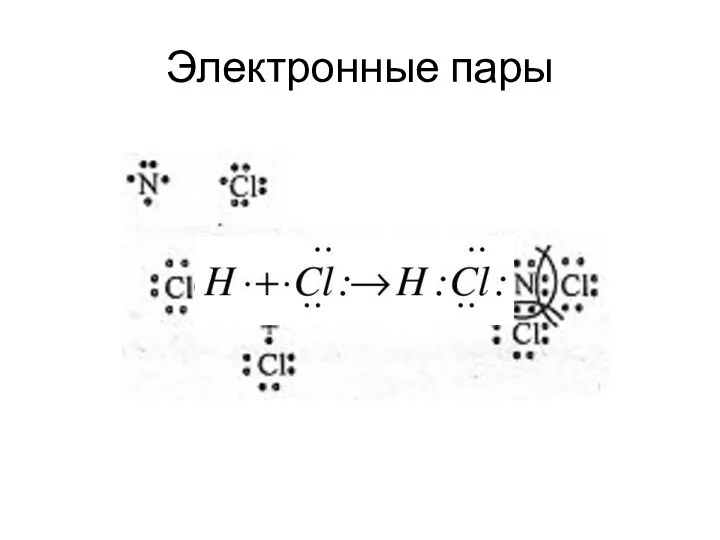
- 18. Электронные пары
- 19. Радикалы Частицы с неспаренными электронами называются радикалами. Примеры радикалов: Н·, Сl·, ·ОН, ·СН3. Стабильные радикалы редки,
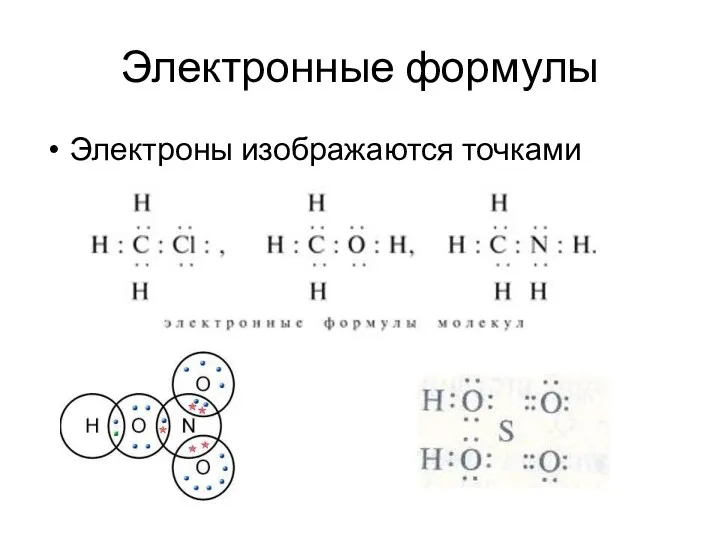
- 20. Электронные формулы Электроны изображаются точками
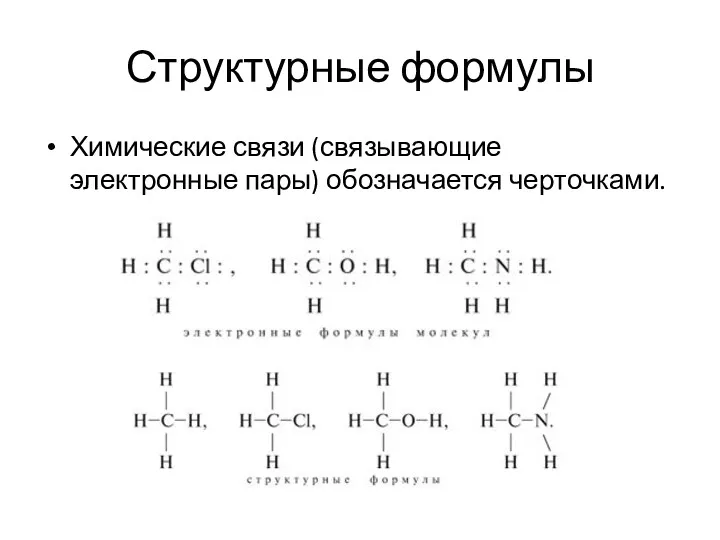
- 21. Структурные формулы Химические связи (связывающие электронные пары) обозначается черточками.
- 22. Стехиометрические формулы В стехиометрических формулах, (HCl, BCl3, H2O, H2S2, SO32– ит. п.), указан только состав частицы
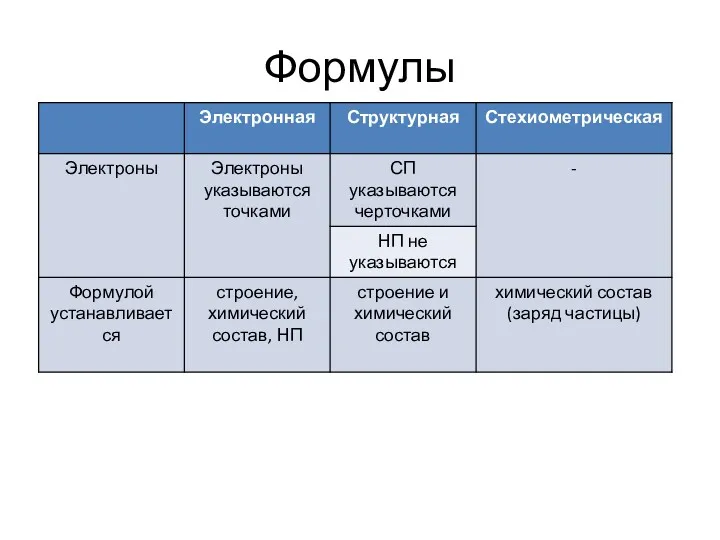
- 23. Формулы
- 24. Химическое соединение Химическое соединение – вещество, состоящее из разных элементов в определенных соотношениях, т.е. имеющее определенный
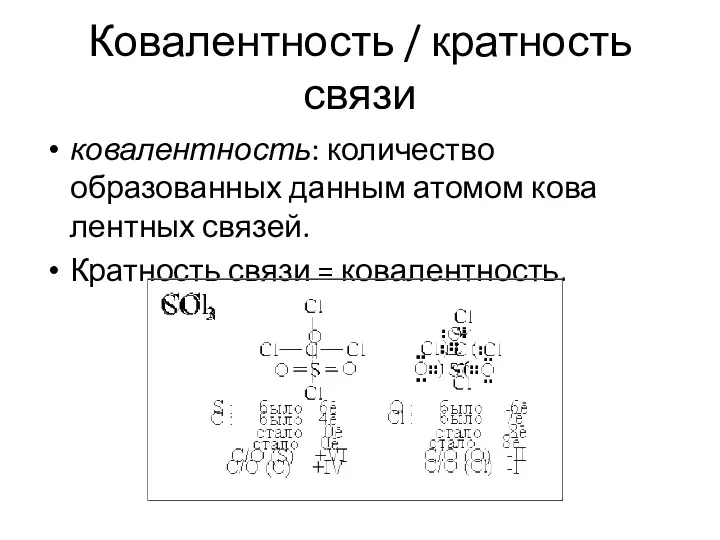
- 25. Ковалентность / кратность связи ковалентность: количество образованных данным атомом ковалентных связей. Кратность связи = ковалентность.
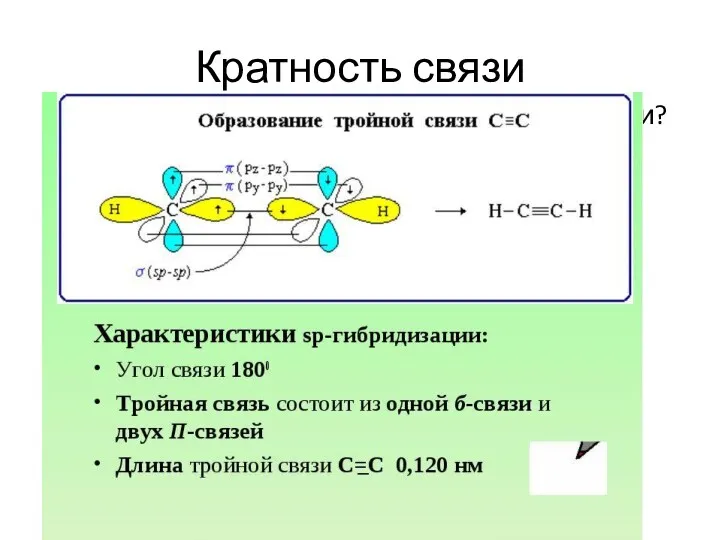
- 26. Кратность связи Откуда так много электронов между атомами? Сигма- и пи- связи (Ϭ- и π-)
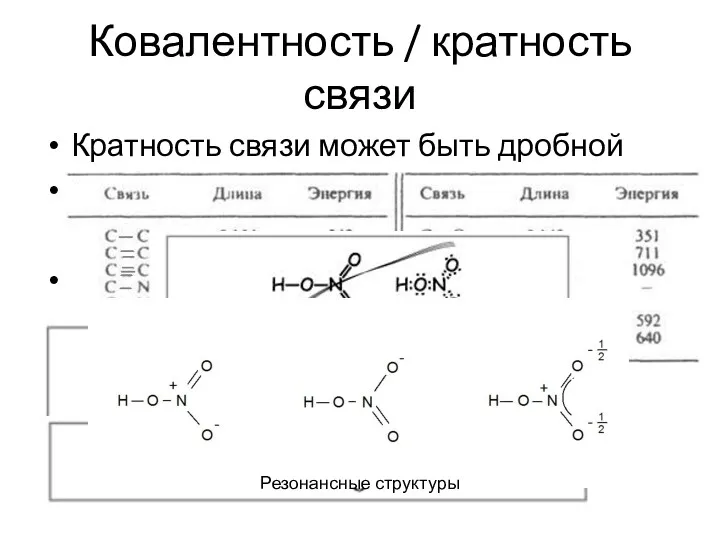
- 27. Ковалентность / кратность связи Кратность связи может быть дробной H2+ H • H+ H … H+
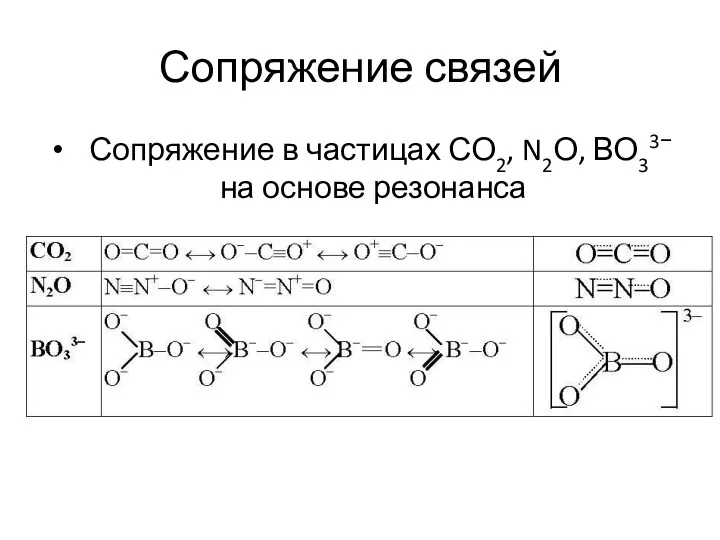
- 28. Сопряжение связей Сопряжение в частицах СО2, N2О, ВО33− на основе резонанса
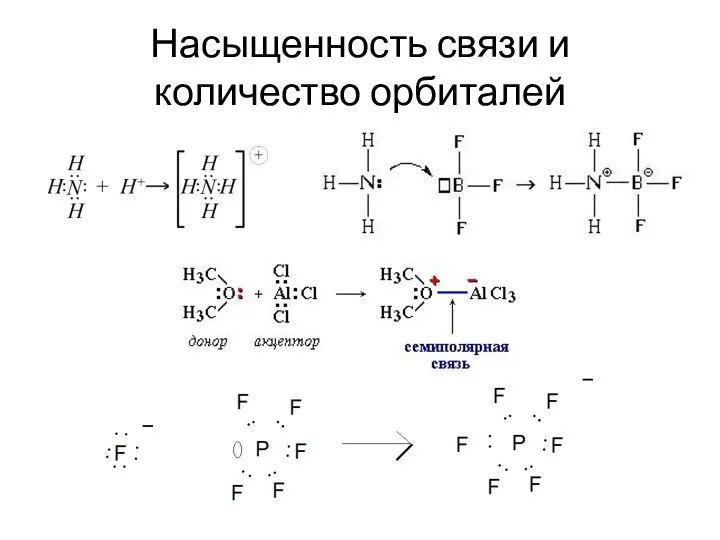
- 29. Насыщенность связи Насыщенность связи - максимально возможная ковалентность/кратность. Определяется: количеством орбиталей. Взаимодействие орбиталей крайне необходимо для
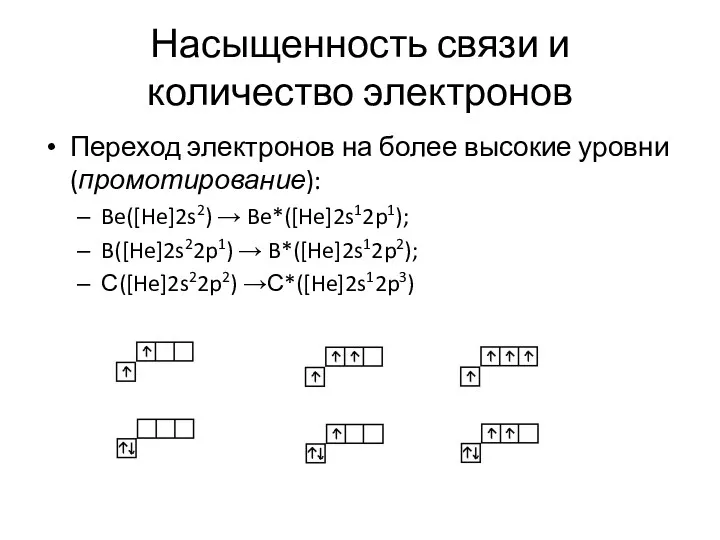
- 30. Насыщенность связи и количество электронов Переход электронов на более высокие уровни (промотирование): Be([He]2s2) → Be*([He]2s12p1); B([He]2s22p1)
- 31. Насыщенность связи и количество электронов N([He]2s22p3) →N*([He]2s12p33s1) Нужно много энергии. Да и валентность 1.
- 32. Насыщенность связи и количество электронов P([Ne]3s23p3) →P*([Ne]3s13p33d1)
- 33. Насыщенность связи и количество электронов O([He]2s22p6) → O*([He]2s12p43s1); F([He]2s22p1) → F*([He]2s12p53s1) Слишком большие энергии. Cl([Ne]3s23p5) →Cl*([Ne]3s13p33d3)
- 34. Насыщенность связи и количество орбиталей
- 35. КЧ Количество ближайших к выделенному атому соседних атомов (ближайших соседей) называют координационным числом(КЧ). Для частиц с
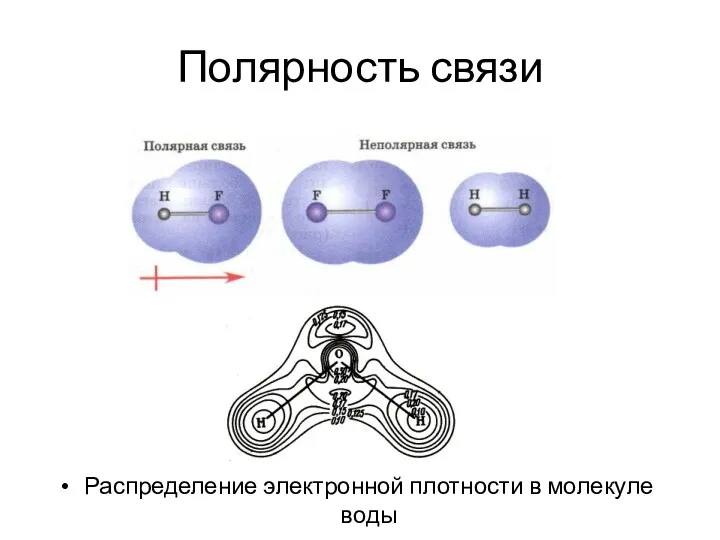
- 36. Полярность связи Распределение электронной плотности в молекуле воды
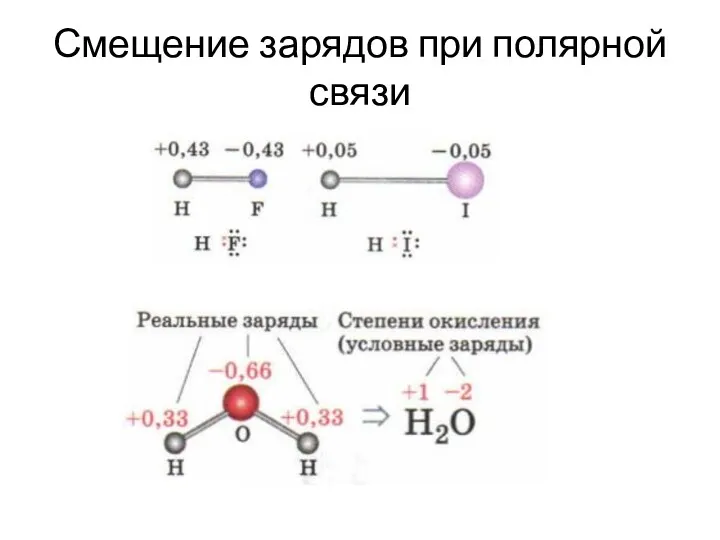
- 37. Смещение зарядов при полярной связи
- 38. Электроотрицательность Кто у кого забирает электроны? Электроотрицательность (ЭО) это свойство атомов оттягивать на себя электронную плотность
- 39. Степень окисления Степень окисления (СО) – условный заряд атома в соединении, если считать все связи полностью
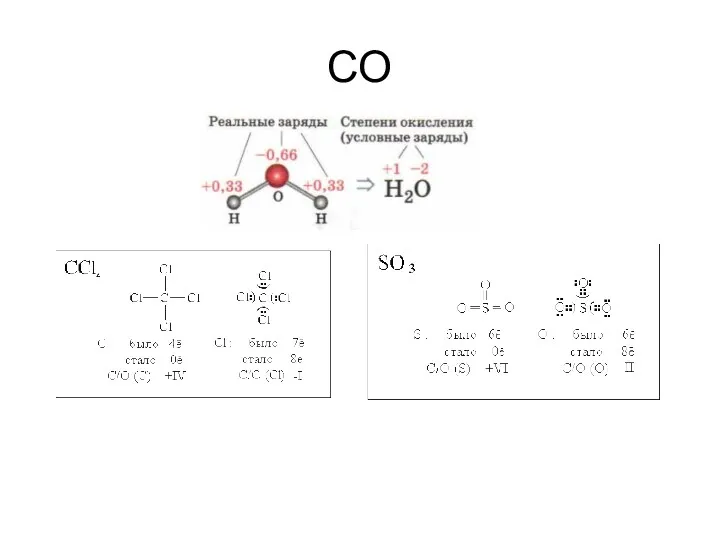
- 40. СО
- 41. Дипольный момент
- 42. Дипольный момент Дипольные моменты молекул обычно измеряют в дебаях (D): 1D = 3,34·10-30 Кл·м.
- 44. Скачать презентацию













![Насыщенность связи и количество электронов N([He]2s22p3) →N*([He]2s12p33s1) Нужно много энергии. Да и валентность 1.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/297843/slide-30.jpg)
![Насыщенность связи и количество электронов P([Ne]3s23p3) →P*([Ne]3s13p33d1)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/297843/slide-31.jpg)
![Насыщенность связи и количество электронов O([He]2s22p6) → O*([He]2s12p43s1); F([He]2s22p1) → F*([He]2s12p53s1) Слишком большие энергии. Cl([Ne]3s23p5) →Cl*([Ne]3s13p33d3)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/297843/slide-32.jpg)





 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Экспериментально исследовательский проект Соль волшебница
Экспериментально исследовательский проект Соль волшебница Химиялық кинетика және химиялық тепе-теңдік
Химиялық кинетика және химиялық тепе-теңдік Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Қалдық мөлшерлер
Қалдық мөлшерлер сложные эфиры
сложные эфиры Закон сохранения массы. Химические уравнения
Закон сохранения массы. Химические уравнения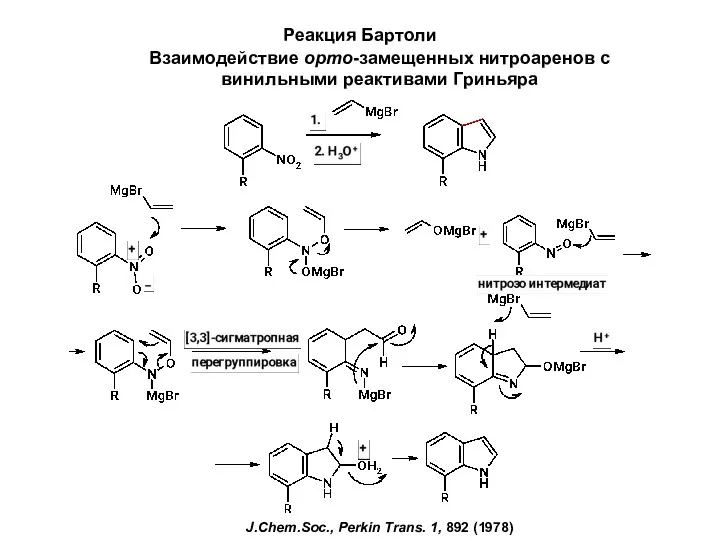 Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра
Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості Химические свойства толуола
Химические свойства толуола Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Определите положение в ПСХЭ элементов
Определите положение в ПСХЭ элементов Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Complex compounds
Complex compounds Химия - тұрмыста
Химия - тұрмыста p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Свойства кислорода. Получение кислорода методом вытеснения воздуха
Свойства кислорода. Получение кислорода методом вытеснения воздуха Самородные элементы
Самородные элементы Товары бытовой химии
Товары бытовой химии Реакції йонного обміну між електролітами у водних розчинах
Реакції йонного обміну між електролітами у водних розчинах Вода – растворитель. Растворы. Значение воды
Вода – растворитель. Растворы. Значение воды Окислительно-восстановительные реакции. (лекция №10)
Окислительно-восстановительные реакции. (лекция №10) Узагальнення й систематизація знань з теми Початкові хімічні поняття (1 частина)
Узагальнення й систематизація знань з теми Початкові хімічні поняття (1 частина) Виды присадок к моторным топливам (керосин)
Виды присадок к моторным топливам (керосин) Сера и ее соединения
Сера и ее соединения Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Последствия применения удобрений в сельском хозяйстве
Последствия применения удобрений в сельском хозяйстве