Слайд 2

Вещества
Электролиты – это вещества, растворы или расплавы которых проводят электрический ток.
Неэлектролиты
– это вещества, растворы или расплавы которых не проводят электрический ток.
Слайд 3

Неэлектролитами являются вещества с неполярными или слабополярными ковалентными связями. К ним
относится большинство органических соединений (глюкоза, фруктоза, сахароза, этанол, глицерин и др.), простые вещества-неметаллы (сера, алмаз, азот, кислород и др.).
Слайд 4

Шведский учёный С. Аррениус обнаружил, что растворы, проводящие электрический ток, содержат
больше частиц, чем можно было бы ожидать исходя из количества растворённого вещества. Так, если в воде растворить 1 моль хлорида натрия , то общее число частиц в растворе будет в 2 раза больше. Это позволило Аррениусу сделать вывод о том, что при растворении соли в воде появляются свободные ионы.
Слайд 5

Ионы – это…
Приведите пример ионов.
Слайд 6

Катионы
- это положительно заряженные ионы
Пример:
H+
K+
Ca+
Слайд 7

Анионы
- это отрицательно заряженные ионы
Пример:
OH-
Cl-
SO4(2-)
Слайд 8

Электролитическая
диссоциация
процесс распада вещества на ионы при растворении или при плавлении.
Слайд 9
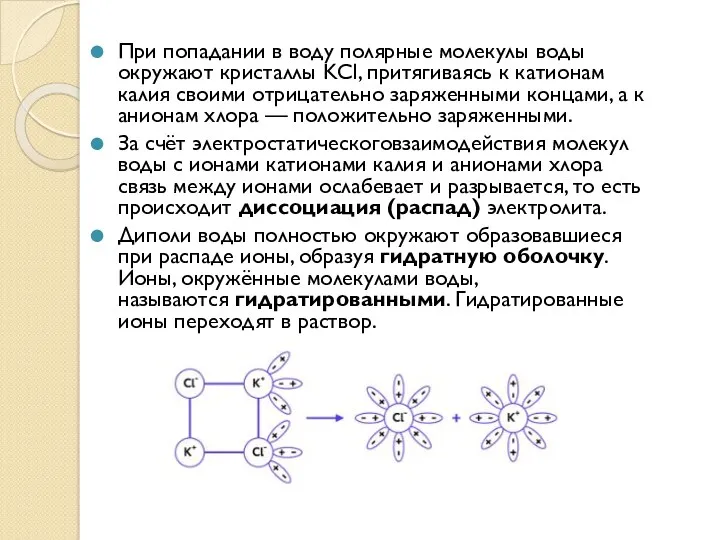
При попадании в воду полярные молекулы воды окружают кристаллы KCl, притягиваясь
к катионам калия своими отрицательно заряженными концами, а к анионам хлора — положительно заряженными.
За счёт электростатическоговзаимодействия молекул воды с ионами катионами калия и анионами хлора связь между ионами ослабевает и разрывается, то есть происходит диссоциация (распад) электролита.
Диполи воды полностью окружают образовавшиеся при распаде ионы, образуя гидратную оболочку. Ионы, окружённые молекулами воды, называются гидратированными. Гидратированные ионы переходят в раствор.
Слайд 10
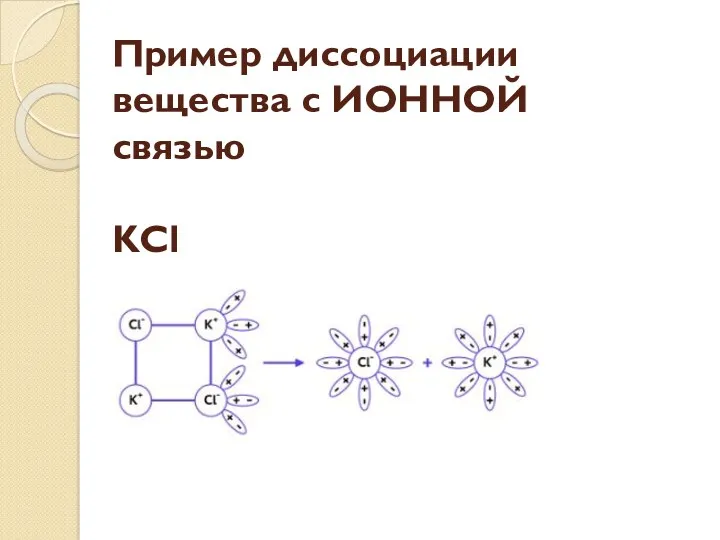
Пример диссоциации вещества с ИОННОЙ связью
KCl
Слайд 11
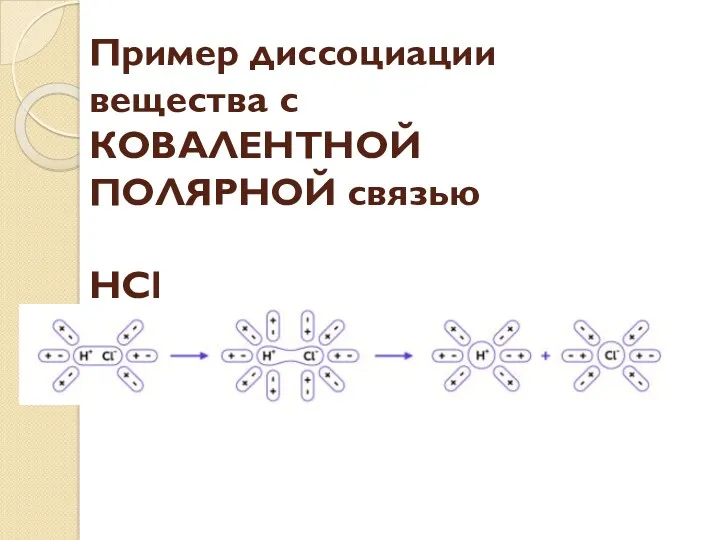
Пример диссоциации вещества с КОВАЛЕНТНОЙ ПОЛЯРНОЙ связью
HCl
Слайд 12

Теория электролитической диссоциации
При растворении в воде электролиты диссоциируют (распадаются) на ионы.
Причиной
диссоциации электролита в водном растворе является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нём.
Под действием электрического тока катионы движутся к отрицательному полюсу источника тока — катоду, а анионы — к положительному полюсу источника тока — аноду.
Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Слайд 13

Степень диссоциации «α»
отношение числа молей электролита, распавшихся на ионы Nдис, к общему числу
молей электролита в растворе Nобщ.
Слайд 14

Степень диссоциации зависит от природы электролита, его концентрации, природы растворителя, температуры.
Степень
диссоциации может изменяться от 0 до 1, т. е. от 0 до 100%. Если степень диссоциации равна 0%, это означает, что диссоциации вещества не происходит. Если степень диссоциации равна 100%, это означает, что вещество полностью диссоциирует на ионы.
В зависимости от значения степени диссоциации различают сильные и слабые электролиты.
Слайд 15

Сильными
называются электролиты, степень диссоциации которых больше 0,3
(α ˃30 %).
К сильным электролитам относятся:
почти
все соли;
сильные кислоты (HCl, HNO3, HI, HClO3 и др.);
сильные основания (щёлочи, LiOH, NaOH, KOH).
Слайд 16

Слабыми
называются электролиты, степень диссоциации которых меньше 0,03
(α ˂3 %).
К слабым электролитам относятся:
вода;
слабые
кислоты (H2CO3, H2S органические кислоты CH3COOH и др.);
NH3*H2O, нерастворимые основания (Zn(OH)2 и др.).
Слайд 17

Диссоциация сильного электролита протекает необратимо, поэтому в уравнении диссоциации ставится знак
равенства «=», например:
KOH = K+ + OH-
Сильный электролит диссоциирует обратимо только в насыщенном растворе, где существует равновесие между кристаллом соли и гидратированными ионами в растворе
Слайд 18

Слабые электролиты диссоциируют обратимо, в уравнении их диссоциации ставится знак обратимости
«˂---˃», например:
HNO2 ˂---˃ H+ + NO2-
Слайд 19

Степень диссоциации зависит от природы электролита, природы растворителя и от концентрации
электролита. С уменьшением концентрации электролита (при разбавлении раствора) степень диссоциации возрастает. Нагревание способствует увеличению степени диссоциации.


















 Строительное материаловедение. Лекция 1
Строительное материаловедение. Лекция 1 Адсорбция. Раздел III
Адсорбция. Раздел III D-элементы VII-В группы. Марганец
D-элементы VII-В группы. Марганец Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе Электролитическая диссоциация химических элементов
Электролитическая диссоциация химических элементов Методы прямого секвенирования белков (пептидов)
Методы прямого секвенирования белков (пептидов) Безазотистые вторичные метаболиты минорных групп в фармации. Биохимия, функциональное значение в царстве растений
Безазотистые вторичные метаболиты минорных групп в фармации. Биохимия, функциональное значение в царстве растений Химический элемент радон
Химический элемент радон Значення хімії у розв’ язанні енергетичної проблеми
Значення хімії у розв’ язанні енергетичної проблеми Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Что нас объединяет?
Что нас объединяет? Основные понятия и законы химии
Основные понятия и законы химии Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Классификация и свойства кислот
Классификация и свойства кислот Взрывоопасные грузы
Взрывоопасные грузы Пластмаси, синтетичні каучуки, гума, штучні й синтетичні
Пластмаси, синтетичні каучуки, гума, штучні й синтетичні Незвичайна вода
Незвичайна вода Химическое равновесие
Химическое равновесие Ароматические соединения (арены)
Ароматические соединения (арены) Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Кислотно-основное титрование. Алкалиметрия
Кислотно-основное титрование. Алкалиметрия Классы неорганических веществ
Классы неорганических веществ Кристаллохимия как наука
Кристаллохимия как наука Одноатомные спирты. Простые эфиры
Одноатомные спирты. Простые эфиры Окисление перманганатом и бихроматом калияорганических соединений. Уровень ЕГЭ
Окисление перманганатом и бихроматом калияорганических соединений. Уровень ЕГЭ Видалення забруднень органічного походження з поверхні тканини
Видалення забруднень органічного походження з поверхні тканини Чистые вещества и смеси
Чистые вещества и смеси Термодинамика химического равновесия
Термодинамика химического равновесия