Содержание
- 2. Специфические окислители CuO окисляет первичные и вторичные спирты спирты при нагревании. t Аммиачный раствор оксида серебра.
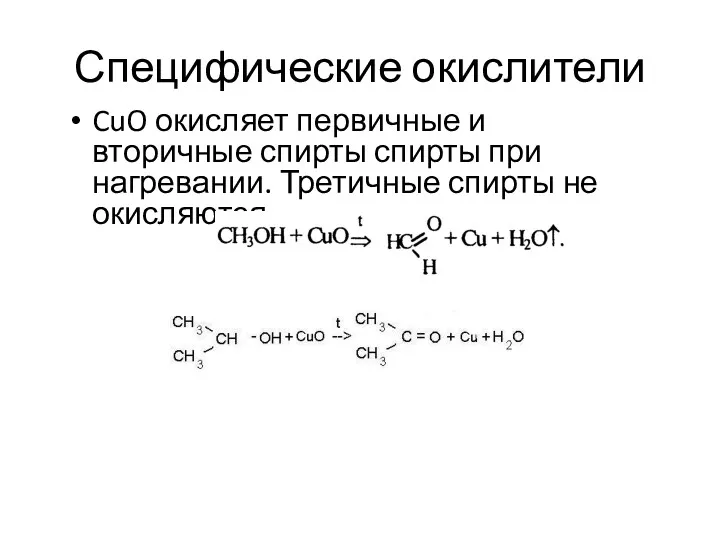
- 3. Специфические окислители CuO окисляет первичные и вторичные спирты спирты при нагревании. Третичные спирты не окисляются.
- 4. Взаимодействие альдегидов с гидроксидом меди. СH3-CH2-CH2-CH=O + Cu(OH)2 → СH3-CH2-CH2-COH=O + Cu2O + H2O
- 5. Конечные продукты окисления KMnO4
- 6. Что представляют собой «жёсткие условия»? Кислая или сильнощелочная среда даже без нагревания. Нейтральная или слабощелочная среда,
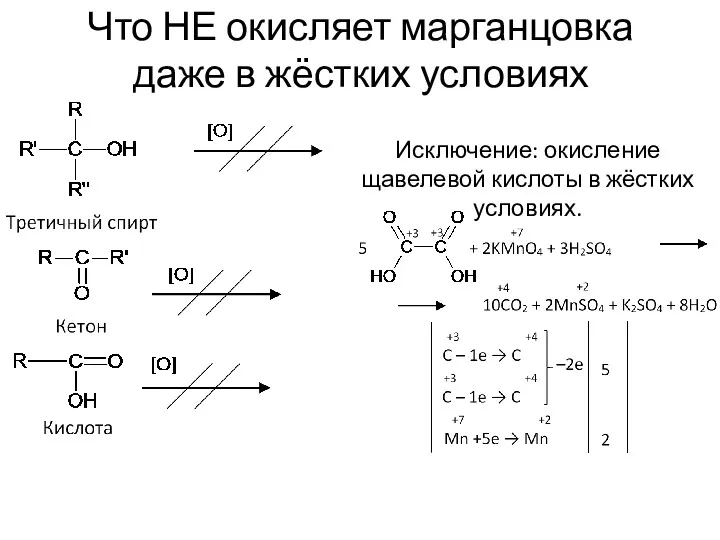
- 7. Что НЕ окисляет марганцовка даже в жёстких условиях Исключение: окисление щавелевой кислоты в жёстких условиях.
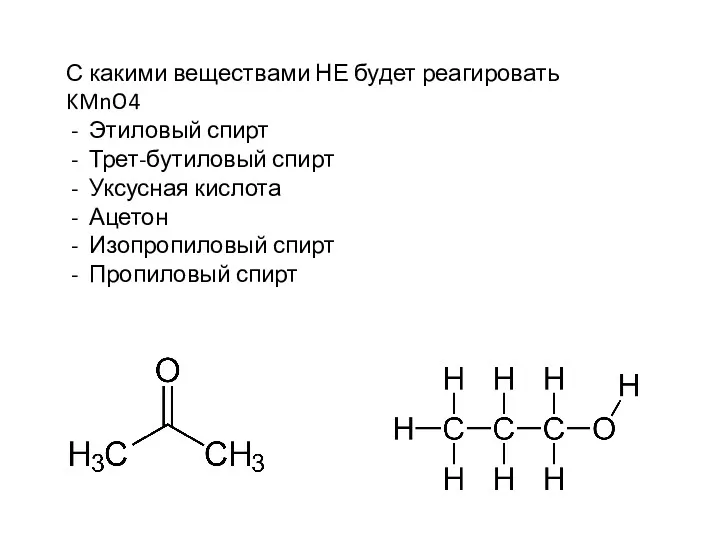
- 8. С какими веществами НЕ будет реагировать KMnO4 Этиловый спирт Трет-бутиловый спирт Уксусная кислота Ацетон Изопропиловый спирт
- 9. Что НЕ окисляет марганцовка в мягких условиях кроме того, что она НЕ окисляет в жёстких условиях
- 10. Что может окислять марганцовка? Первичный спирт окисляется сначала до альдегида, потом до карбоновой кислоты: Окисление вторичного
- 11. Как окисляет марганцовка двойные и тройные связи в углеводородах в мягких условиях Двойные связи до двухатомных
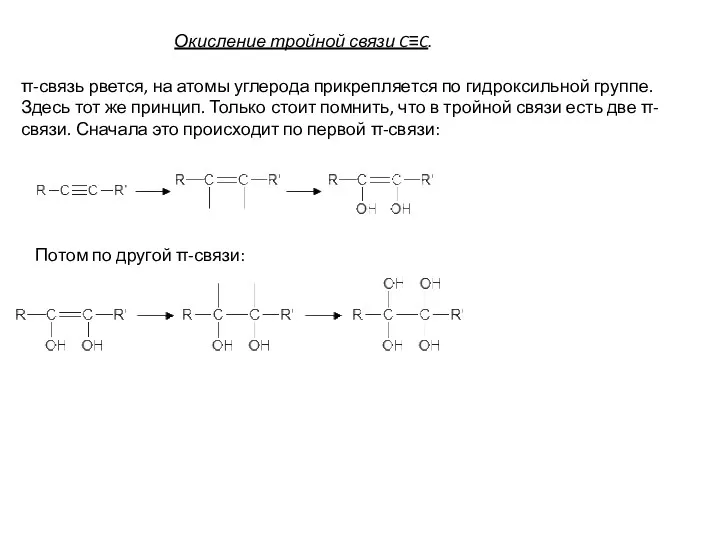
- 12. Окисление тройной связи C≡C. π-связь рвется, на атомы углерода прикрепляется по гидроксильной группе. Здесь тот же
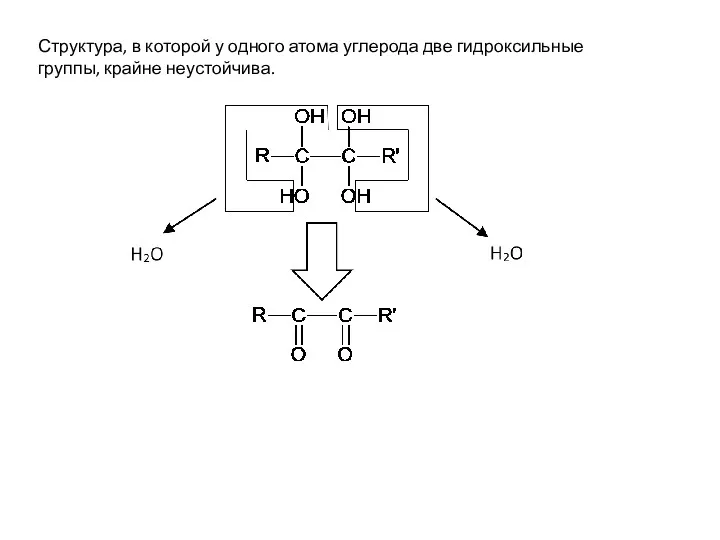
- 13. Структура, в которой у одного атома углерода две гидроксильные группы, крайне неустойчива.
- 14. СH3-CH=CH2 → [O] Тренировка. Как происходит окисление марганцовкой в мягких условиях CH2=CH-CH2-CH3 CH3-CH=CH-CH3
- 15. Как окисляет марганцовка двойные и тройные связи в углеводородах в жёстких условиях Этилен и ацетилен до
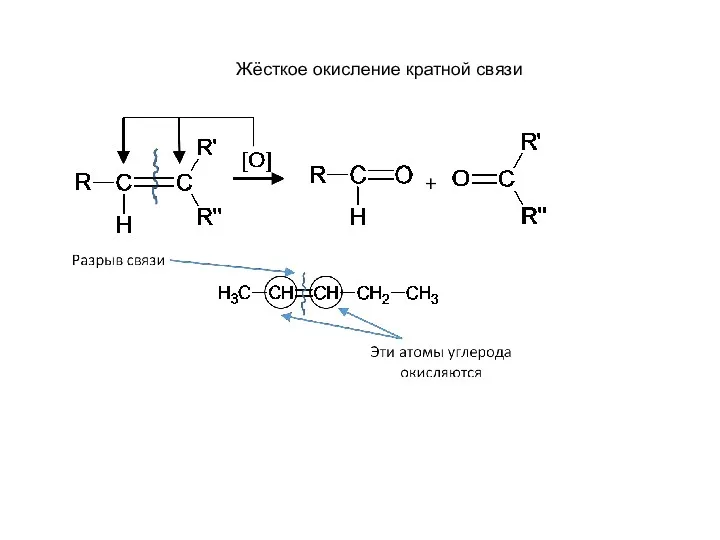
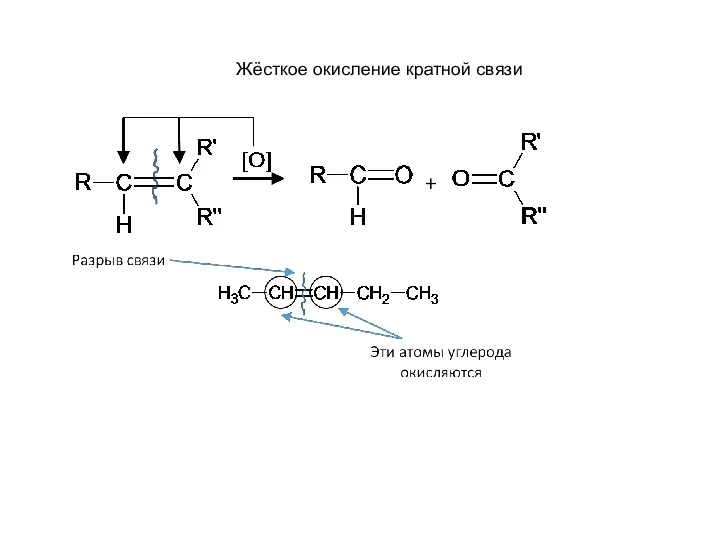
- 16. Жёсткое окисление кратной связи
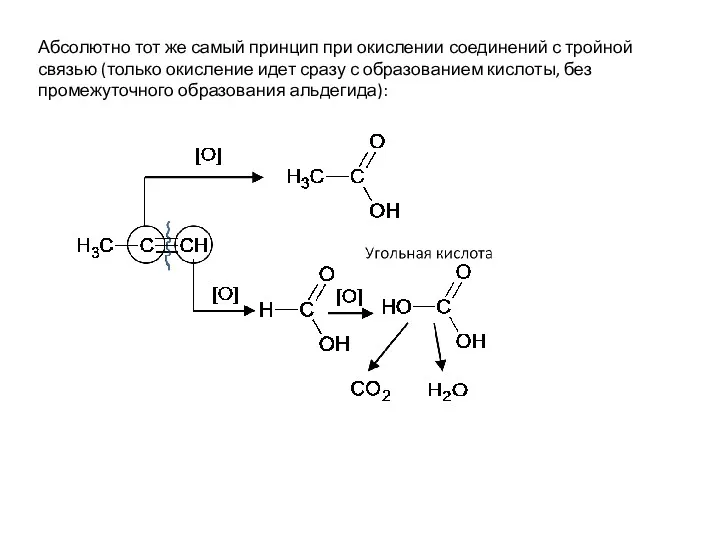
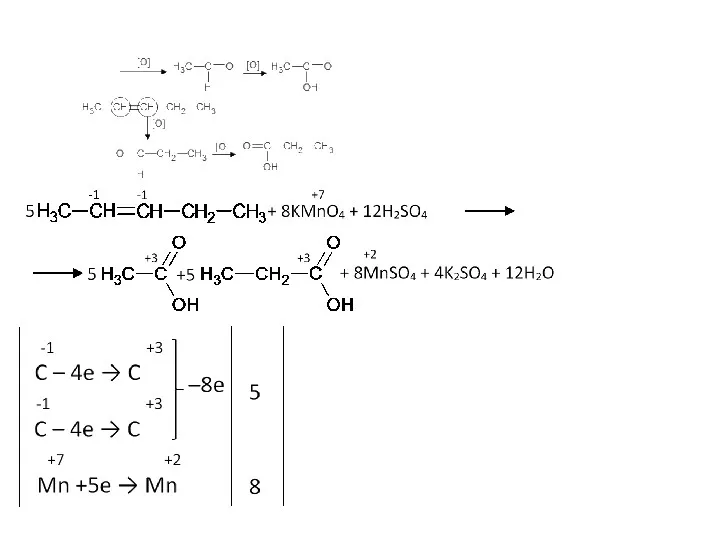
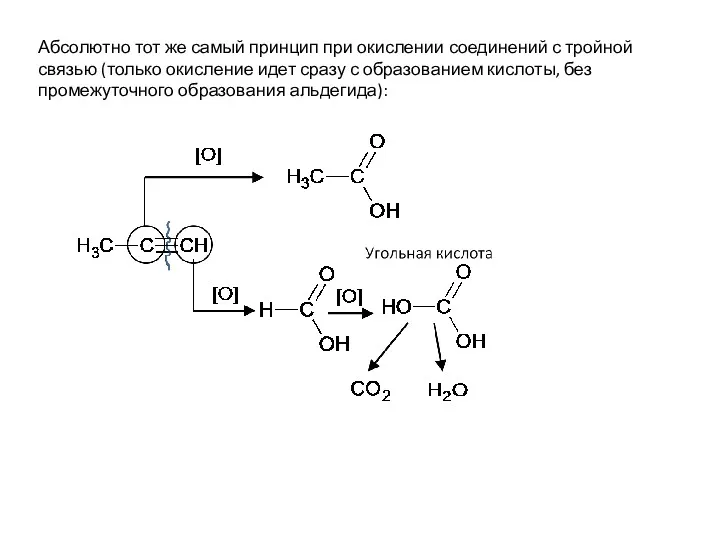
- 19. Абсолютно тот же самый принцип при окислении соединений с тройной связью (только окисление идет сразу с
- 21. Закрепим на практике теорию Вернёмся к мягкому окислению.
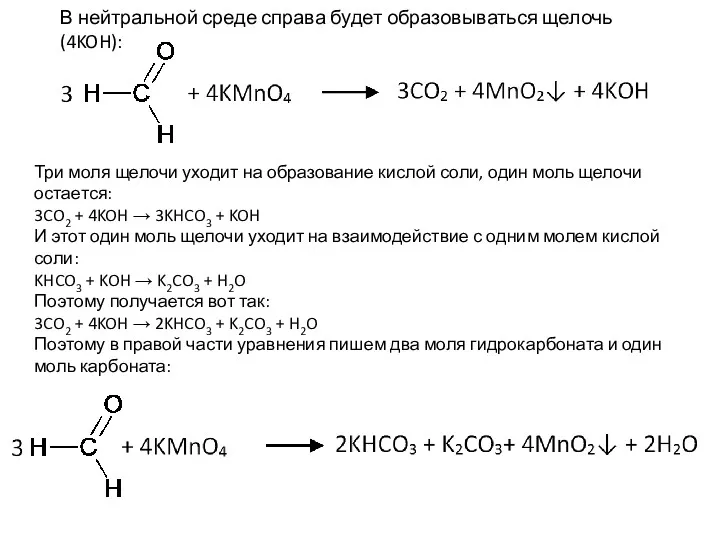
- 22. В нейтральной среде справа будет образовываться щелочь (4KOH): Три моля щелочи уходит на образование кислой соли,
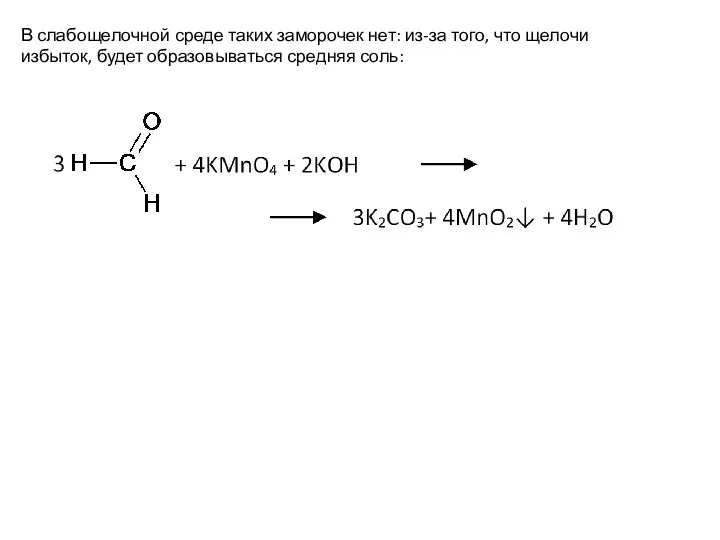
- 23. В слабощелочной среде таких заморочек нет: из-за того, что щелочи избыток, будет образовываться средняя соль:
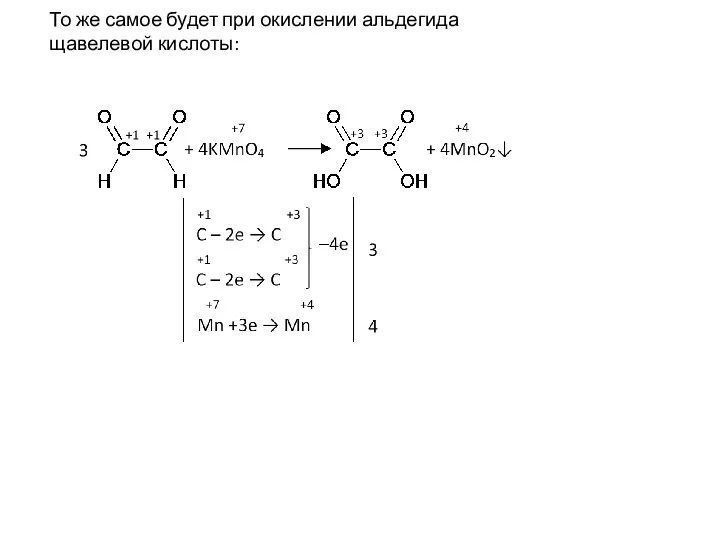
- 24. То же самое будет при окислении альдегида щавелевой кислоты:
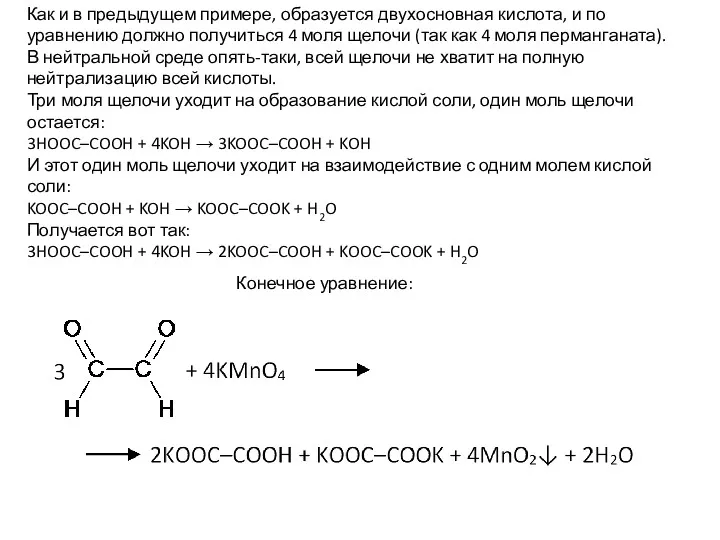
- 25. Как и в предыдущем примере, образуется двухосновная кислота, и по уравнению должно получиться 4 моля щелочи
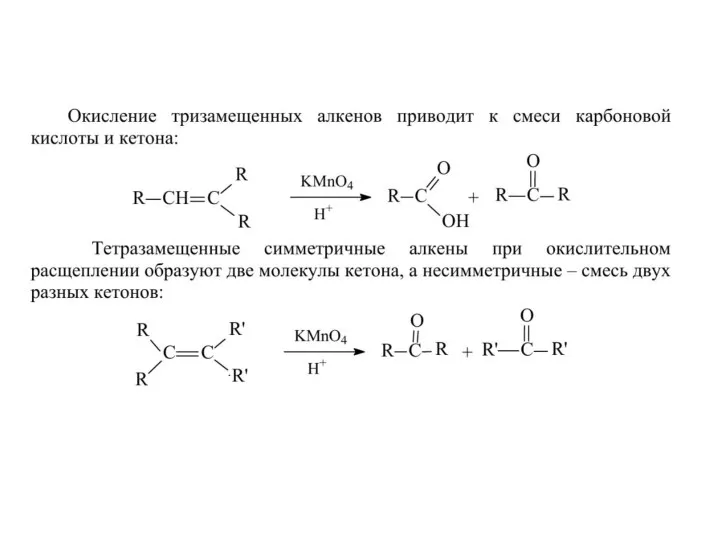
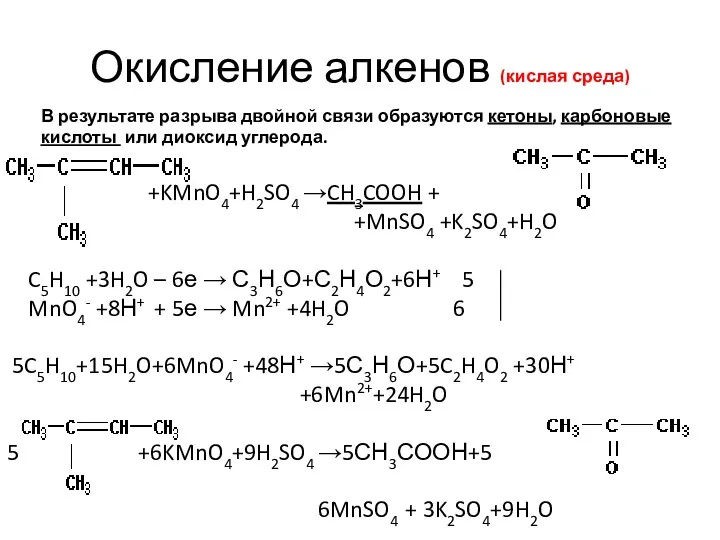
- 26. Окисление алкенов (кислая среда) В результате разрыва двойной связи образуются кетоны, карбоновые кислоты или диоксид углерода.
- 27. Окисление алкенов (кислая среда) В результате разрыва двойной связи образуются кетоны, карбоновые кислоты или диоксид углерода.
- 28. Окисление алкенов (кислая среда) В результате разрыва двойной связи образуются кетоны, карбоновые кислоты или диоксид углерода.
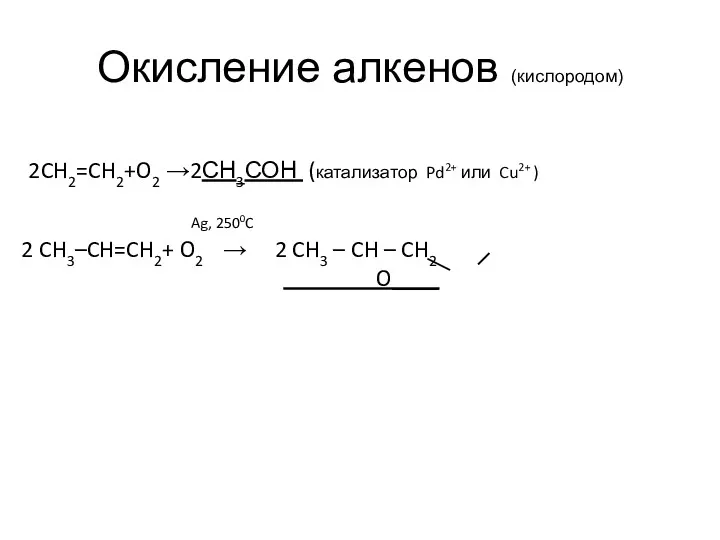
- 29. Окисление алкенов (кислородом) 2CH2=CH2+O2 →2СН3СОН (катализатор Pd2+ или Cu2+ ) Ag, 2500C 2 CH3–CH=CH2+ O2 →
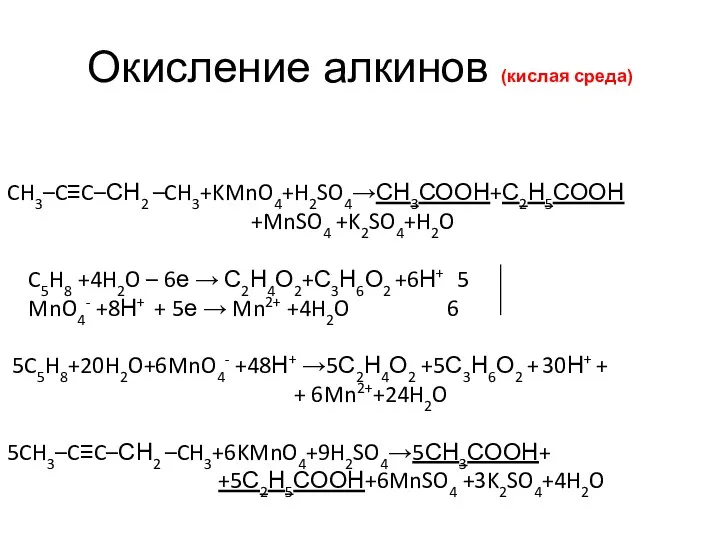
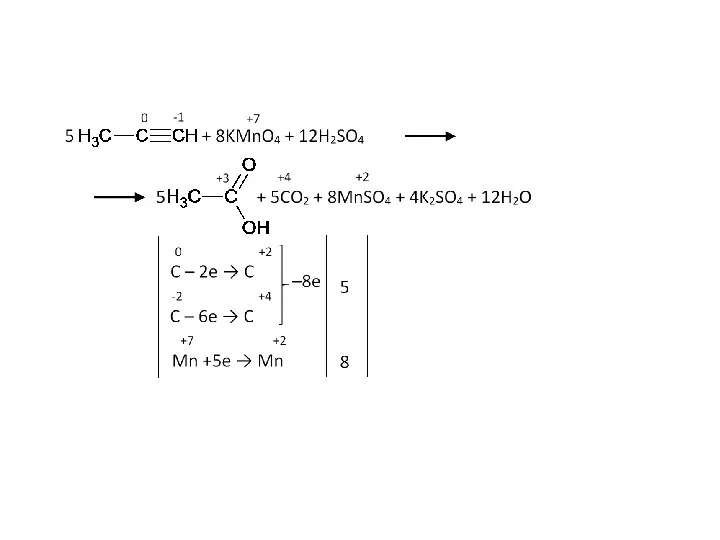
- 30. Окисление алкинов (кислая среда) CH3–C≡C–СН2 –CH3+KMnO4+H2SO4→СН3СООН+С2Н5СООН +MnSO4 +K2SO4+H2O C5H8 +4H2O – 6е → С2Н4О2+С3Н6О2 +6Н+ 5
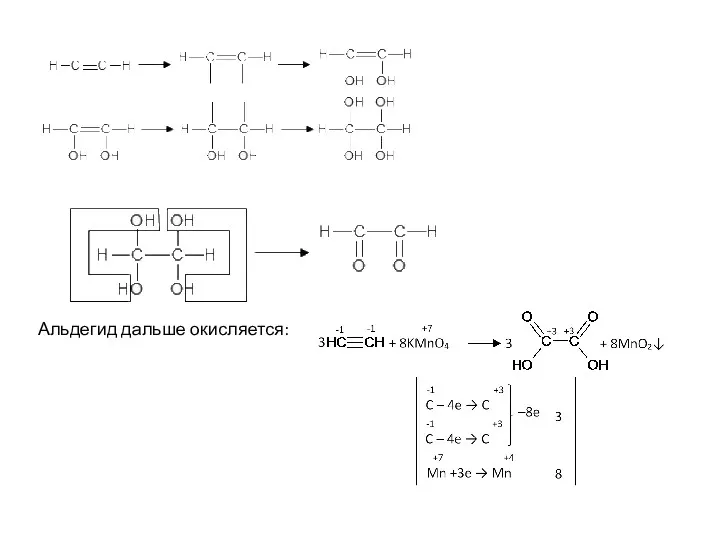
- 31. Альдегид дальше окисляется:
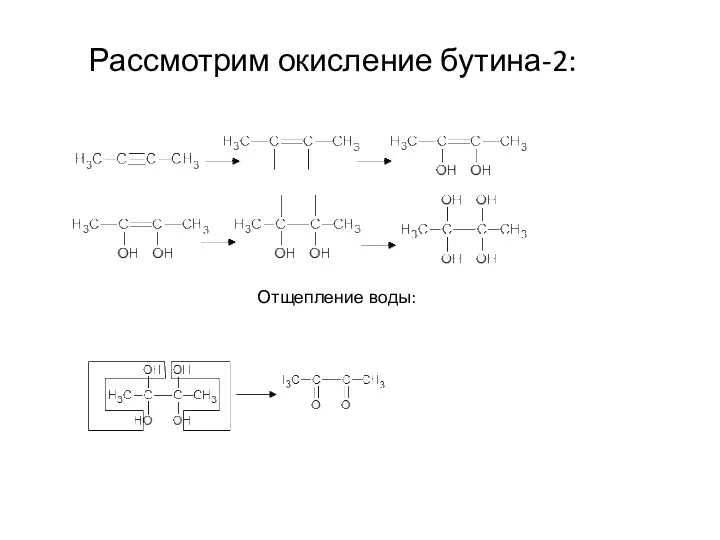
- 32. Рассмотрим окисление бутина-2: Отщепление воды:
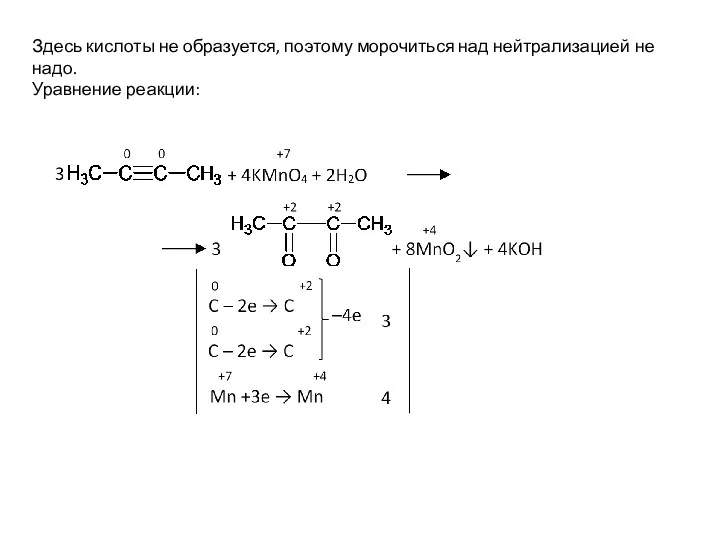
- 33. Здесь кислоты не образуется, поэтому морочиться над нейтрализацией не надо. Уравнение реакции:
- 34. Вывод: окисление алкенов в нейтральный и слабощелочных условиях перманганатом Углерод с тройной связью окисляется: · До
- 35. Задача. Как окислится пропин в кислой среде перманганатом калия?
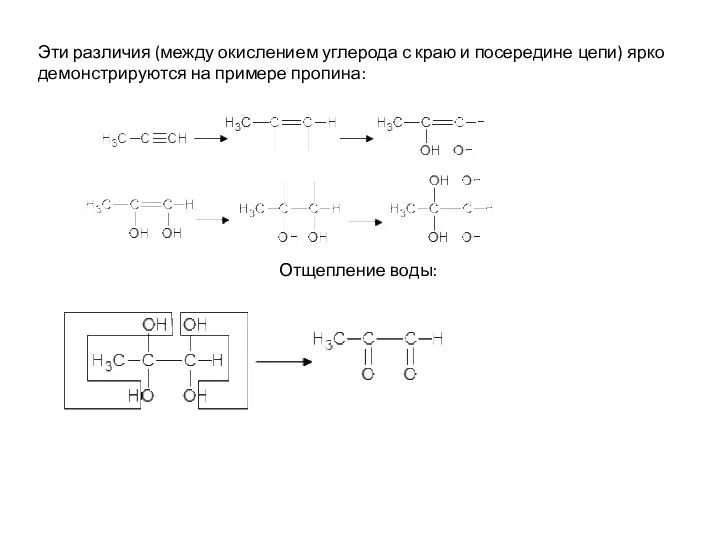
- 36. Эти различия (между окислением углерода с краю и посередине цепи) ярко демонстрируются на примере пропина: Отщепление
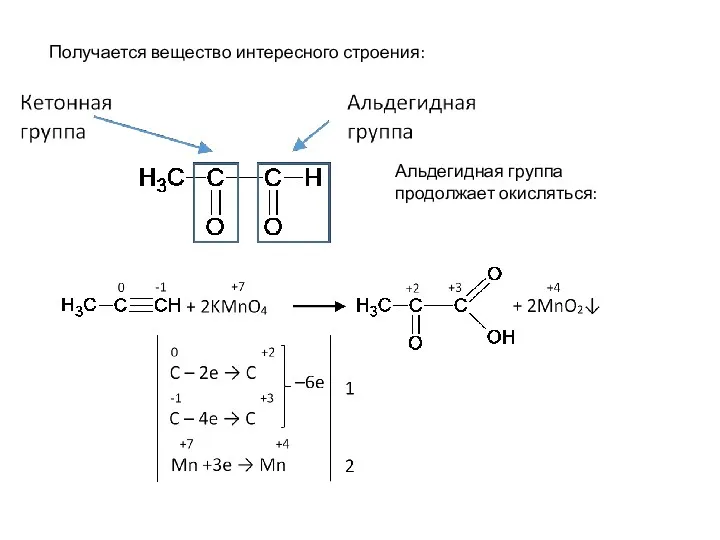
- 37. Получается вещество интересного строения: Альдегидная группа продолжает окисляться:
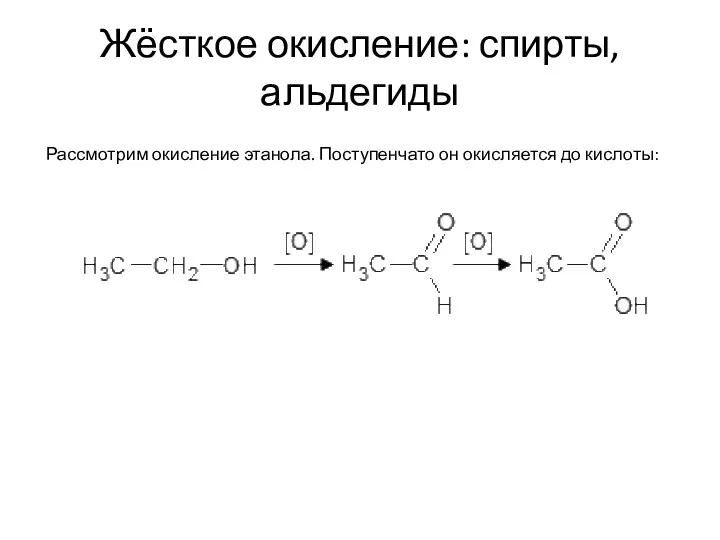
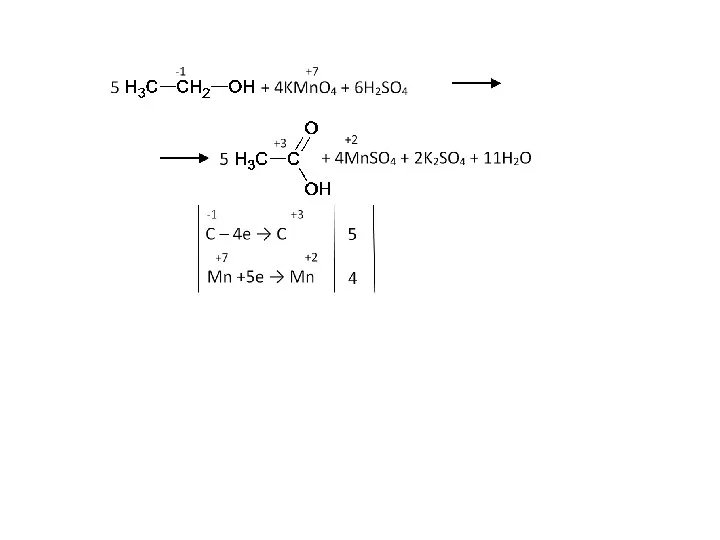
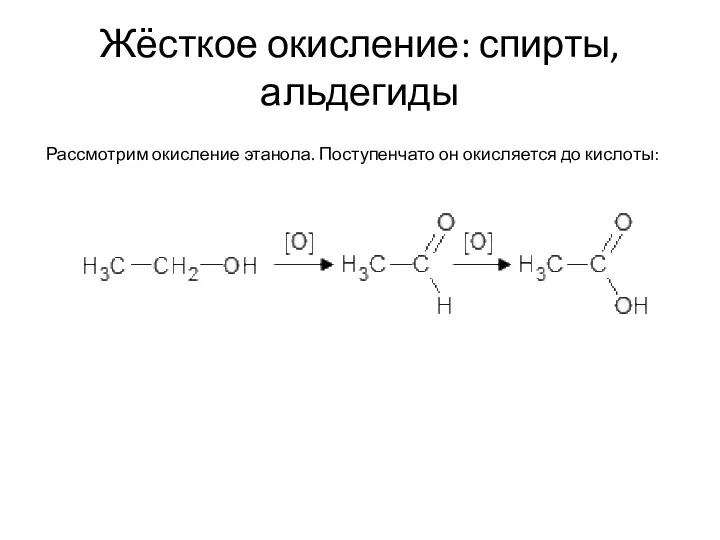
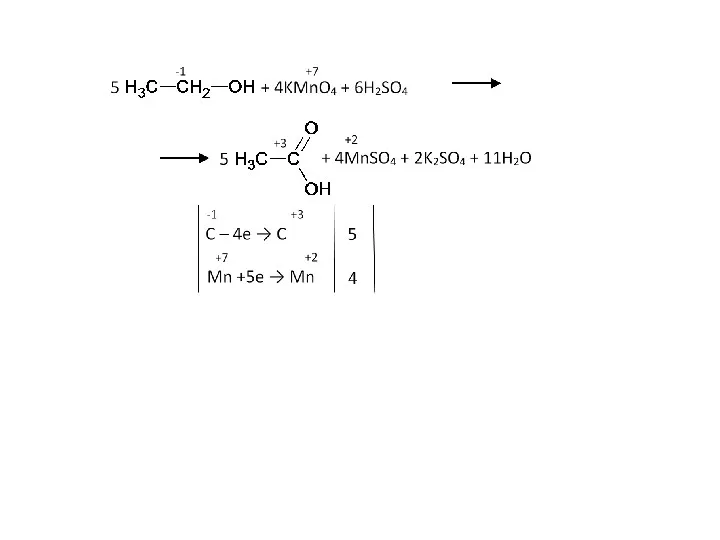
- 38. Жёсткое окисление: спирты, альдегиды Рассмотрим окисление этанола. Поступенчато он окисляется до кислоты:
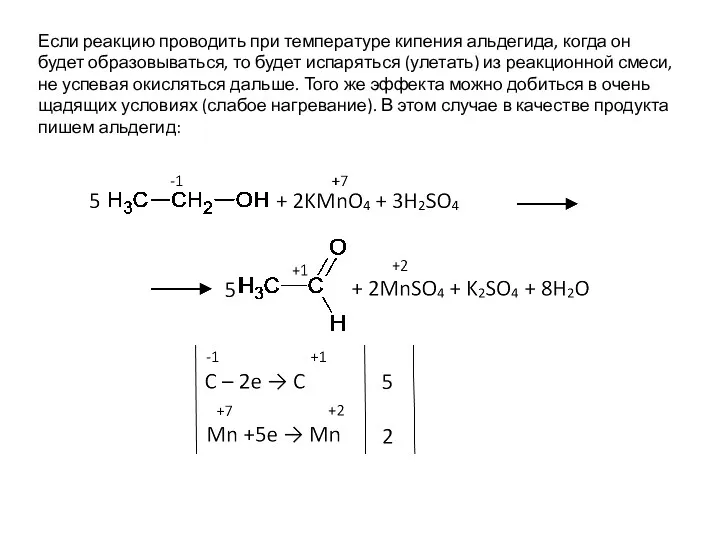
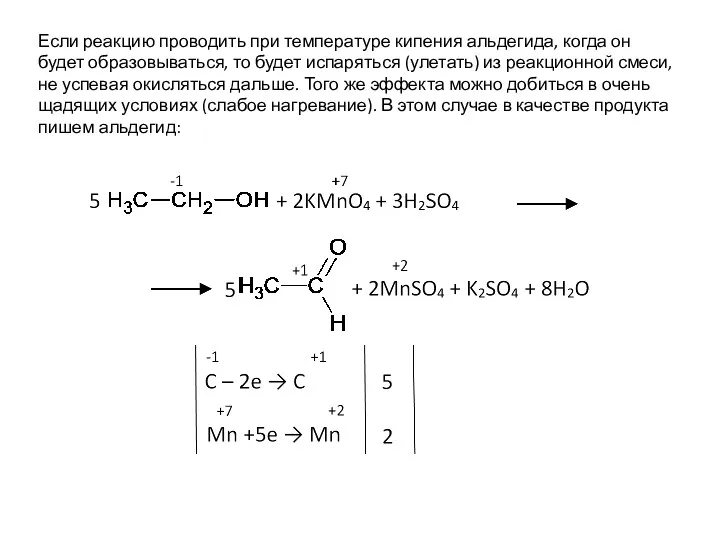
- 40. Если реакцию проводить при температуре кипения альдегида, когда он будет образовываться, то будет испаряться (улетать) из
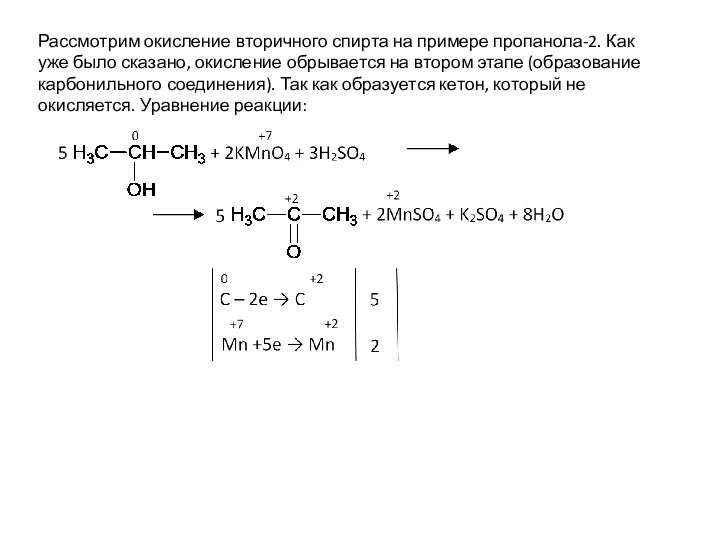
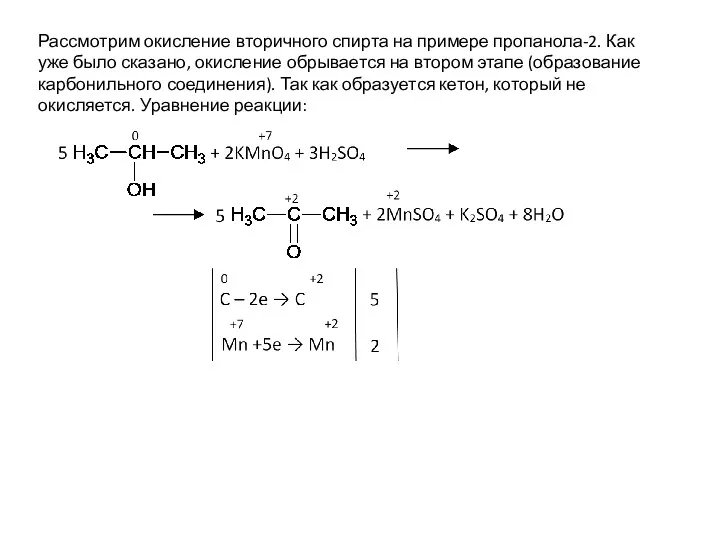
- 41. Рассмотрим окисление вторичного спирта на примере пропанола-2. Как уже было сказано, окисление обрывается на втором этапе
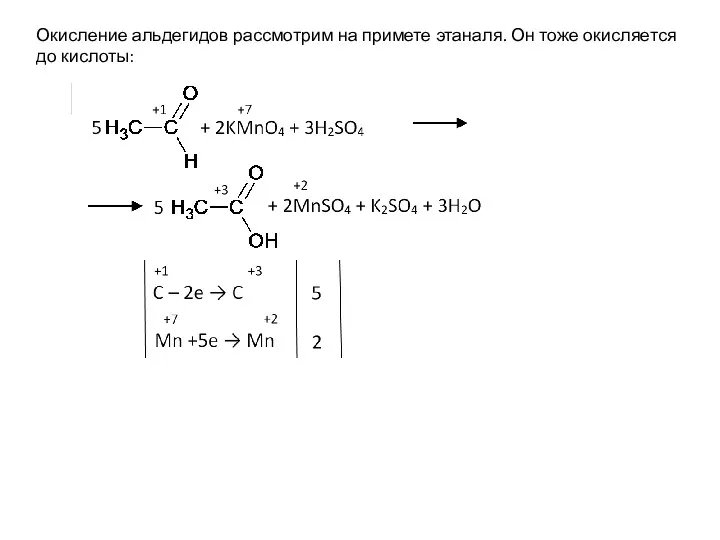
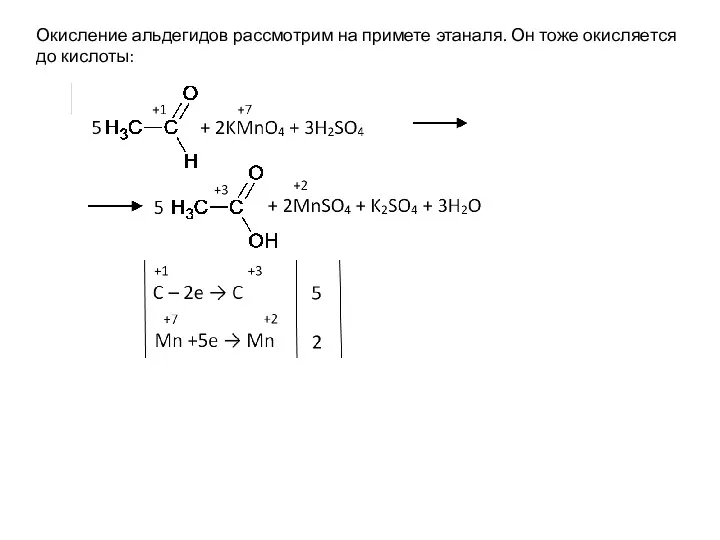
- 42. Окисление альдегидов рассмотрим на примете этаналя. Он тоже окисляется до кислоты:
- 44. Жёсткое окисление: спирты, альдегиды Рассмотрим окисление этанола. Поступенчато он окисляется до кислоты:
- 46. Если реакцию проводить при температуре кипения альдегида, когда он будет образовываться, то будет испаряться (улетать) из
- 47. Рассмотрим окисление вторичного спирта на примере пропанола-2. Как уже было сказано, окисление обрывается на втором этапе
- 48. Окисление альдегидов рассмотрим на примете этаналя. Он тоже окисляется до кислоты:
- 50. Жёсткое окисление кратной связи
- 53. Абсолютно тот же самый принцип при окислении соединений с тройной связью (только окисление идет сразу с
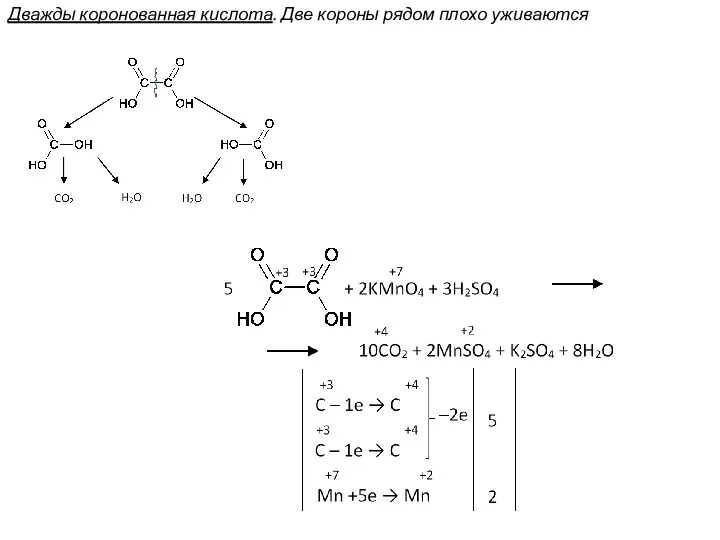
- 55. Дважды коронованная кислота. Две короны рядом плохо уживаются
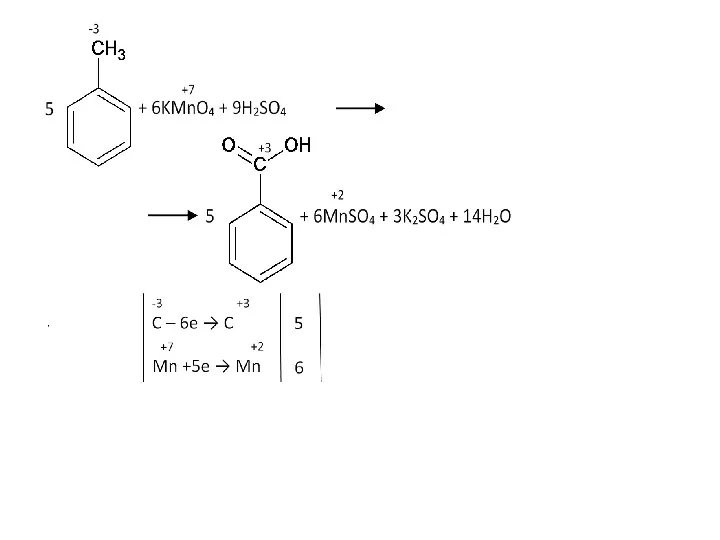
- 56. Бензольное кольцо само не разрушается, и остается целым до конца, разрыв связи происходит в радикале. Окисляется
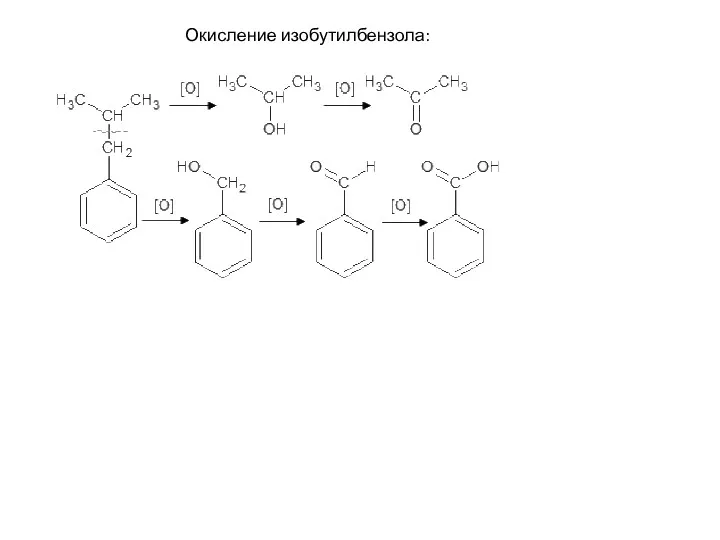
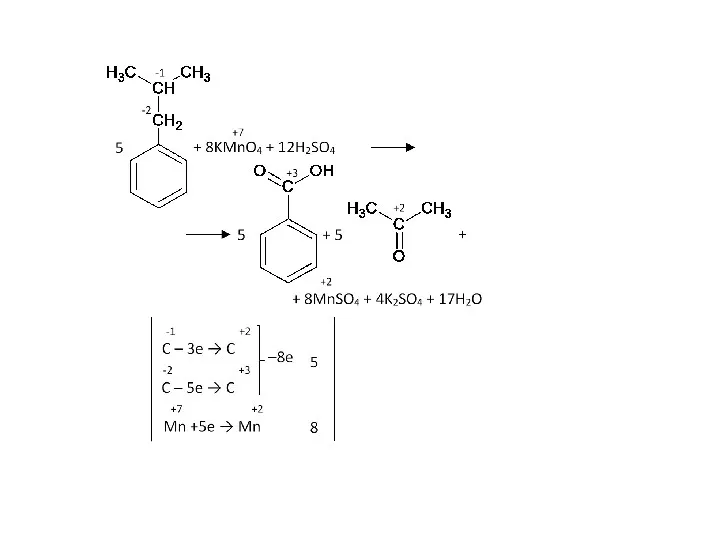
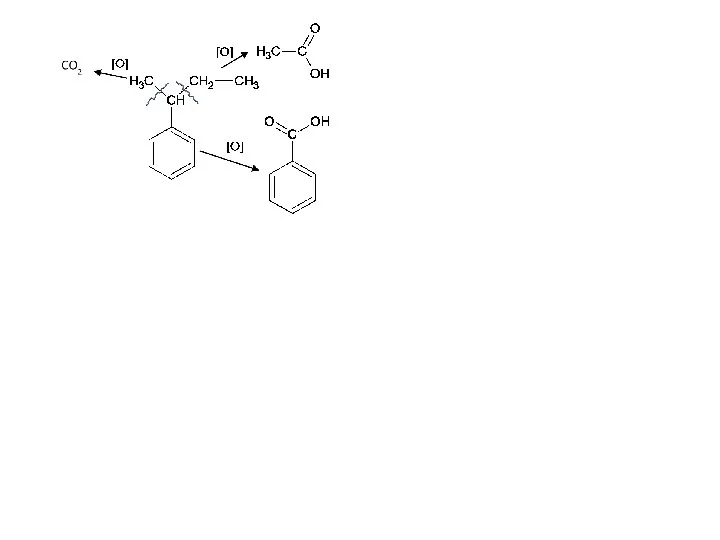
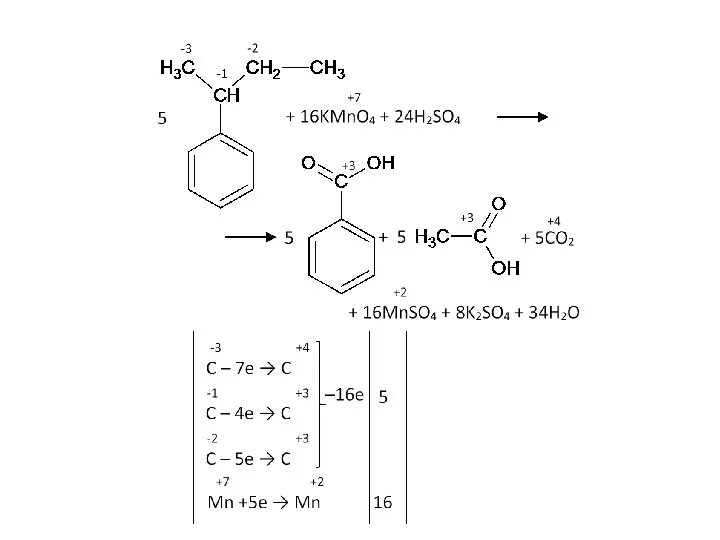
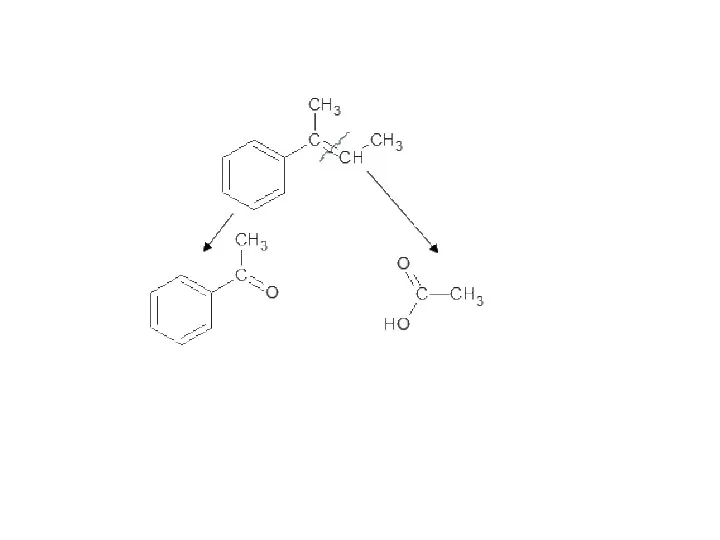
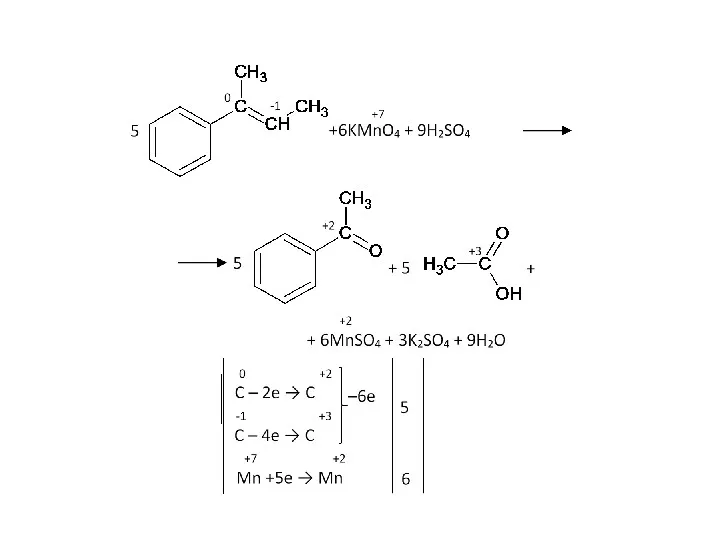
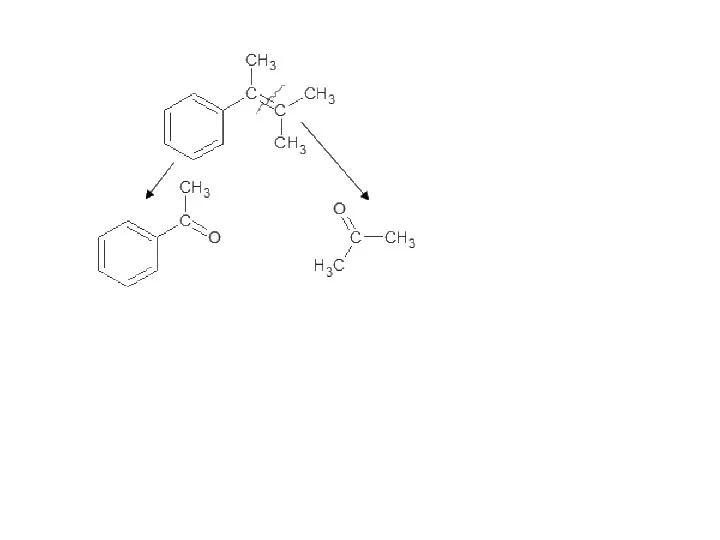
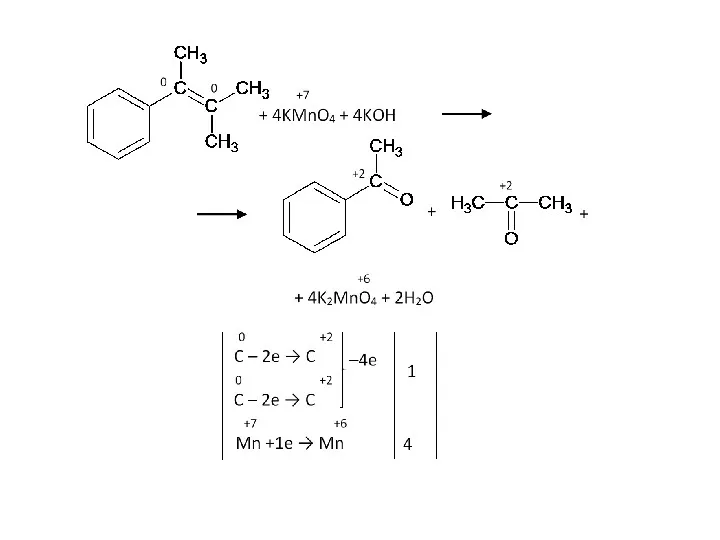
- 58. Окисление изобутилбензола:
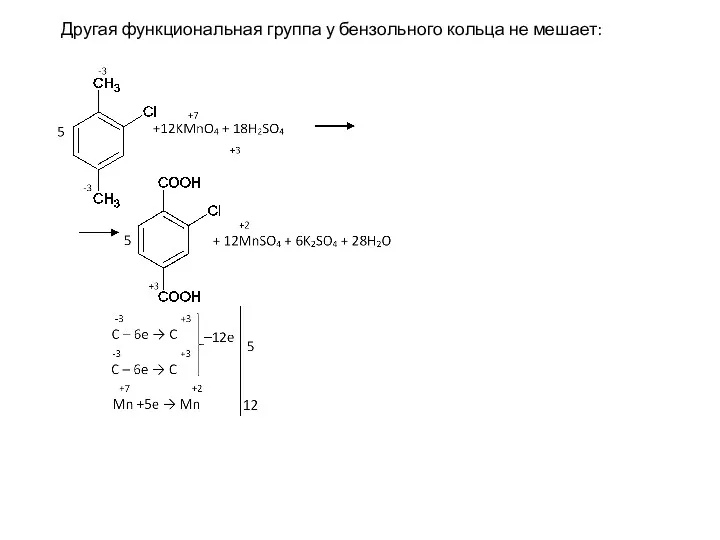
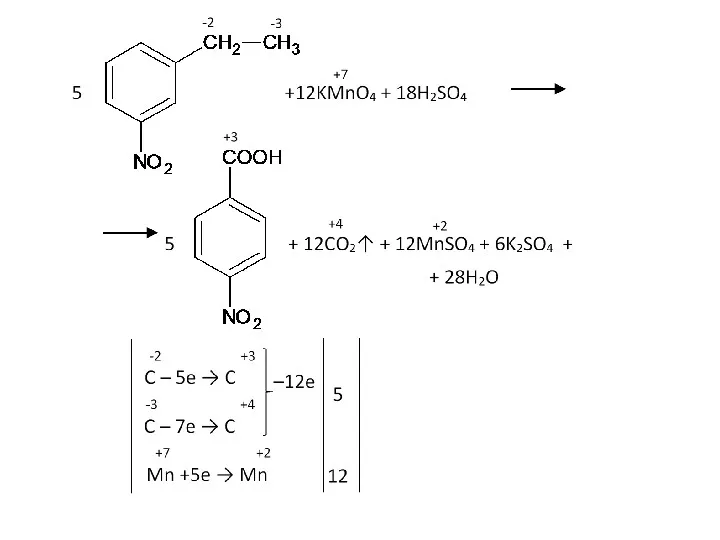
- 63. Другая функциональная группа у бензольного кольца не мешает:
- 65. Алгоритм «как записать реакцию жесткого окисления перманганатом в кислой среде»: 1. Записать исходные вещества (органика +
- 66. Окислительно-восстановительные реакции с участием дихромата (бихромата) калия. Бихромат не имеет такого большого разнообразия реакций окисления органики
- 67. Если проводить окисление спирта при температуре кипения альдегида, то он будет уходить их реакционной смеси, не
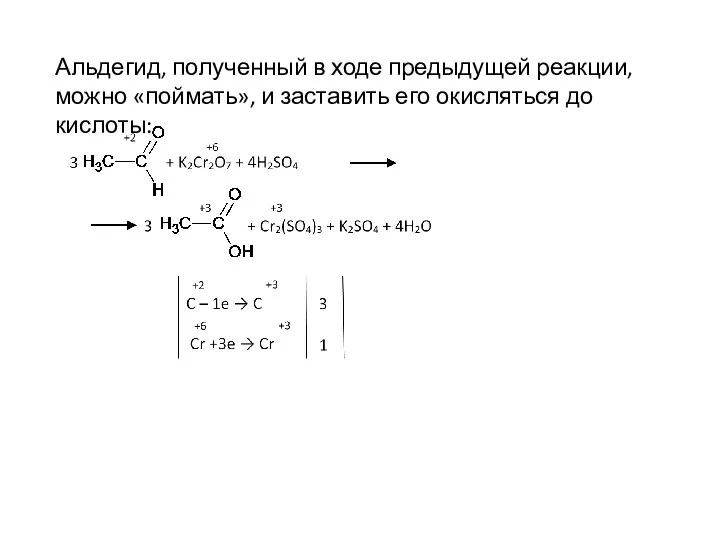
- 68. Альдегид, полученный в ходе предыдущей реакции, можно «поймать», и заставить его окисляться до кислоты:
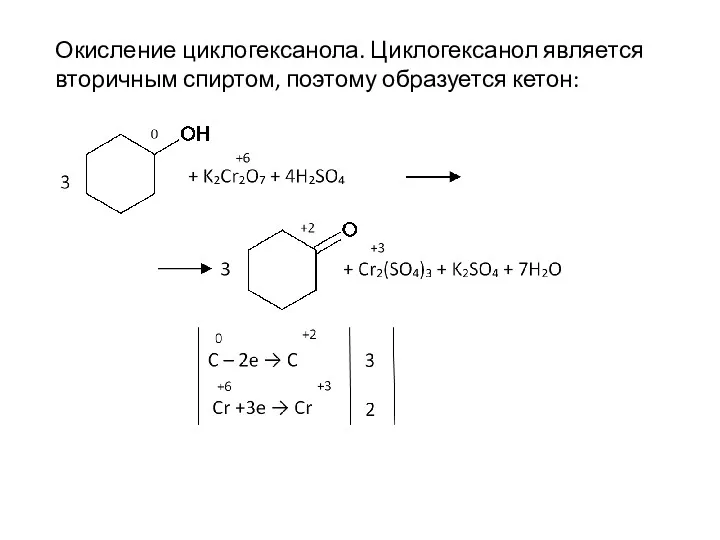
- 69. Окисление циклогексанола. Циклогексанол является вторичным спиртом, поэтому образуется кетон:
- 71. Некоторые неадекватности в в ЕГЭ. Приведённые правила касательно ЖЁСТКОГО окисления гомологов бензола при условии наличия в
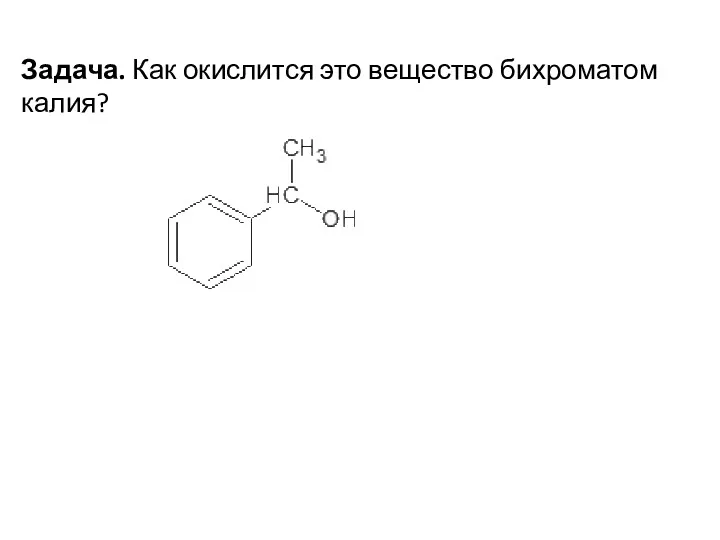
- 72. Задача. Как окислится это вещество бихроматом калия?
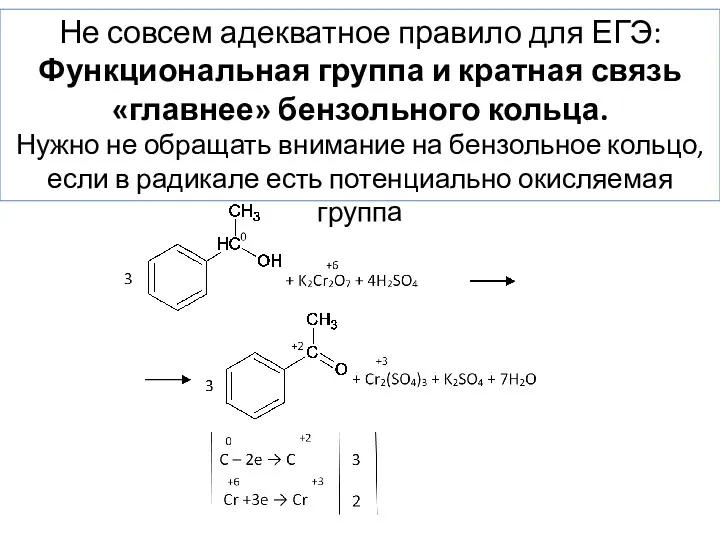
- 73. Не совсем адекватное правило для ЕГЭ: Функциональная группа и кратная связь «главнее» бензольного кольца. Нужно не
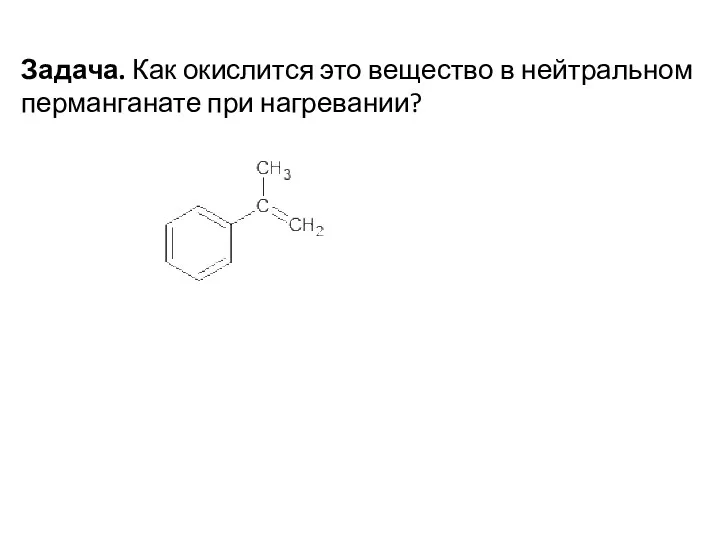
- 74. Задача. Как окислится это вещество в нейтральном перманганате при нагревании?
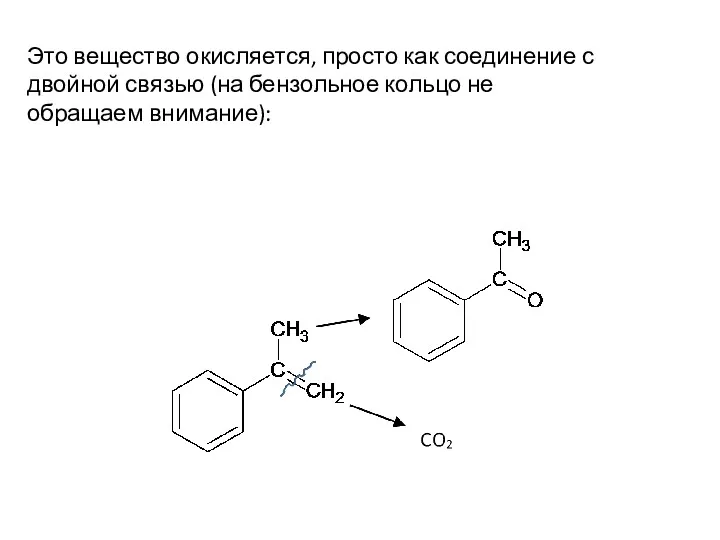
- 75. Это вещество окисляется, просто как соединение с двойной связью (на бензольное кольцо не обращаем внимание):
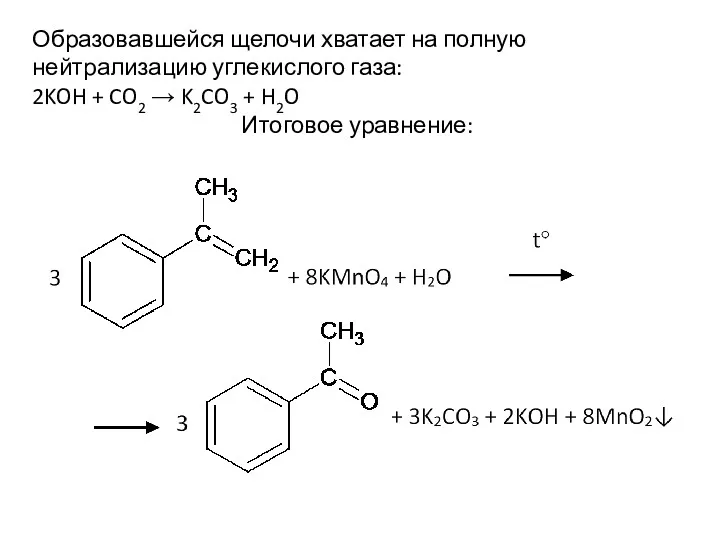
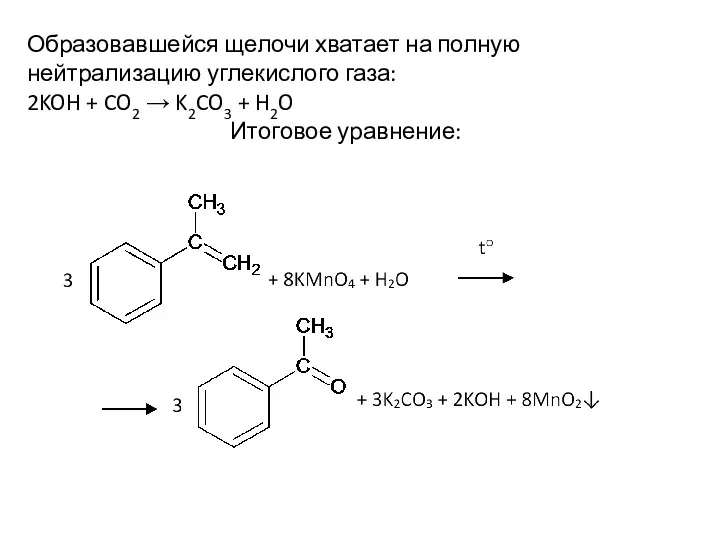
- 77. Образовавшейся щелочи хватает на полную нейтрализацию углекислого газа: 2KOH + CO2 → K2CO3 + H2O Итоговое
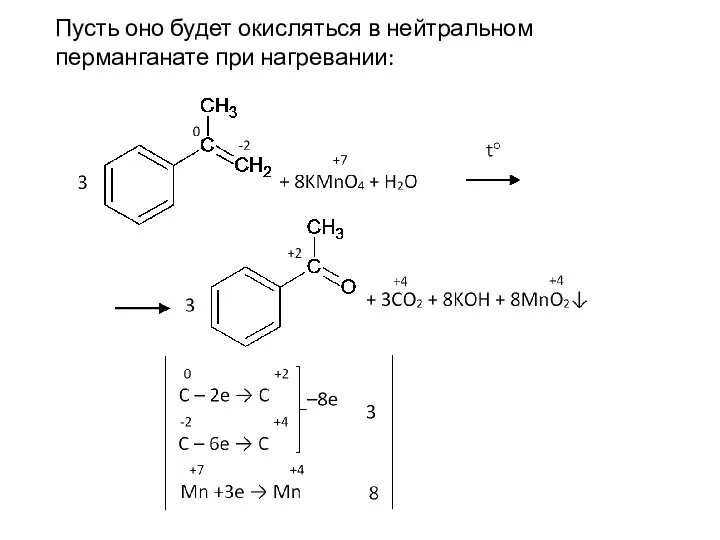
- 78. Пусть оно будет окисляться в нейтральном перманганате при нагревании:
- 79. Образовавшейся щелочи хватает на полную нейтрализацию углекислого газа: 2KOH + CO2 → K2CO3 + H2O Итоговое
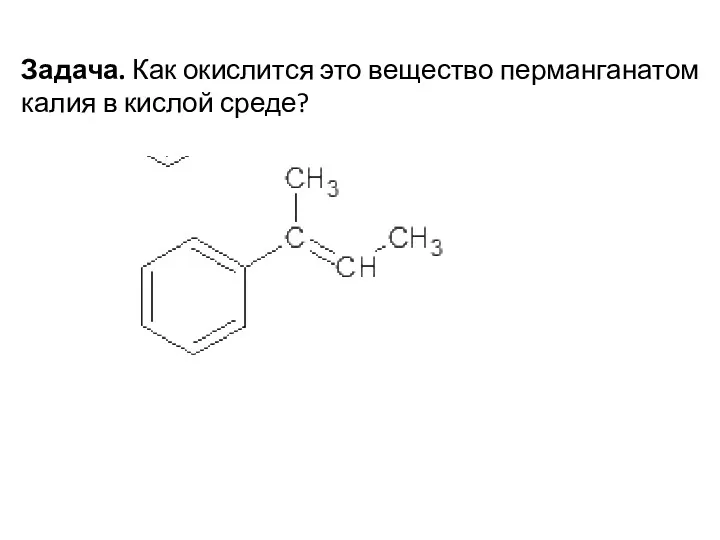
- 80. Задача. Как окислится это вещество перманганатом калия в кислой среде?
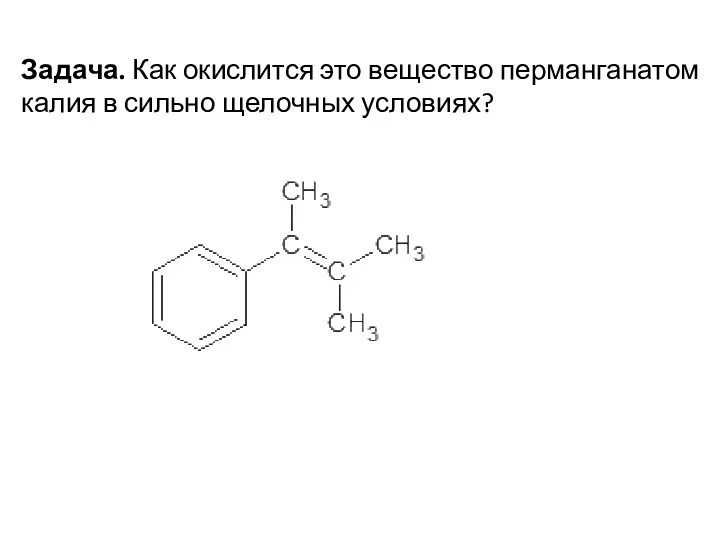
- 83. Задача. Как окислится это вещество перманганатом калия в сильно щелочных условиях?
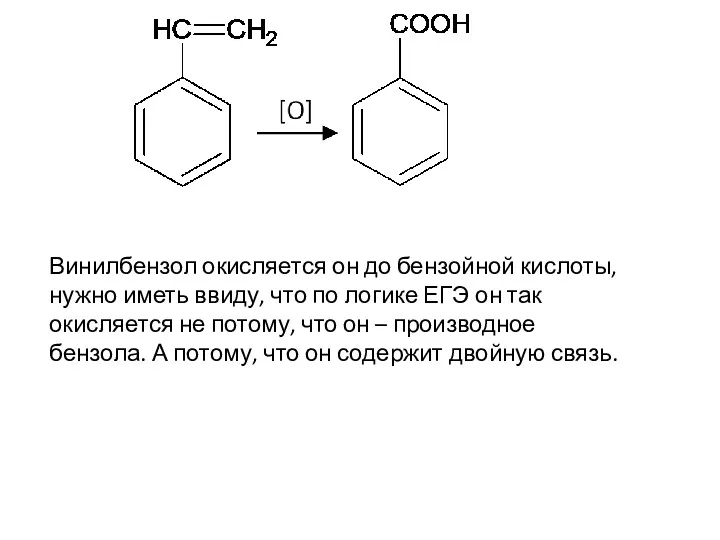
- 86. Винилбензол окисляется он до бензойной кислоты, нужно иметь ввиду, что по логике ЕГЭ он так окисляется
- 87. Второе несоответствие ЕГЭ реальности При избытке окислителей в любой среде первичные спирты превращаются в карбоновые кислоты
- 88. Ещё одно отличие от ЕГЭ: третичные спирты окисляютя, но в кислотных (а не щелочных) условиях. Процесс
- 89. Ещё одно отличие от ЕГЭ: На сам
- 90. СH3-CH2-OH + CuO → CH3-CH=O + Cu + H2O t
- 109. Скачать презентацию







![СH3-CH=CH2 → [O] Тренировка. Как происходит окисление марганцовкой в мягких условиях CH2=CH-CH2-CH3 CH3-CH=CH-CH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/297827/slide-13.jpg)








































 Связь структуры и функций химических соединений. Задачи QSAR
Связь структуры и функций химических соединений. Задачи QSAR Электронные представления в химии
Электронные представления в химии Элемент свинец Рb
Элемент свинец Рb Использование кубового остатка ректификации стирола в процессах получения нефтяных дорожных битумов
Использование кубового остатка ректификации стирола в процессах получения нефтяных дорожных битумов Классификация, номенклатура, изомерия органических соединений
Классификация, номенклатура, изомерия органических соединений Хімія у створенні нових матеріалів та побуті
Хімія у створенні нових матеріалів та побуті Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс Характеристика элементов VIIA-группы (галогены)
Характеристика элементов VIIA-группы (галогены) Возраст в геологии
Возраст в геологии Химические свойства металлов
Химические свойства металлов Химические свойства основных неорганических соединений в свете ЭД и ОВР (9 класс)
Химические свойства основных неорганических соединений в свете ЭД и ОВР (9 класс) Литий
Литий Химические элементы
Химические элементы Si - Silicon. Distribute Properties
Si - Silicon. Distribute Properties Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Аминокислоты. Белки
Аминокислоты. Белки Кремний
Кремний Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Химическая промышленность
Химическая промышленность Соли как производные кислот и оснований
Соли как производные кислот и оснований Спирты
Спирты Алкены. Строение алкенов
Алкены. Строение алкенов Производство метанола. Физико-химические основы синтеза метанола. Современные катализаторы
Производство метанола. Физико-химические основы синтеза метанола. Современные катализаторы Жидкие кристаллы
Жидкие кристаллы Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность
Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность Химическая лаборатрия. Химический состав растений
Химическая лаборатрия. Химический состав растений Предельные углеводороды ( 10 класс )
Предельные углеводороды ( 10 класс ) Алюминий IIIА топ элементі
Алюминий IIIА топ элементі